铜基载氧体的焦炉煤气化学链燃烧特性
范心瑜,卢春强,左慧琮,李志强,江 磊,李孔斋
(1.昆明理工大学 冶金与能源工程学院,云南 昆明 650093;2冶金节能减排教育部工程研究中心,云南 昆明 650093)
0 引 言
焦炉煤气(COG)是炼焦副产品,包括60% H2、28% CH4、9% CO和3% CO2及少量N2、C2烃类和硫化物,其中可燃气体体积分数高达96%[1-2]。COG广泛用于制合成气、发电、制化工原料、直接还原铁、燃料、制氢等领域[3-6]。COG作为燃料时,由于气体成分不稳定且存在少量杂质,导致燃烧不充分和热值较低等问题。化学链燃烧技术(CLC)通过避免燃料和空气直接接触降低碳捕集成本,无需额外能源产生高纯CO2[7],可直接用做下游化工合成原料。
CLC反应器一般由燃料反应器(FR)和空气反应器(AR)组成。载氧体(OC)在2个反应器之间通过氧的释放与吸收,实现氧化还原循环。在FR中,OC与H2、CH4、CO等燃料气体反应生成CO2和H2O,CO2可通过冷凝分离,OC被还原,在AR中,被还原的OC通过氧化性气体进行补氧使载氧体再生。目前,CLC工艺研究较多的载氧体(OCs)包括铁[8-9]、钴[10-11]、镍[12-13]、铜[13-14]、锰[15-16]等金属氧化物。载氧体除要求具有较高的燃烧性能以外,良好的循环稳定性也很关键。铜基载氧体具有较高的反应速率和氧转移能力[17],但在高温反应条件下热稳定性不强,ZEDAN等[18]发现在CeO2固溶体中掺杂6% CuO明显提高了CeO2催化CH4的活性,CeO2在585 ℃仅转化25% CH4,掺杂铜后T50=502 ℃,T90=556 ℃,显著降低CH4转化温度。SAHA等[19]以褐煤作为燃料,发现CuO载氧体1 223 K烧结而失活,但降低反应温度后在1 073 K时仍保持96%的活性,表明CuO热稳定性较差。LUIS等[20]通过热重分析法发现CuO作为载氧体时,纯CuO的氧化还原速率随循环次数增加而迅速下降。而在TiO2和SiO2载体上负载Cu后,制得的Cu基载氧体反应性较高;CuO/Al2O3载氧体在1 073 K下进行200 h化学链燃烧试验[21],在整个反应中表现出良好的反应性能。结果表明,负载于惰性载体可在一定程度解决Cu基载氧体热稳定性较差的问题。WANG等[22]研究了Zr掺杂对CuO载氧体释氧性能的影响机理。研究表明,掺杂Zr的CuO比纯CuO氧释放容量增大,具有更低的氧空位能垒,从而具有更高的反应活性。CAI等[23]通过微波辅助共沉淀法制备了Cu-Ce0.8Zr0.2O2,发现其中活性Cu均匀分散且与Cu-Ce0.8Zr0.2O2有强烈的相互作用,从而起到稳定铜物种的作用。综上所述铜基载氧体用于化学链燃烧性能优异,而铈锆复合氧化物具有高储存释放氧的能力与热稳定性[24],还具有稳定铜物种、促进晶格氧迁移率、提高活性的作用,因此CuO/CexZr1-xO2用于COG化学链燃烧潜力较好,有助于拓宽COG化学链燃烧铜基载氧体体系。
笔者通过添加Ce-Zr-O固溶体有效增强CuO载氧体在COG化学链燃烧的反应性能,运用XRD、SEM、Raman、XPS对铜基载氧体结构进行表征,探究COG化学链燃烧反应性能及循环稳定性。
1 试 验
1.1 载氧体制备
采用溶胶凝胶法制备了一系列x(%)CuO/Ce-Zr-O(x=0、30、50、70、90、100)载氧体。具体制备步骤如下:① 将一定量金属前驱盐(Cu(NO3)2·3H2O、Ce(NO3)3·6H2O、Zr(NO3)2·5H2O)按比例加入去离子水中在80 ℃水浴温度下搅拌;② 搅拌20 min后向混合盐溶液加入柠檬酸,快速搅拌直至成凝胶状,其中柠檬酸与金属离子物质的量比为1.1∶1.0;③ 将胶状物在120 ℃干燥12 h,取出烘干的样品研磨均匀;④ 研磨后前驱体放入马弗炉,以2 ℃/min升温至350 ℃煅烧2 h后,以相同升温速率升温至800 ℃焙烧 2 h;⑤ 载氧体制备成粒度0.5~0.8 mm颗粒。得到一系列Ce∶Zr物质的量比为2∶1时,(Ce∶Zr)∶Cu物质的量比为1∶9(90CuO/CZ)、3∶7(70CuO/CZ)、5∶5(50CuO/CZ)、7∶3(30CuO/CZ)及(Ce∶Cu)物质的量比为1∶9(90CuO/CeO2),(Zr∶Cu)物质的量比为1∶9(90CuO/ZrO2),CuO和Ce0.67Zr0.33O2(CZ)等载氧体。
1.2 载氧体物理化学表征
载氧体物相成分测定采用日本理学Mini Flex600型X射线粉末衍射仪(XRD),Cu靶(λ=0.154 06 nm),工作电压为40 kV,电流为15 mA,扫描范围为2θ=10°~90°,扫描速度为5 (°)/min,步长为0.02°,驻留时间为0.3 s。
拉曼光谱采用Thermo Fisher DXRxi型显微拉曼光谱仪测定。激光器波长为532 nm。激光功率为4.0 mW,频率为200~1 000 cm-1。
X射线光电子能谱(XPS)试验在Thermo Scientific K-Alpha仪器上进行,加速电压为15 kV,样品表面电荷被校正为C 1s=284.8 eV作为内部标准。
1.3 微观形貌分析
采用扫描电子显微镜(SEM)NOVA NANOSEM450 仪器观察载氧体反应前后的形态,使用能量色散X射线光谱法(EDS)获得元素的分布图像。加速电压为3 kV。
1.4 程序升温还原
氢气程序升温还原(H2-TPR)在ChemiMaster 8320 化学吸附仪(北京华璞恒创仪器有限公司)进行。将0.3 g载氧体放入U型反应器,Ar气氛吹扫,在10% H2/Ar气氛中由室温加热至900 ℃,升温速率10 ℃/min,气体流量30 mL/min。
甲烷程序升温还原(CH4-TPR)是在实验室搭建固定床设备上进行,装置如图1所示。将1 g载氧体放入反应管,在N2气氛(99.9%,100 mL/min)下吹扫10 min后,通入5% CH4/N2(100 mL/min),温度由100 ℃升温至900 ℃,升温速率为10 ℃/min。

图1 载氧体活性评价装置
CO程序升温还原(CO-TPR)在实验室搭建固定床设备进行,装置如图1所示。将1 g载氧体放入反应管中,在N2气氛(99.9%,100 mL/min)下吹扫10 min后,通入10% CO/N2(100 mL/min),温度由100 ℃升温至900 ℃,升温速率为10 ℃/min。
焦炉煤气升温还原(COG-TPR)基于实际COG主要组分[1],配制得到实验室用COG(0.9% CO、0.3% CO2、2.8% CH4、6% H2、N2为平衡气)。载氧体和焦炉煤气程序升温还原试验在固定床反应系统进行,气体流量为200 mL/min,载氧体用量1 g,以10 ℃/min速率由室温升温至 900 ℃。
1.5 载氧体恒温反应活性评价
1.5.1 固定床试验
载氧体活性评价在固定床反应系统中进行。装置如图1所示,整体由配气系统、反应系统、检测系统3部分组成。反应系统由石英管和控温电弧炉组成,使用烟气分析仪实时检测尾气CH4、H2、O2、CO和CO2变化。
1.5.2 恒温氧化还原反应和循环试验
载氧体用量为2 g,恒温时间10 min,所有样品均在800 ℃进行COG恒温测试。步骤如下:① 程序设置由室温升温至800 ℃,升温速率10 ℃/min,升温过程通入N2为保护气,清除管路杂质;② 升温至800 ℃,COG以200 mL/min流速进入反应管,与载氧体反应;③ 吹入N2吹扫;④ 反应管中通入10% O2/N2,流速200 mL/min。
1.5.3 载氧体的性能评价指标
CH4转化率X(CH4):
(1)
式中,Cin(CH4)、Cout(CH4)分别为CH4进气和出气时体积分数,%;Fin为进管时气体流量,mL/min;Fout为出管时气体流量,mL/min。
CO2产率Y(CO2):
(2)
式中,Cout(CO2)为CO2出气时体积分数,%;R为理想状态下气体摩尔体积,22.4 L/moL;moxygen carrier为每次反应所需载氧体质量,g。
CO2捕集率η(CO2):
(3)
式中,Cout(CO)为CO出气时的体积分数,%。
2 结果与讨论
2.1 载氧体物理化学表征
为确定载氧体的晶体结构,通过XRD分别对x(%)CuO/Ce-Zr-O (x=0、30、50、70、90、100)、90 CuO/CeO2和90CuO/ZrO2载氧体样品进行物相分析,结果如图2所示。x(%)CuO/Ce-Zr-O (x=30、50、70、90)及90CuO/CeO2、90CuO/ZrO2载氧体均具有明显CuO特征衍射峰,分别存在单独的Ce0.67Zr0.33O2、CeO2和ZrO2特征峰。相比纯CeO2,样品中CZ特征衍射峰向高角度方向迁移(区域放大图)。这是由于Zr4+半径(0.084 nm)小于Ce4+半径(0.097 nm)[25],Zr4+可进入CeO2占据Ce4+的立方晶格,形成铈锆固溶体。ROOBERTA等[26]研究CeO2-ZrO2结构性质,发现Zr4+完全固溶到CeO2晶格中形成更多缺陷和晶格应力,提高耐温性,增加氧空位,提高体相氧迁移和扩散速率,进而提高燃料氧化能力。

图2 不同新鲜载氧体XRD图与Ce0.67Zr0.33O2主特征峰区域放大图
随CuO含量增多,峰宽变窄,峰强增加,其他特征峰位置无明显变化,说明载氧体上CuO并未与Ce0.67Zr0.33O2形成Cu-Ce-Zr固溶体[27]。文献[28]报道煅烧温度500 ℃时,制备的Cu-Ce-Zr氧化物中Cu2+进入Ce-Zr晶格,铜氧化物以Cu-Ce-Zr固溶体和CuO两种形式存在,活性试验表明形成的Cu-Ce-Zr固溶体的载氧体H2还原峰温度较高,说明Cu-Ce-Zr固溶体释放氧能力较差,不宜作为载氧体。浸渍法制备的催化剂,Cu-Ce-Zr-4样品H2-TPR中主还原峰与CuO还原峰温度相近,发现CuO分散度低,形成大块CuO(1~3 μm),难以还原,不利于CO氧化[29]。
为进一步研究晶体结构,对不同样品进行拉曼光谱测试,如图3所示。268 cm-1处振动峰对应CuO结构,321 cm-1处对应ZrO2结构[30],453 cm-1处对应CeO2面心立方结构F2g振动峰,由于Zr4+固溶到CeO2中发生晶格畸变,使CZ振动的吸收峰发生蓝移,与XRD分析一致[31]。

图3 不同载氧体的拉曼图谱
CeO2、ZrO2、Ce0.67Zr0.33O2的加入对Cu结构无明显影响。添加CuO后,由于铜与铈锆之间的强相互作用[32],x(%)CuO/Ce-Zr-O (x=30、50、70、90)和90 CuO/CeO2中CeO2的F2g峰相较CZ样品发生蓝移,且在617 cm-1处出现新的振动峰,这归因于CeO2中部分Ce4+转变为Ce3+形成氧空位[28]。氧气吸附在氧空位上可降低表面释氧的吉布斯自由能,平衡化学价态,形成表面活性氧物种[33]。Zr4+加入CeO2晶格也可产生电荷平衡的氧缺陷[28],氧空位对提高载氧体活性至关重要。
XPS谱图如图4所示。由图4(a)可知,O 1s XPS图谱均由2个峰组成,其中529 eV的OⅠ归因于晶格氧(O2-),而532 eV的OⅡ则归因于表面吸附氧[28]。文献[34-35]报道表面吸附氧易与CH4反应生成CO2和H2O。OⅡ/OⅠ比值与氧缺陷浓度成正比。随CuO负载量增加,载氧体OⅡ/OⅠ比例增加,吸附氧在90CuO/CZ催化剂中最大,促进燃烧反应进行。由图4(b)可知,Cu 2p中结合能分别为930~936、950~958 eV处Cu 2p3/2和Cu 2p1/2的2个主峰,并在938~945 eV处出现卫星弱特征峰。高结合能Cu 2p3/2和卫星峰出现表明Cu在CuO中以Cu2+形式存在[36]。由图4(c)可知,Ce的XPS曲线显示4对3d5/2-3d3/2的自旋轨道分裂峰,用v和u表示,其中v(882.48 eV)、v″(889.5 eV)、v‴(898.4 eV)归属于Ce4+的3d5/2轨道,u(901.6 eV)、u″(908.1 eV)、u‴(916.7 eV)归属于Ce4+的3d3/2轨道,u′和v′是Ce 3d5/2和Ce 3d3/2中Ce3+离子特征峰[35]。表明样品中铈以Ce4+和Ce3+两种氧化态共存。Ce3+离子存在会形成氧缺陷,Ce3+/Ce4+比值越高表明可能具有最丰富的氧空位。Ce物种主要以CeO2形式存在,CeO2中Ce3+占比15%[33]。根据XPS结果计算载氧体表面元素组成见表1,Ce3+占比增至19%,由于Zr4+取代Ce4+,Ce4+(0.097 nm)离子自发转变为较大Ce3+(0.110 nm)补偿晶格收缩[37]。90CuO/CZ中Ce3+/Ce4+比例最大,产生较多氧空位以增加吸附氧量。由图4(d)可知,Zr 3d图谱中Zr 3d5/2和Zr 3d3/2的结合能分别为181.9和184.6 eV,分别为ZrO2中的Zr4+与亲电子羟基基团结合的Zr4+物种[38],说明以Zr4+形式存在[39]。Zr 3d3/2和Zr 3d3/2峰的结合能不随CuO负载量的增加而变化。

表1 根据XPS结果计算载氧体表面元素组成

图4 XPS谱图
2.2 程序升温还原
焦炉煤气成分复杂,通过H2-TPR、CO-TPR、CH4-TPR研究不同还原组分在焦炉煤气转化中的竞争效应。H2-TPR用于探究载氧体的释氧特性,载氧体H2-TPR图谱如图5所示。CuO还原峰集中在200~400 ℃。相较CuO样品,加入Ce0.67Zr0.33O2、CeO2和ZrO2降低载氧体还原温度,表明铈锆与铜之间相互作用增强其低温释氧性能[40-41]。单独添加CeO2、ZrO2时,分别显示低温还原峰、高温还原峰。从还原峰面积分析,添加CZ后,载氧体还原性更强。随CuO负载量增加,所有载氧体整体还原峰向较高温度移动。x(%)CuO/CZ(x=30、50、70、90)在200~300 ℃出现α和β两个峰。Cu/Ce[42]和Cu/Zr/Ce[28]氧化物体系H2-TPR谱通常由2个重叠还原峰组成。低温还原峰归属于铈锆产生相互作用的高分散态铜物种,而高温还原峰则归属于体相铜物种及分散不均匀大颗粒[43]。这2个强还原峰是不同类型铜物种与CZ表面氧的共同还原[27]。
CO-TPR过程中CO和CO2随温度变化如图6所示。CuO、CZ转化初始温度300 ℃。相较纯CuO,添加Ce0.67Zr0.33O2、CeO2和ZrO2,CO初始还原温度分别为200、150、150 ℃,铈锆提高CuO对CO氧化能力[36,44]。单独CeO2、ZrO2做载体时CO无法完全转化。负载CZ的载氧体与CO反应温度远低于与H2反应温度,说明CuO/CZ更易被CO还原。

图6 不同载氧体CO-TPR曲线
CH4与不同载氧体之间的程序升温反应(CH4-TPR)如图7所示。x(%)CuO/CZ(x=30、50、70、90、100)、90CuO/CeO2和90CuO/ZrO2载氧体在400 ℃开始转化,与CH4反应前期主要是主要产生CO2和H2O。CH4氧化产生的CO2和H2O的强度随温度升高急剧增加。温度增至800 ℃,表面吸附氧耗尽,不再产生CO2,CO、H2继续升高。CuO未负载时,CZ在600 ℃开始转化,表明铜的加入能在较低温度下实现低浓度CH4转化[45]。与CO-TPR和H2-TPR相比,CH4反应温度明显更高。这表明CuO/CZ与COG的反应条件应与CH4氧化反应条件一致,保证所有组分(CO、H2和CH4)相对较高的转化率。

图7 不同载氧体CH4-TPR曲线
载氧体与焦炉煤气程序升温还原(COG-TPR)曲线如图8所示。整个还原过程可分为2个阶段,200~700 ℃产物可归因于还原性气体和样品中活性较高的氧物种发生反应。200 ℃时H2和CO浓度降低、CO2浓度增加,这是由于CuO在200 ℃附近优先被H2和CO还原生成H2O和CO2。而H2、CO浓度降低和CO2浓度升高的反应窗口区间随x(%)CuO/CZ(x=30、50、70、90)中CuO降低而收窄。CuO载氧体反应窗口区间比x(%)CuO/CZ载氧体明显宽化,温度升高,CuO氧化CO能力减弱,CO2浓度降低。
第2阶段在700~900 ℃,CH4与样品可能发生部分氧化反应和裂解反应。700 ℃附近时,x(%)CuO/CZ(x=30、50、70、90)、90CuO/CeO2、90CuO/ZrO2载氧体CH4浓度开始降低,H2和CO浓度开始升高,CH4开始发生部分氧化反应,生成CO和H2使各组分浓度变化。CuO和CZ各组分含量未变化。CuO载氧体在500~600 ℃内CH4浓度明显降低,90CuO/CZ样品在升温过程中趋势相同。
800 ℃时,对比CO-TPR、H2-TPR,2种还原性气体完全转化。在CH4-TPR和COG-TPR中生成大量H2,说明CH4发生部分氧化反应。800 ℃时,COG转化到最大值。由COG-TPR可知,H2在150 ℃左右开始转化,相比H2-TPR,还原温度降低。CO开始转化温度和CO-TPR基本一致,对CO转化没有太大影响。2种还原性气体被载氧体氧化后产生大量CO2,且CO2产量随CuO增多面积增大,与上述试验结果一致。
2.3 载氧体恒温反应活性评价
通过载氧体和COG的恒温反应可判断载氧体的反应活性,不同载氧体与COG恒温反应在800 ℃下进行,气体组分浓度变化如图9所示。

图9 3次氧化还原反应循环主要产物与反应物的典型曲线
添加CeO2、ZrO2后,CH4转化率分别为82%、86%,但添加Ce0.67Zr0.33O2后CH4转化率达100%。x(%)CuO/CZ(x=30、50、70、90)随CuO含量增多,CH4消耗量逐渐增加,CO2产率随CuO含量增多随之增加,在3次循环中保持稳定。CuO负载量较低时,产生的活性位点较少,增加负载量可显著提高活性位点数量,进而提升燃烧性能。随循环次数增加,纯CuO活性减弱。结合CuO样品循环前后SEM图,循环后CuO样品烧结严重,影响反应活性。CZ转化CH4能力较弱,5 min后其他组分恢复初始浓度,失去活性。
在800 ℃下进行50次还原氧化循环,考察载氧体对COG化学链燃烧的稳定性。CH4转化率和CO2产率、捕集率如图10所示。x(%)CuO/CZ(x=50、70)活性明显高于CuO,CH4转化率由第1次84.7%降至第3次22%,70CuO/CZ、90CuO/CZ的CH4转化率由第1次至第50次循环分别由94.6%、99.8%降至77%、93.6%。从CO2捕集率角度对比,70CuO/CZ、90CuO/CZ由第1次92.4%、100%降至第50次76%、97%。CuO样品则由第1次86%降至第3次34%。随着CuO含量增加,90CuO/CZ整体性能好于70CuO/CZ。CuO和70CuO/CZ活性下降明显,90CuO/CZ循环稳定性高。
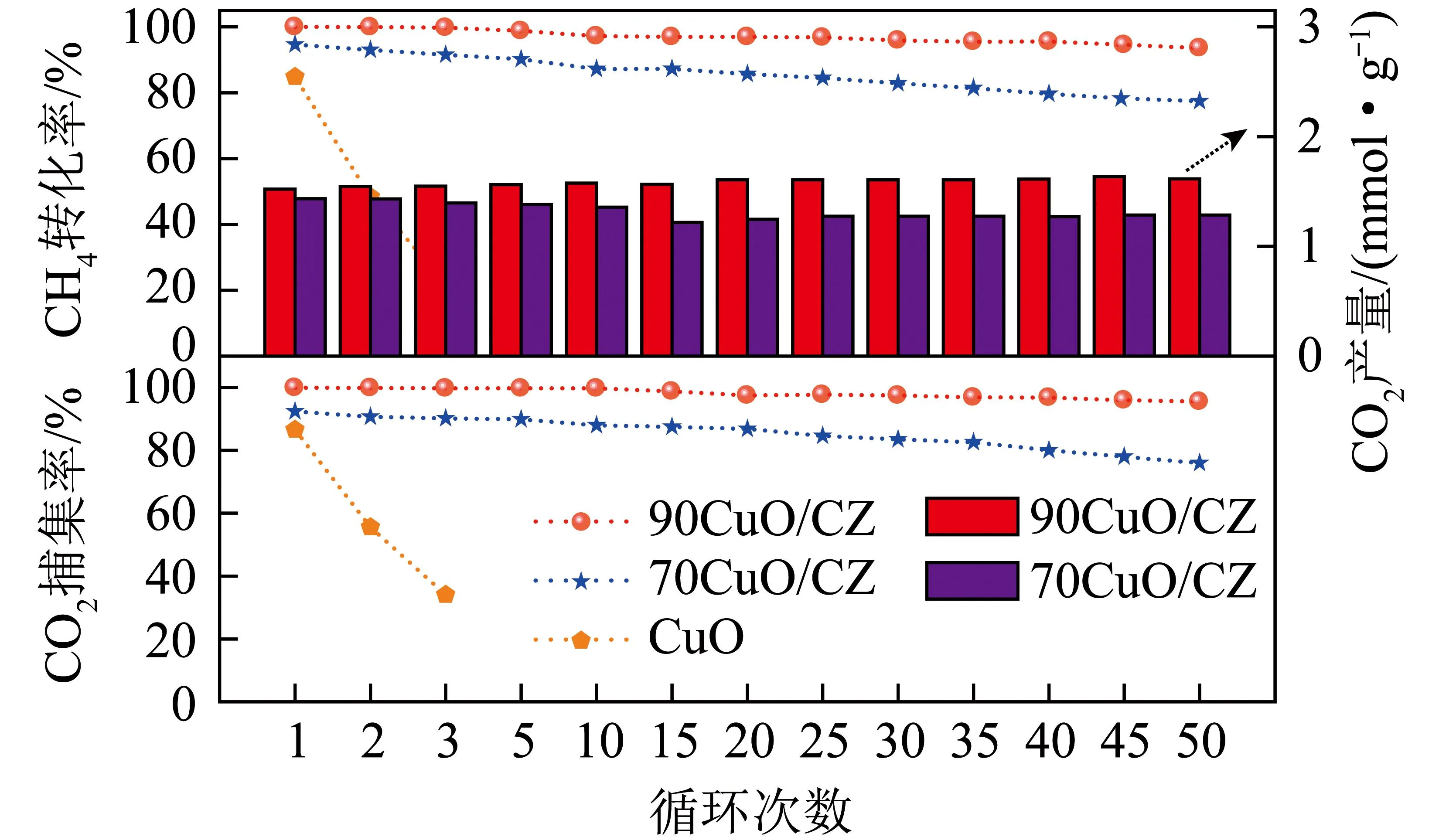
图10 载氧体和焦炉煤气反应循环试验
2.4 微观形貌分析
采用SEM及EDS考察90CuO/CZ样品循环前后的整体结构和元素分布情况。90CuO/CZ样品循环前后EDS图如图11所示。90CuO/CZ样品循环前后的EDS图中,Cu、Ce、Zr和O元素分布区域重叠,表明表面Cu元素均匀分布。90CuO/CZ样品的XRD物相组成为Ce0.67Zr0.33O2和CuO两种物相,不存在Ce、Zr和Cu三种元素固溶,说明Ce0.67Zr0.33O2和CuO分布位置一致,且循环前后无明显变化。

图11 SEM-EDS
70CuO/CZ、90CuO/CZ和CuO样品循环前后的显微结构如图12所示。由图12(a)可知,CuO循环3次后颗粒尺寸显著增大,说明CuO样品存在严重烧结问题。由图12(a)、12(c)、12(e)可知,随Ce0.67Zr0.33O2含量增加,颗粒尺寸逐渐减小,其中D50由CuO的2.25 μm分别降至90CuO/CZ的399.66 nm和70CuO/CZ的223.88 nm,说明第二相颗粒Ce0.67Zr0.33O2的添加对CuO颗粒长大起抑制作用。通过对比图12(c)、12(d)及12(e)、12(f)发现,70CuO/CZ和90CuO/CZ样品循环50次后CuO颗粒尺寸接近,但70CuO/CZ和90CuO/CZ样品循环50次后活性评价存在差异,说明烧结情况对70CuO/CZ和90CuO/CZ样品活性评价影响不大。

图12 载氧体的SEM图谱
2.5 载氧体循环前后的物性结构变化
50次循环后载氧体的XRD和拉曼图谱如图13所示,可知长时间COG/O2还原氧化循环未明显影响载氧体物相结构,无其他晶相特征峰出现,且载氧体的拉曼主峰基本恢复到之前状态。进一步证明载氧体具有良好循环稳定性。
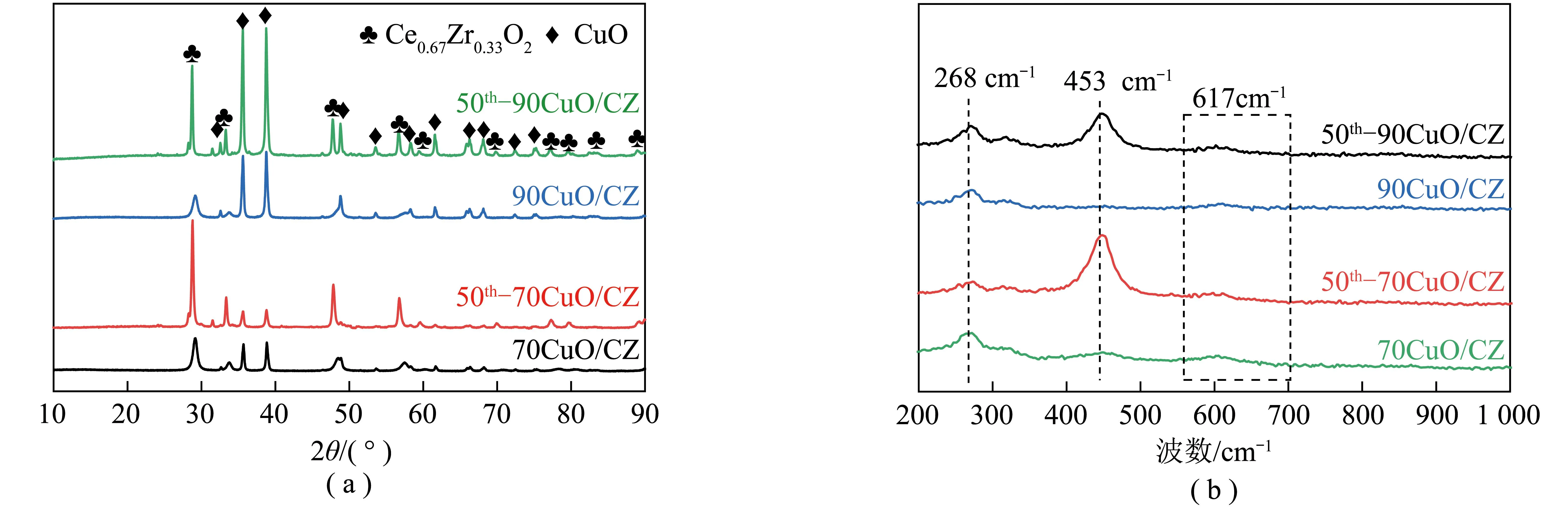
图13 50次循环后的载氧体XRD和拉曼图谱
3 结 论
1)通过溶胶凝胶法制备一系列x(%)CuO/Ce-Zr-O(x=30、50、70、90)、CZ和CuO载氧体,用于焦炉煤气化学链燃烧。载氧体物相以CuO和Ce0.67Zr0.33O2共存。相对纯CeO2,Ce0.67Zr0.33O2在617 cm-1处出现了明显拉曼特征峰,说明Ce0.67Zr0.33O2固溶体的形成产生了氧空位。
2)H2-TPR、CO-TPR、CH4-TPR和COG-TPR结果表明,CuO与Ce-Zr-O之间相互作用促进铜物种低温的释氧能力。
3)CuO载氧体在3次循环后CH4转化率由84.7%降至22.0%,CO2捕集率由86%降至34%。而90CuO/CZ载氧体50次redox循环后CH4转化率和CO2捕集率分别保持在95%和77%以上,CO2捕集量为1.61 mmol/g。

