基于cGAS-STING通路探讨参白扶正颗粒调节肿瘤免疫应答的作用机制
刘福蓉,李 奕,黄 进,温 婷,陈方姗
(西南医科大学附属中医医院,四川 泸州 646000)
胃癌是临床常见恶性消化道肿瘤,据最新肿瘤发病率统计,我国每年新发胃癌近70万例,死亡近50万例,发病率、病死率高居因癌症死亡中第2位,目前对该病的治疗尚无突破性进展[1-2]。参白扶正颗粒是西南医科大学附属中医医院的临床经验方,具有扶正祛瘀、补肝健脾、益气散结的功效,临床用于乳腺癌的治疗可减轻症状,提高机体免疫功能[3]。临床用于胃癌的治疗发现其可减轻化疗不良反应,对预防胃癌转移也有积极作用,但具体作用机制尚不明确。鸟苷酸-腺苷酸合成酶(cGAS)是一种能激活干扰素基因刺激因子(STING)蛋白的细胞质DNA传感器,对于DNA病原体产生保护性免疫防御,cGAS-STING通路在抵御病原体入侵、肿瘤免疫中发挥关键作用[4-5],激活该通路可促进自然杀伤细胞浸润,抑制癌细胞增殖和免疫逃逸[6-8]。基于此,本研究建立胃癌移植瘤小鼠模型,探讨了参白扶正颗粒能否通过cGAS-STING通路介导肿瘤免疫应答而抑制胃癌的发展,以为其临床应用提供理论依据。
1 实验材料与方法
1.1实验动物 SPF级KM小鼠60只,体重(20±2)g,由四川省人民医院实验动物研究所提供,动物生产许可证号:SCXK(川)2018-15,于室内温度21~25 ℃,相对湿度45%~55%条件下标准鼠饲料及无菌水饲养。本实验已取得西南医科大学实验动物管理委员会批准(伦理编号:SWMU20230011),所涉及的研究方案符合中国伦理委员会关于实验动物的指导原则。
1.2实验药物及细胞株 参白扶正颗粒由党参、黄芪、当归、泽泻、决明子、细辛、熟地黄、鹿角、菟丝子、枸杞子、天麻组成,由西南医科大学附属中医医院制剂室生产,川药制字Z20080290,规格:10 g/袋,制成含5 mg/mL的药液备用。MGC-803人胃癌细胞(澳睿赛生物,货号:ORC0554)。
1.3主要试剂与仪器 4%多聚甲醛溶液、磷酸缓冲液、乙醇、二甲苯(湖北鑫鸣泰化学有限公司),苏木素液、伊红液(南京科佰生物科技有限公司),免疫活化指标[CD4+、CD8+、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+、CD4+Foxp3+Treg]抗体(美国MP Biomedicals生物医学公司),β干扰素(IFN-β)、C-C类趋化因子22(CCL22)、C-C类趋化因子17(CCL17)、白细胞介素-10(IL-10)试剂盒(上海酶联生物科技有限公司),RIPA裂解液(美国Sigma-Aldrich公司),STING、TANK结合激酶1(TBK1)、干扰素调节因子 3(IRF3)兔单克隆抗体和GAPDH兔单克隆抗体(英国abcam公司),电子天平、石蜡包埋机、石蜡切片机(德国Leica公司),光学显微镜(日本OLYMPUS公司),组织超声匀浆机、流式细胞仪(美国BD公司),凝胶成像分析系统(以色列DNR成像系统有限公司)。
1.4造模及干预方法 体外培养人胃癌MGC-803细胞,消化细胞后进行离心,PBS调节细胞浓度至1.0×107个/mL,按0.2 mL/只接种于小鼠左侧腋下,建立人胃癌MGC803细胞裸鼠移植瘤模型。将42只造模成功小鼠按照随机数字表法分为模型组、参白扶正低剂量组、参白扶正中剂量组、参白扶正高剂量组,根据人的参白扶正颗粒用药剂量为40 g/70 kg以及人和动物间按体表面积折算的等效剂量换算,参白扶正低、中、高剂量组小鼠分别给予参白扶正颗粒5 mg/g、10 mg/g、20 mg/g灌胃,模型组给予等量生理盐水灌胃,均2次/d,连续灌胃15 d。
1.5检测指标及方法
1.5.1瘤重和肿瘤抑制率 末次灌胃24 h后脱颈处死小鼠,剥离瘤体组织,称重并计算肿瘤抑制率[(1-给药组平均瘤重/模型组平均瘤重)×100%]。
1.5.2肿瘤组织病理形态 末次灌胃24 h后脱颈处死小鼠后取新鲜肿瘤组织,采用磷酸缓冲液冲洗,依次进行梯度乙醇脱水、二甲苯透明、石蜡包埋,制成约4 μm厚度石蜡切片,再依次进行脱蜡、水化、苏木素染色、伊红染色、脱水封片,晾干后于光学显微镜下观察。
1.5.3肿瘤组织中免疫活化指标水平 取新鲜肿瘤组织,制成单细胞悬液,取出100 μL肿瘤组织浸润淋巴细胞悬液4份并标号,1号标本加入CD4+-RPE抗体、CD8+-RPE抗体、IFN-γ-RPE抗体、TNF-α-RPE抗体;2号标本加入CD45+-FITC抗体、CD11c+-FITC抗体、MHC-Ⅱ+-FITC抗体;3号标本加入CD40+-FITC抗体、CD70+-FITC抗体;4号标本中加入CD4+-RPE抗体,4 ℃孵育15 min后加入Foxp3抗体。1~4号标本添加完抗体后进行避光操作,并于4 ℃的温度下孵育20 min,孵育完成后加入500 μL RBC裂解液,室温避光孵育30 min,上流式细胞仪检测CD4+、CD8+、IFN-γ、TNF-α、CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+及CD4+Foxp3+Treg水平。
1.5.4肿瘤组织中cGAS-STING通路相关细胞因子水平 取新鲜肿瘤组织,磷酸缓冲液冲洗后机械剪碎匀浆,在离心半径12.5 cm、10 000 r/min条件下离心15 min,分离上清液,严格按照ELISA试剂盒说明书步骤检测IFN-β、CCL22、CCL17、IL-10水平。
1.5.5肿瘤组织中cGAS-STING通路相关蛋白表达情况 取新鲜肿瘤组织,加入RIPA裂解液,匀浆后提取总蛋白,BCA法测量蛋白含量。取30 μg蛋白,依次进行凝胶电泳、转膜、封闭后,加入一抗STING、TBK1、IRF3和GAPDH(稀释比例均为1∶1 000),4 ℃过夜,次日洗膜后加入二抗(稀释比例均为1∶10 000),恒温摇床1 h,滴加ECL,凝胶成像系统分析,采用Image J软件计算条带灰度值。

2 结 果
2.1各组小鼠瘤重、肿瘤抑制率比较 参白扶正各组瘤重均明显低于模型组(P均<0.05),且瘤重随参白扶正颗粒剂量增加而降低,肿瘤抑制率随参白扶正颗粒剂量增加而升高,两两比较差异均有统计学意义(P均<0.05)。见表1。

表1 胃癌移植瘤各组小鼠瘤重及肿瘤抑制率比较
2.2各组小鼠肿瘤组织病理形态 模型组胃癌移植瘤小鼠胃黏膜组织细胞排列不规整且异型性明显,细胞间质充血水肿且有明显炎症浸润;参白扶正各组胃癌移植瘤小鼠胃黏膜炎症浸润和细胞间质充血水肿较模型组不同程度减轻,细胞排列相对整齐,异型性不明显,其中参白扶正高剂量组改善最明显。见图1。

图1 胃癌移植瘤各组小鼠肿瘤组织病理形态(HE染色,×200)
2.3各组小鼠肿瘤组织中免疫活化指标水平比较参白扶正各组CD4+、CD8+、IFN-γ、CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+水平均明显高于模型组,TNF-α、CD4+Foxp3+Treg水平均明显低于模型组,且CD4+、CD8+、IFN-γ、CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+水平随参白扶正颗粒剂量增加而升高, TNF-α、CD4+Foxp3+Treg水平随参白扶正颗粒剂量增加而降低,两两比较差异均有统计学意义(P均<0.05)。见表2。
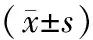
表2 胃癌移植瘤各组小鼠肿瘤组织中免疫活化指标水平比较
2.4各组小鼠肿瘤组织中IFN-β、CCL22、CCL17、IL-10水平比较 参白扶正各组IFN-β、CCL22、CCL17、IL-10水平均明显低于模型组,且各指标水平随参白扶正颗粒剂量增加而降低,两两比较差异均有统计学意义(P均<0.05)。见表3。
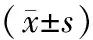
表3 胃癌移植瘤各组小鼠肿瘤组织中cGAS-STING通路相关细胞因子水平比较
2.5各组小鼠肿瘤组织中cGAS、STING、TBK1、IRF3蛋白表达情况比较 参白扶正各组cGAS、STING、TBK1、IRF3蛋白相对表达量均明显高于模型组,且各蛋白相对表达量随参白扶正颗粒剂量增加而升高,两两比较差异均有统计学意义(P均<0.05)。见图2及表4。
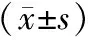
表4 胃癌移植瘤各组小鼠肿瘤组织中cGAS-STING通路相关蛋白相对表达量比较
3 讨 论
目前胃癌以手术、放化疗等综合治疗为主,但长期放化疗产生的不良反应较大,加之部分患者耐受性较差,胃癌患者预后仍不理想。近年来中医药因其多靶点、不良反应少等特点在胃癌领域逐渐受到重视。参白扶正颗粒中党参多糖、黄芪甲苷等有效成分不仅可提高机体细胞免疫功能,而且具有抗炎、抑制肿瘤细胞增殖的作用[9-10]。本实验结果显示,胃癌移植瘤小鼠瘤重随参白扶正颗粒剂量增加而明显降低,肿瘤抑制率随参白扶正颗粒剂量增加而明显升高,胃黏膜炎症浸润和细胞间质充血水肿较模型组不同程度减轻,由此可见参白扶正颗粒可抑制胃癌移植瘤小鼠肿瘤生长。
免疫功能在恶性肿瘤发生发展中具有重要作用。T淋巴细胞是一类肿瘤浸润性且具有抗原效应的细胞群,以CD4+、CD8+为主,IFN-γ是CD4+分化出的Th1细胞分泌的因子,可呈递抗原,诱导CD8+、巨噬细胞活化,调节免疫应答;TNF-α是CD4+分化出的Th2细胞分泌的免疫抑制因子,可促使巨噬细胞发生极化,抑制免疫;CD8+为细胞毒性T细胞,可直接杀伤肿瘤细胞而发挥抗肿瘤作用[11-13]。树突状细胞属于特异性抗原提呈细胞,在诱导免疫应答、调控T细胞免疫中发挥重要作用,其中CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+是树突细胞成熟、活化的标志物,这些指标水平升高意味着树突细胞增多,可为T细胞活化提供更多抗原信息,继而抑制肿瘤细胞增殖、分化[14]。CD4+Foxp3+Treg是近年来发现的具有免疫抑制作用的T细胞亚群,可逆向调控CD4+、CD8+细胞,其水平降低可促进CD4+、CD8+细胞活化、增殖,从而增强机体抗肿瘤免疫应答反应[15]。本实验结果显示,参白扶正各组肿瘤组织中CD4+、CD8+、IFN-γ、CD45+CD11c+MHC-Ⅱ+、CD40+、CD70+水平均明显高于模型组,TNF-α、CD4+Foxp3+Treg水平均明显低于模型组,提示参白扶正颗粒可调节胃癌移植瘤小鼠免疫功能。
cGAS-STING通路与恶性肿瘤的发生密切相关,其在肿瘤细胞、非肿瘤细胞中均可被激活,诱导一系列干扰素、细胞因子表达[16]。IFN-β作为一种干扰素,与免疫系统有着密切的关系,其不仅能够增强机体的免疫应答能力,刺激免疫细胞产生更多的免疫活性物质,从而抵御病原体的侵袭,还能够通过调节肿瘤细胞的基因表达,抑制肿瘤细胞增殖和转移,从而起到抗肿瘤的作用。IFN-β水平降低意味着DAPK3感知STING的能力减弱,免疫逃逸受到抑制[17]。CCL22、CCL17是趋化因子家族重要成员,与肿瘤细胞特异性受体结合后可诱导肿瘤细胞迁移、侵袭,二者表达水平降低提示肿瘤侵袭能力降低[18];IL-10是由T细胞分泌的促炎因子,直接参与树突状细胞诱导的肿瘤免疫耐受,因此当IL-10水平降低时,则提示肿瘤免疫应答增强[19]。本研究发现参白扶正各组IFN-β、CCL22、CCL17、IL-10水平均低于模型组,提示参白扶正颗粒可调控胃癌移植瘤小鼠肿瘤免疫应答,抑制免疫逃逸。
STING蛋白表达对自发性T细胞激活、自然杀伤细胞活力、T细胞杀伤效应有明显影响,其与2’3’-环GMP-AMP二核苷酸结合后形成的多聚体可在高尔基体上招募激酶TBK1,激酶TBK1可使STING磷酸化,而STING磷酸化又可介导IRF3磷酸化,进一步刺激DNA依赖性树突状细胞活化,吞噬肿瘤微环境中的坏死细胞,发挥抗肿瘤效应[20-21]。而cGAS能够识别并结合双链DNA,之后cGAS会催化细胞质中的ATP和GTP,合成第二信使cGAMP,cGAMP与STING结合后,会使STING从内质网转移到高尔基体,从而激活下游的信号通路,cGAS通过上述过程,启动了机体的先天免疫反应[21]。本研究发现参白扶正各组STING、TBK1、IRF3蛋白表达量均上调,提示参白扶正颗粒可调控cGAS-STING通路。
综上所述,参白扶正颗粒可增强胃癌移植瘤小鼠免疫功能,调节肿瘤免疫应答,其机制可能与调控cGAS-STING通路有关。
利益冲突:所有作者均声明不存在利益冲突。

