雷替曲塞联合顺铂与多西他赛联合顺铂同步放疗治疗晚期食管癌的效果比较
亓军波
食管癌属于消化系统恶性肿瘤,在临床肿瘤疾病中具有较高的发病率,根据病理学分析可将食管癌分为鳞癌和腺癌,90%以上的食管癌患者属于鳞癌[1]。食管癌与饮食习惯、遗传因素、生活作息不规律等相关[2]。食管癌一般确诊时已发展至中、晚期,存在远处转移的可能性,手术治疗难度较大,为保留其食管正常功能,临床通常以化疗与放疗为主[3]。TP化疗方案会引起神经毒性反应及过敏反应,化疗后会出现皮肤反应、胃肠道不适、水肿等,严重降低患者生活质量,因此需寻找一种低毒性、安全且科学的药物替代紫杉类药物以提高整体疗效[4-5]。陈星等[6]研究发现,雷替曲塞能抑制肿瘤细胞DNA合成,预防肿瘤扩展及病情进展,同时能杀灭部分肿瘤细胞,且不良反应相对较少,可提升同步放化疗耐受性,提高患者生活质量。本研究比较雷替曲塞联合顺铂与多西赛联合顺铂同步放疗治疗晚期食管癌的效果,报道如下。
1 资料与方法
1.1 临床资料 选取2020年10月—2021年6月济南市中西医结合医院收治的晚期食管癌患者97例,采用随机数字表法分为试验组49例和对照组48例。试验组男26例,女23例;年龄34~78(53.32±4.28)岁;病程2~7(4.65±0.42)年;病理类型:鳞癌43例,腺癌6例。对照组男25例,女23例;年龄33~72(52.95±4.16)岁;病程2~6(4.59±0.41)年;病理类型:鳞癌41例,腺癌7例。2组患者临床资料经由数据分析软件对比后,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批。
1.2 选择标准 纳入标准:经临床病理性检查已确诊为晚期食管癌且符合临床特征;不存在化疗及放疗禁忌证;患者或家属知晓研究内容并签署知情同意书。排除标准:伴有精神疾病者;认知功能障碍患者;对本研究所用药物存在过敏反应者;伴严重心、肺、肾等器质性疾病者。
1.3 治疗方法 试验组实施雷替曲塞联合顺铂治疗,予注射用雷替曲塞(扬子江药业集团有限公司生产)3 mg/m2静脉滴注,于15 min完成滴注,再给予注射用顺铂(锦州九泰药业有限责任公司生产)75 mg/m2静脉滴注,于2~6 h完成滴注,连续治疗3 d。对照组实施多西他赛联合顺铂治疗,予多西他赛注射液(江苏恒瑞医药股份有限公司生产)60 mg/m2混合0.9%氯化钠注射液250 ml静脉滴注,于1 h完成滴注,再给予注射用顺铂75 mg/m2静脉滴注,于2~6 h完成滴注,连续治疗3 d。2组均以21 d为1个周期,连续化疗2个周期。
同步放疗方案:入组患者全部实施三维适形强调放疗,采用螺旋CT定位增强扫描,确定位置后利用三维重建确定靶体积位置与大小,将肿瘤体积分别向左、右、前3个方向扩展1.0 cm,向上、下2个方向扩展3.0 cm,向后方扩展0.5 cm,确定临床靶体积后进行常规分割,确认视野内具备阳性淋巴结,获取4~6个共面照射野,按照1.8~2.0 Gy剂量进行照射,每周展开5次放疗,以42~50 d为总治疗周期,总照射剂量控制在50~60 Gy。
1.4 观察指标与方法 (1)采集患者治疗前后空腹静脉血,离心处理后取上层血清,采用全自动化学发光免疫分析仪检测血清肿瘤标志物,包括糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、血清癌胚抗原(CEA)、鳞状细胞癌相关抗原(SCC);(2)于治疗前后采集患者空腹静脉血采用流式细胞仪测定免疫功能指标,包括CD4+、CD8+及CD4+/CD8+;(3)观察治疗期间患者不良反应发生情况,包括恶心呕吐、肝功能异常、肾功能异常、腹泻、骨髓抑制等。
1.5 近期疗效评价标准 按实体瘤相关疗效标准评定。完全缓解(CR):肿瘤病灶基本消失且维持时间>1个月;部分缓解(PR):肿瘤病灶≥50%且维持时间>1个月;稳定(SD):肿瘤病灶缩减<50%且未出现新病灶;进展(PD):肿瘤病灶无变化或增大,有新病灶出现。客观缓解率(ORR)=(CR+PR)/总例数×100%。
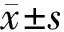
2 结 果
2.1 近期疗效比较 试验组ORR为83.67%,高于对照组的62.50%(χ2=5.540,P=0.018),见表1。

表1 对照组与试验组近期疗效比较 [例(%)]
2.2 血清肿瘤标志物比较 治疗前,2组血清CA125、CA19-9、CEA、SCC水平比较差异无统计学意义(P>0.05);治疗2个周期后,2组血清CA125、CA19-9、CEA、SCC水平较治疗前明显下降,且试验组低于对照组(P<0.01),见表2。
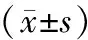
表2 对照组与试验组治疗前后血清肿瘤标志物比较
2.3 免疫功能指标比较 治疗前,2组CD4+、CD8+及CD4+/CD8+比较差异无统计学意义(P>0.05);治疗2个周期后,2组CD4+、CD8+及CD4+/CD8+较治疗前升高,且试验组高于对照组(P<0.05或P<0.01),见表3。
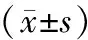
表3 对照组与试验组治疗前后免疫功能指标比较
2.4 不良反应比较 试验组不良反应总发生率为24.49%,低于对照组的45.83%(χ2=4.852,P=0.028),见表4。
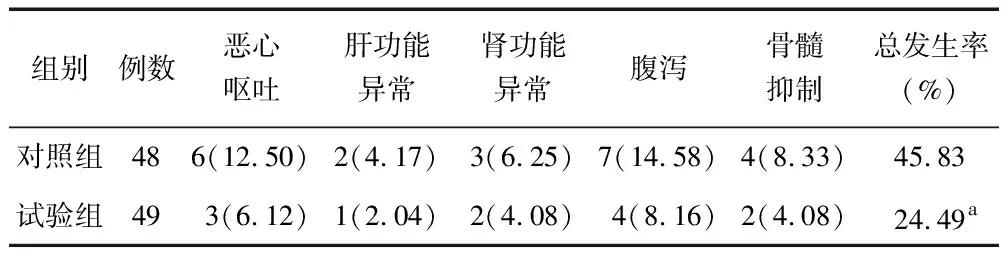
表4 对照组与试验组不良反应比较 [例(%)]
3 讨 论
食管癌是临床多发的消化系统恶性肿瘤,在我国食管癌发病率及病死率排在恶性肿瘤疾病中第5位,属于食管癌中较严重的一种类型,早期症状不明显,吞咽食物会有哽咽感,胸部伴有针刺或灼烧样疼痛,中晚期会表现为进行性吞咽困难,身体逐渐消瘦、脱水及无力,直至死亡[7]。食管癌主要分为鳞癌和腺癌两大类,其中鳞癌占比约为95%,临床尚未明确病因,但与患者日常饮食、缺乏营养物质、病菌感染、遗传及生活条件等因素相关,主要病灶部位是食管上皮细胞,正常食管组织在受到外界因素不断刺激下经历反复的损伤与修复,其过程中食管上皮细胞可能发生基因突变逐渐被鳞状上皮增生或异常柱状上皮细胞取代,随着肿瘤细胞不断浸润会扩散至食管壁及邻近组织或器官,明显降低患者生活质量[8-9]。临床上食管癌诊断以中晚期居多,为保留患者正常的食管组织临床通常采取TP化疗方案,多西他赛是临床常用的紫衫类抗肿瘤药物,其作用机制是通过抑制微管解聚及加强微管蛋白聚合形成非功能性微管束干扰肿瘤细胞有丝分裂进而阻碍肿瘤细胞DNA复制,促使其逐渐凋亡,联合顺铂能加强干扰效果,发挥协同抗肿瘤作用[10]。但TP化疗方案会引起神经毒性反应、过敏反应,产生诸多不良反应,如肝肾功能损伤、胃肠道反应及皮肤反应等,还会破坏机体免疫功能,整体疗效欠佳[11]。雷替曲塞属于抗代谢叶酸类似物,作为胸苷酸合成酶抑制剂能经细胞膜外叶酸盐载体摄入细胞内代谢为谷氨酸类化合物抑制胸苷酸合成酶活性,进而抑制肿瘤细胞DNA合成,且能长期在细胞内潴留,增强抑制效果并延长作用时间[12]。顺铂属于临床常用的金属铂类药物,通过注射可快速吸收,广泛分布在肿瘤组织中,可无特异性结合血浆蛋白抑制肿瘤细胞活性,破坏DNA,与雷替曲塞联合应用可充分抑制肿瘤细胞生长,致使其逐渐凋亡[13]。
本研究结果显示,试验组治疗后CA125、CA19-9、CEA、SCC水平相较于对照组更低,CD4+、CD8+及CD4+/CD8+相较于对照组更高。CEA、SCC作为诊断及监测食管癌进展情况的重要指标,其含量升高表明肿瘤细胞较活跃,该数据表明雷替曲塞联合顺铂化疗能明显降低肿瘤标记物,阻止肿瘤细胞分化,促进肿瘤细胞凋亡,同时能改善机体免疫功能,相较于TP化疗方案更佳。本研究结果显示,试验组患者ORR(83.67%)高于对照组(62.50%),不良反应总发生率(24.49%)低于对照组(45.83%),表明雷替曲塞联合顺铂化疗取得近期疗效更好,对患者产生的不良反应相对少,安全性高,证明其抗肿瘤效果更显著,与潘攀[14]以60例食管癌患者作为研究对象取得的治疗效果一致,合理应用雷替曲塞能改善ORR与远期生存率,进一步证实雷替曲塞在治疗食管癌的确切作用。雷替曲塞给药方式简单,用药后是以叶酸盐为载体进入细胞中,可长期潴留于细胞内保持药物浓度,其主要通过肾脏排出,对比多西他赛联合顺铂并无交叉耐药性,故出现的不良反应较少。
三维适形强调放疗是临床常用的放疗方法,鳞癌属于中度敏感肿瘤,通常需照射50~65 Gy,值得注意的是,长期放疗可能会引起张口、吞咽及呼吸困难等并发症,应注意与食管癌临床症状进行鉴别及给予对症处理[15]。紫杉醇脂质体对胃肠道产生的刺激作用及神经毒性较高,需采取针对性治疗措施减轻不良反应,避免对后续化疗产生影响,联合雷替曲塞所造成的神经毒性相对较低,对胃肠道刺激较小,利用现代医学仪器结合患者实际病情调整用药剂量,在患者机体器官完全能承受的范围内达到靶区药物浓度峰值,降低对其他组织与器官造成的损伤,提高患者对同步放化疗耐受程度,延长效应时间,大幅降低对心脏、消化道及肝脏造成的毒性反应。
综上所述,在同步放疗方案基础上,晚期食管癌患者采用雷替曲塞联合顺铂化疗相较于多西他赛联合顺铂疗效更确切,可有效减少血清肿瘤标志物,提高患者机体免疫功能,且不良反应发生率较低。
利益冲突所有作者声明无利益冲突

