注射用头孢唑肟钠的质量评价
王小亮?梁亚伟?席志芳?牛龙青?邓玉龙?张伊榕?张秉华
摘要:目的 评价国内上市的注射用头孢唑钠整体的质量状况。方法 按照法定标准检验结合探索性研究,包括对产品的有关物质、聚合物、残留溶剂、2-巯基苯并噻唑、成盐率等关键质量属性的考察,综合评价产品的质量及现行质量标准对产品质量的可控性。结果 抽取的238批样品,按法定标准检验,合格率为100.0%。探索性研究结果表明,法定标准在杂质控制、聚合物测定等方面存在一定不足;个别企业样品醋酸残留超出限度;部分企业样品检出基因毒性杂质2-巯基苯并噻唑;不同企业样品成盐率无明显差异。结论 国内上市的注射用头孢唑肟钠总体质量较好;现行标准需进一步统一和提高,建议完善有关物质等检测方法;建议生产企业关注工艺中“醋酸”的残留及2-巯基苯并噻唑的潜在风险。
关键词:注射用头孢唑肟钠;评价性抽验;质量评价;聚合物;二巯基苯并噻唑
中图分类号:R917文献标志码:A
Quality assessment of cefazole sodium for injection
Abstract Objective This study evaluated the quality of cefazole sodium for injection in China. Methods The quality of cefazole sodium injection was assessed, along with its current specifications, in accordance with the legal standard determination and exploratory research. This included looking into related substances, polymer impurities, residual solvents, 2-mercaptobenzothiazole, salt formation rate, and other important product quality attributes. Results The qualified rate of 238 batches of samples was 100.0% according to the legal specifications. The results of exploratory research showed that the legal specifications had some deficiencies in impurity control and polymer determination. The acetic acid residue of individual samples exceeded the limit; the genotoxic impurity 2-mercaptobenzothiazole was detected in some samples. There was no significant difference in the salt formation rate of samples from different manufacturers. Conclusion The quality of cefazoxime sodium for injection in China was good. The current specifications should be further unified and improved. It was proposed to improve the control of polymer impurities and related substances. It is suggested that manufacturers should pay attention to the residue of “acetic acid” in the process and the potential risk of 2-mercaptobenzothiazole.
Key words Cefazoxime sodium for injection; Evaluative sampling; Quality assessment; Polymer; 2-mercaptobenzothiazole
注射用頭孢唑肟钠为头孢唑肟钠原料直接无菌分装制成的注射用无菌粉末,由日本藤泽药品工业株式会社研制,于1981年在日本首次上市。本品适用于对头孢唑肟敏感的链球菌属、肺炎链球菌、流感嗜血杆菌、大肠埃希菌、克雷伯杆菌属、变形杆菌属、沙雷菌属、肠细菌属、柠檬酸细菌属、消化球菌属、消化链球菌属和类杆菌属所引起的感染症[1-2]。常见不良反应有皮疹、瘙痒和药物热等过敏反应[3-4]。1989年原研企业通过技术转移方式授权西南制药三厂(现更名为西南药业股份有限公司)在中国上市,2023年被确定为国产仿制药参比制剂。目前我国批准上市的注射用头孢唑肟钠共有6个规格。头孢唑肟钠原料质量标准在中国药典2020年版(ChP2020)、美国药典2023年版(USP2023)、日本药局方18改正(JP18)和韩国药典12版(KP12)均有收载,注射用头孢唑肟钠收载于ChP2023、USP2023、KP12和16个NMPA注册标准。
注射用头孢唑肟钠为2023年国家药品抽检品种。本文按法定标准对238批样品进行检验,并针对其中发现的问题开展探索性研究,进而对该产品的质量现状进行评价,并从有效性、安全性角度对完善制剂质控标准提出建议。
1 仪器及试药
1.1 仪器
高效液相色谱仪(Shimadzu, LC-2030 3D,检测器:岛津DAD),气相色谱仪(Agilent 8890,FID检测器),超高效液相色谱-质谱联用仪(AB公司, SCIEX QTRAP5500+),粉末X射线衍射仪(Shimadzu, XRD-6100),激光粒度测定仪(Beckman, LS13320),离子色谱仪(瑞士万通940,电导检测器),电子分析天平(Mettler Toledo, XPE205)。
1.2 试药
头孢唑肟对照品(130504-202304),含量为97.8%,购自中国食品药品检定研究院;杂质D(QRTBZWX023-20220729),含量為98.58%,头孢唑肟开环物(QRTBZWX017-20220902)购自广州清瑞生物科技有限责任公司;头孢唑肟E异构体(20230201),来自Molcoo Chemicals Inc.;杂质3、杂质6、杂质12、杂质13、杂质16、杂质18、杂质KTO、二聚体及其异构体、开环脱羧S-氧化物1和开环脱羧-S氧化物2对照品均为西南药业股份有限公司提供;2-巯基苯并噻唑对照品(G1211642),含量为98.45%,购自Ehrenstorferf公司。
1.3 样品
238批注射用头孢唑肟钠均为2023年国家药品评价性抽验样品,来自全国29个省、自治区和直辖市的药品生产、经营和医疗单位,其中124批抽自经营企业,99批抽自生产企业,15批抽医疗单位,6个药品规格(0.25、0.5、0.75、1.0、1.5及2.0 g)涉及28个生产企业。头孢唑肟原料为企业提供。
2 实验方法
2.1 法定检验
按法定标准检验对238批注射用头孢唑肟钠进行检验。主要检验项目包括鉴别、有关物质、酸碱度、水分、含量测定等,部分注册标准包括聚合物。
2.2 探索性研究
2.2.1 有关物质分析
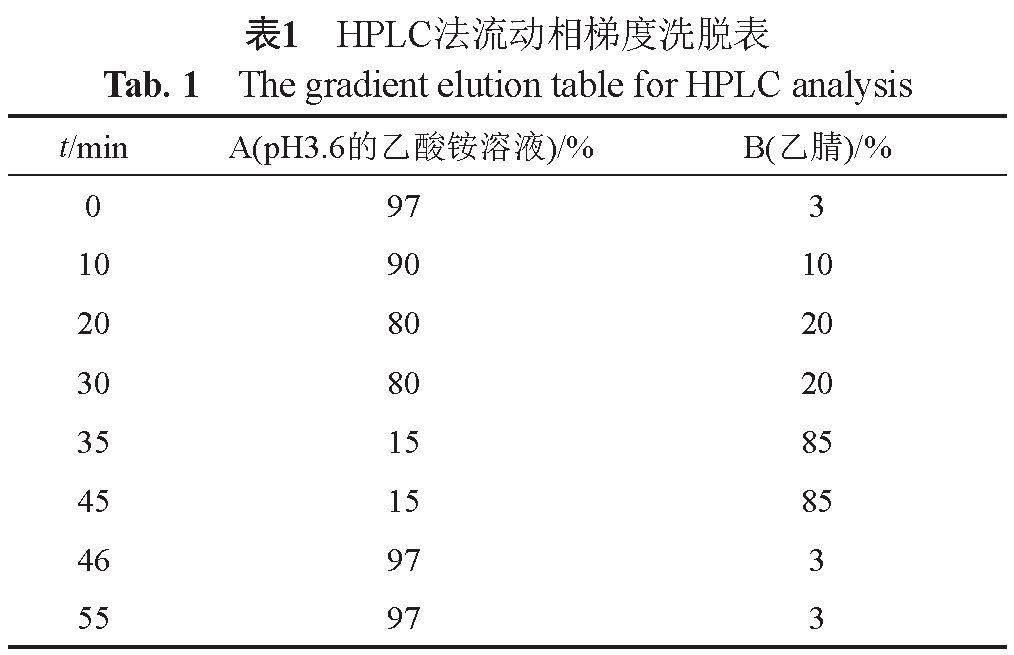
色谱方法:采用Agilent ZORBAX SB-C18
(4.6 mm×250 mm,5 μm)色谱柱;以pH 3.6的
50 mmol/L的乙酸铵溶液为流动相A,乙腈为流动相B,按表1方式进行梯度洗脱;流速为0.8 mL/min;柱温:35 ℃;检测波长为254 nm;进样体积:20 μL。样品临用新制。
2.2.2 聚合物测定及比较分析
对部分注册标准测定聚合物的高效分子排阻法(HPSEC)进行改进,对国产28个企业的76批样品的聚合物进行测定;比较《中国药典》2020年版有关物质项下反相-高效液相色谱(RP-HPLC)方法的二聚体检测结果、部分注册标准葡聚糖G-10凝胶色谱法测定聚合物的结果与新优化的聚合物测定结果的相关性。
改进的高效分子排阻法(HPSEC):采用球状亲水改性硅胶Zenix SEC-100(7.8 mm ×300 mm,3 ?m)色谱柱;以pH7.0的0.075 mol/L磷酸盐缓冲液为流动相;柱温:25 ℃;检测波长:254 nm;进样量:20 ?L;流速:0.6 mL/min。样品临用新制。
2.2.3 残留溶剂测定
根据函调资料得知注射用头孢唑肟钠有两种原料合成工艺,涉及不同的残留溶剂。参照相关文献考察[5-6],建立了两种分析原料中残留溶剂的方法。
色谱方法1(分析甲醇、乙醇、异丙醇、丙酮、二氯甲烷、四氢呋喃):采用Agilent DB-624(30 m× 0.320 mm,1.8 μm)毛细管柱,载气为氮气,流速为1.0 mL/min,检测器为FID,起始柱温40 ℃,维持 12 min,以10 ℃/min速率升至80℃,以15 ℃/min速率上升至140 ℃,维持2 min,进样口温度为150 ℃,检测器温度为250 ℃,顶空平衡温度为90 ℃,平衡30 min。
色谱方法2(分析醋酸):采用Agilent-FFAP(30 m× 0.320 mm,0.25 μm)色谱柱,载气为氮气,流速为3.0 mL/min,检测器为FID,起始柱温50 ℃,维持5 min,以10 ℃/min速率升至120 ℃,维持1 min,以50 ℃/min速率上升至240 ℃,维持7 min,进样口温度为210 ℃,检测器温度为250 ℃,顶空平衡温度为90 ℃,平衡30 min,分流比为20: 1:进样体积为1 μL。
2.2.4 基因毒性杂质2-巯基苯并噻唑的测定
参照相关文献[7]建立了HPLC-MS-MS法测定样品中的2-巯基苯并噻唑(MBT)的方法。色谱条件:采用Phenomenex,Luna Omega C18(2.1 mm×100 mm,1.6 μm)色谱柱;2 mmol/L乙酸铵为流动相A,乙腈为流动相B,按表2进行梯度洗脱;柱温为30℃;流速为0.3 mL/min;进样量:5 μL;阀切换时间:0.1~2 min进废液;2~11 min进质谱。
质谱条件:离子源ESI;正离子模式;源参数:气帘气35 psi;离子化电压5500 V,离子化温度550 ℃,喷雾气55 psi,辅助加热气55 psi,喷撞气8 psi,射入电压10 V,喷撞室射出电压10 V。采用多反应监测模式模式(MRM)测定。
2.2.5 成盐率测定
采用离子色谱法测定注射用头孢唑肟钠的成盐率[8-9]。通过测定的钠离子的摩尔数,再与头孢唑肟酸的摩尔数相比,比值即为成盐率。理论值为1.0。
色谱方法:采用Metrohm C6-150/4.0阳离子分析色谱柱(4.0 mm×150 mm);淋洗液: 1.7 mmol/L硝酸-1.7 mmol/L吡啶二羧酸;流速:1.2 mL/min;柱温:30.0 ℃;进样体积:20 μL;检测器:电导检测器。
3 结果与讨论
3.1 法定检验
按现行质量标准检验,238批注射用头孢唑肟钠全部合格,合格率为100.0%。
不同企业执行的质量标准不统一,主要区别为质量标准中“有关物质”“聚合物”的检测方法、限度不一致;原料药中比旋度、吸收系数等部分项目在制剂中重复设置。建议统一和提高法定质量标准。
3.2 探索性研究结果
3.2.1 有关物质分析
参照国内外药典标准和相关文献[10],对注射用头孢唑肟钠有关物质测定方法进行了优化[11]采用新建立的HPLC方法对28个生产企业的注射用头孢唑肟钠的主要杂质和总杂质进行分析,新方法的杂质检出能力更强(图1),可同时检出10种杂质。
注射用头孢唑肟钠的主要杂质为杂质16(头孢唑肟开环物),不同企业该杂质检出量不同,但均符合限度规定(不得过0.5%)。杂质16和总杂质的频数分布近似正态分布(图2),较为均匀,提示产品质量良好。
强制降解试验表明:酸性条件下,头孢唑肟钠比较稳定,几乎无新增杂质;碱性条件下,样品极其不稳定,已知杂质16、杂质3、杂质6、杂质18均有较大程度的增加,同时,9.16 min有1个较大的未知杂质产生;氧化条件下,开环脱羧S-氧化物1和开环脱羧S-氧化物2显著增加;高温下,易降解破坏产生杂质,杂质18,杂质6和杂质3大幅度增加;光照条件下,头孢唑肟钠不稳定,杂质18、杂质16、杂质3和杂质13都有增加,其中变化最大的是杂质18和杂质13。即注射用头孢唑肟钠在碱性、氧化、高温及光照条件下均不稳定,易产生降解杂质。提示注射用头孢唑肟钠在储存、运输及配制使用过程中,应避免高温、光照、氧化及接触碱性物质。
3.2.2 聚合物测定及比较分析
采用法定RP-HPLC方法检测二聚体、葡聚糖凝胶G-10色谱法及HPSEC法测定聚合物的典型色谱图见图3;参照法定标准和相关文献[12-13],建立了新的聚合物测定方法(图4)。新改进的HPSEC方法主峰前可检出5个杂质,其中最大的杂质峰通过保留时间定位为杂质16(头孢唑肟开环杂质),其他4个杂质峰认为可能是不同结构的聚合物峰。G-10法由于分析时间长,专属性差且检出量小。对28个生产企业76批样品的RP-HPLC二聚体测定结果和新改进HPSEC方法的聚合物测定结果进行比较(表3)。将RP-HPLC法结果与新改进HPSEC法测定结果在95%可信区间内进行配对t-检验,在95%可信区间范围内,P值为0.643,大于0.05,表明RP-HPLC法测定结果和新改进HPSEC法测定结果无显著性差异。同时,两组数据的相关系数r为-0.056,接近于0,表明RP-HPLC法和新改进HPSEC法测定结果无相关性。
综上,国内市场中的注射用头孢唑肟钠聚合物检出量均较低,整体质量较好。新改进HPSEC法可检出4个可能是聚合物的杂质峰,其杂质和与RP-HPLC的二聚体含量不具有相关性。对头孢唑肟的可能聚合反应机理研究表明,其可能含有多种聚合物及聚合降解物[14],采用LC-MS方法对上述的4个可能为聚合物的杂质峰进行进一步的分析,将揭示该HPSEC法是否可作为RP-HPLC二聚体测定的补充方法;由于它们和头孢唑肟二聚体的含量没有显著性差异,提示头孢唑肟二聚体是头孢唑肟钠的主要聚合产物。
3.2.3 残留溶剂
测定头孢唑肟钠原料中甲醇、乙醇、异丙醇、丙酮、二氯甲烷和四氢呋喃6种溶剂的残留量,所有样品的检出量均远小于限度。测定原料中醋酸的残留量,发现仅“企业A”产品残留量超出限度(醋酸在《中国药典》2020年版通则<0861>中属于第三类溶剂,限度为0.5%);进一步对28个制剂企业的产品中的醋酸残留量进行筛查,4个企业的产品中检测出醋酸;36批样品中5批样品的残留量超过限度,另5批样品的残留量临近限度,其余样品的醋酸残留量范围为0~0.04%,合格率为86.1%;不合格和残留量较高的样品原料均来自于“企业A”。
调研获悉,醋酸用于头孢唑肟钠在无菌精制步骤,溶解脱色工序中利用醋酸调节pH,因成盐工艺中需加入过量钠盐,故醋酸在样品中以醋酸钠的形式存在。醋酸钠对人体的危害也不同于醋酸。“企业A”样品中醋酸的残留量接近或超过限度,且该企业样品的酸碱度在合格范围内整体偏低,提示该企业生产工艺应进一步优化。
3.2.4 基因毒性杂质2-巯基苯并噻唑的测定结果
采用新建HPLC-MS-MS法测定28個生产企业样品中2-巯基苯并噻唑(MBT)的含量(表4),其典型色谱图见图4。28个生产企业的样品MBT检测量均小于限度10 ppm,但各生产企业检出量有明显差异。
头孢唑肟钠原料合成工艺,采用AE活性酯和7-ANCA为起始原料时,会形成副产物2-巯基苯并噻唑(MBT)。MBT被世界卫生组织国际癌症研究机构列入2A类致癌物清单,可导致基因突变并可能促使肿瘤发生。新型工艺采用DAMA新型活性酯为起始原料,可以避免再产生MBT,但DAMA在储存和运输过程中需要低温(<5 ℃),且价位较高,国内没有大规模应用。调研得知,“企业1”和“企业18”采用了DAMA工艺的原料,理论上不会产生MBT。“企业1”的制剂产品未检出MBT,与原料工艺相吻合,但“企业18”的产品检出有MBT,含量为1.09 ppm,进一步考察其提供的原料,原料亦检出有MBT,检出量为1.15 ppm,与原料合成工艺不符。上述结果提示,对原料中MBT的检测,可用于判断原料的合成工艺。
3.2.5 成盐率测定结果
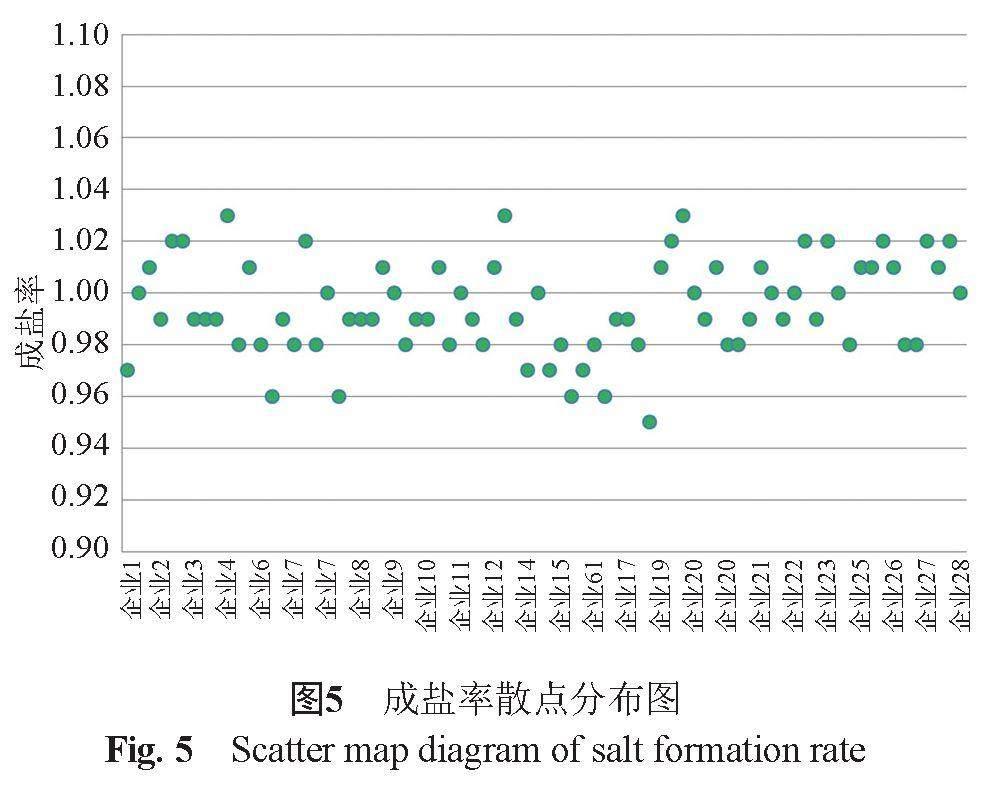
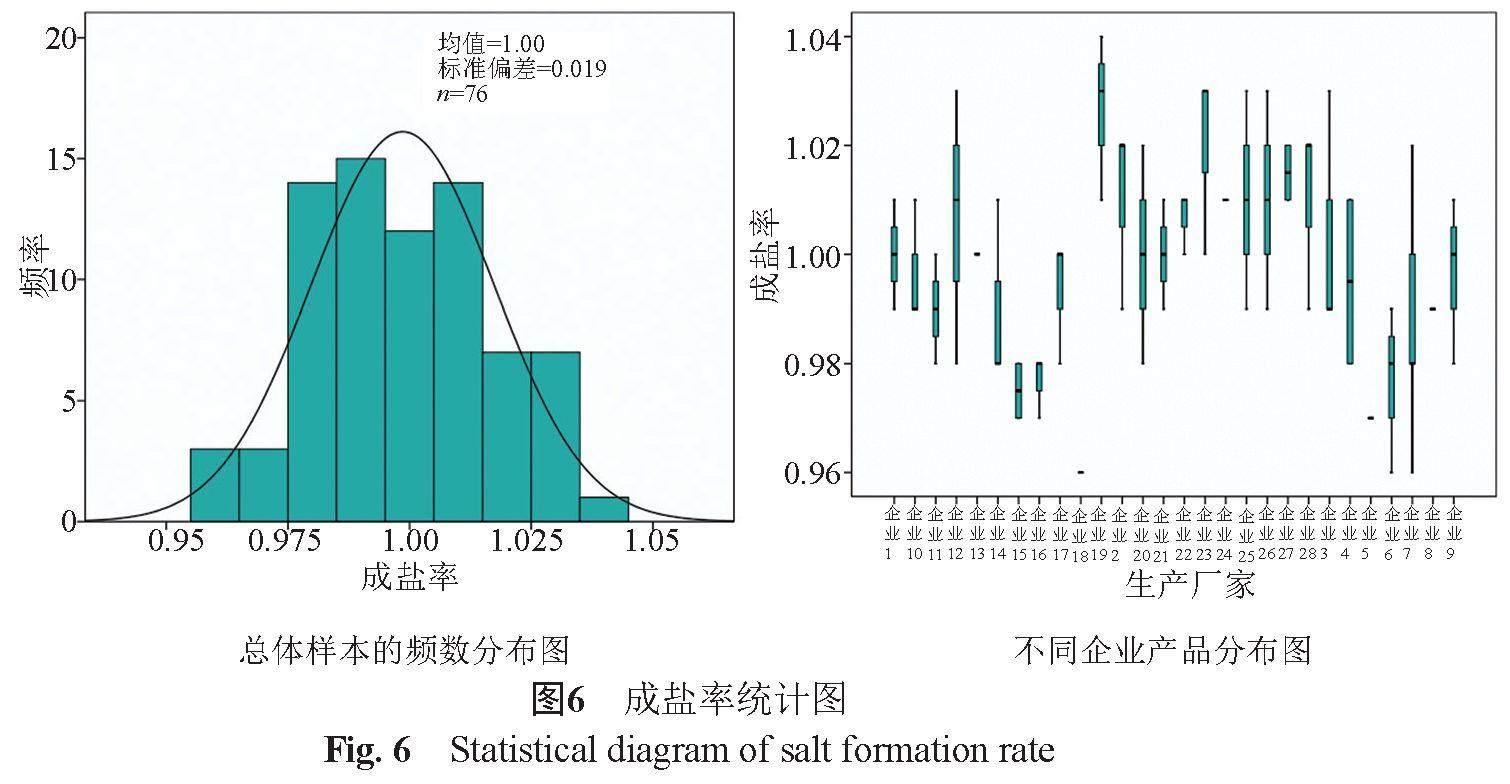
采用离子色谱法法测定28个企业的样品,并对诸产品的成盐率进行比较分析。注射用头孢唑肟钠成盐率理论值为1.0,28个生产企业样品的成盐率测定结果为0.95~1.03,均值为1.00,批间差异较小(图5)。
从频数分布图(图6)可见,28个生产企业产品的成盐率呈近似正态分布。参比企业样品成盐率为0.98~1.01,其他企业成盐率为0.95~1.03。参比企业样品的成盐率稍优于其他国产企业。样品成盐率可反映成盐工艺的稳定性。上述结果提示,国产头孢唑肟钠的成盐工艺稳定。
4 结论
通过标准检验及探索性研究发现,注射用头孢唑肟钠质量总体情况较好;但注射用头孢唑肟钠的法定检验标准应进一步提高和统一。此外,应关注产品原料中的有关物质、聚合物及合成工艺中可能引入的残留溶剂、基因毒性杂质等指标,以保证产品与参比制剂的质量一致。
参 考 文 献
施毅, 苏欣, 肖永营, 等. 注射用头孢唑肟钠治疗细菌性感染的多中心随机对照临床研究[J]. 中国抗感染化疗杂志, 2005, 5(6): 350-354.
戎霞君, 陈巍, 黄绍光. 注射用头孢唑肟钠治疗下呼吸道细菌感染的研究[J]. 世界临床药物, 2006, (7): 395-400.
王丹, 王颖丽, 段石顽, 等. 我院2014—2017年药品不良反应报告回顾性分析[J]. 中国医药导刊, 2018, 20(10): 632-636.
刘书红, 李连春, 罗恩兰, 等. 我院注射用头孢唑肟钠致7例不良反应分析[J]. 北方药学, 2018, 15(7): 189.
杨荣. 头孢唑肟钠中残留溶剂分析技术研究[J]. 考试周刊, 2016, (34): 195-196.
张昕, 吴立峰, 饶春意. 顶空气相色谱法测定头孢唑肟钠中4种残留溶剂[J]. 广东药学, 2004, (5): 20-22.
亓恒芹, 吕远, 孟龙, 等. 高效液相色谱-质谱联用法在头孢唑肟钠中基因毒性杂质控制的应用[J]. 中国医药导刊, 2023, 25(6): 570-574.
陈茜, 伍雯琦, 高丹玲. 离子色谱法测定阿洛西林钠中钠离子含量与成盐率考察[J]. 海峡药学, 2021, 33(11): 77-80.
钱敏, 耿志旺, 彭茗, 等. 离子色谱法测定头孢曲松钠中的钠离子含量以及成盐率[J]. 药物分析杂志, 2015, 35(3): 435-439.
杨倩, 李伟, 曹晓云, 等. 注射用头孢唑肟鈉的杂质谱研究[J]. 中国药学杂志, 2014, 49(19): 1750-1754.
张秉华, 王小亮, 梁亚伟, 等. 注射用头孢唑肟钠有关物质测定方法的建立与分析[J]. 中国抗生素杂志, 2024, 49(3): 348-354.
李进, 姚尚辰, 宁保明, 等. 注射用头孢唑肟钠的聚合物杂质分析[J]. 中国新药杂志, 2023, 32(1): 72-79.
孔令洋, 韩勇, 孙巧巧, 等. 高效分子排阻法测定注射用头孢唑肟钠聚合物的方法学研究[J]. 中国医药科学, 2022, 12(13): 98-100.
胡昌勤, 李进, 张夏. 7-氨噻肟头孢菌素的聚合物分析[J].中国抗生素杂志, 2022, 47(3): 209-220.

