木薯MeHsfB3b转录因子与MeFKBP20蛋白互作关系验证
王超群 李琳琳 陈银华 张肖飞 姚远 耿梦婷

关键词:热激转录因子;FKBP 型肽脯氨酰顺反异构酶;酵母双杂交;双分子荧光互补
木薯(Manihot esculenta Crantz)具有高光合效率、高淀粉产量、耐旱、耐贫瘠等特性,广泛种植于非洲、南美洲和亚洲热带地区,为105个国家的近10 亿人提供主食[1-2],同时也是生产淀粉、生物乙醇及其他生物基产品的重要工业原料[3]。木薯细菌性枯萎病(cassava bacterial blight,CBB) 是由菜豆黄单胞菌木薯枯萎致病变种(Xanthomonas phaseoli pv. manihotis, Xpm)引起的检疫性病害[4-5]。病原菌主要由叶面气孔或伤口侵入经维管束扩散至全株,初期症状表现叶组织出现水浸状半透明角斑不规则分布,而后扩大形成深褐色斑块并伴随乳白色或黄橙色分泌物,后期叶片卷曲呈现焦枯症状或全株凋亡[6-7]。CBB对木薯生产存在巨大破坏性,甚至是毁灭性的,被认为是限制木薯产业健康发展的病害之一,是仅次于木薯花叶病毒病的第二大病害[6, 8]。
植物在与病原菌互作过程中存在广泛的信号交流,通过感知病原菌作出应激反应,增强自身抗病性[9-11]。热激转录因子(heat stress transcriptionfactors, HSFs)作为逆境信号传导的主要调控因子,不但参与高温、干旱、渗透及缺氧等非生物胁迫,还参与了植物对病原菌侵染的响应过程[12-15]。HSFs 在进化上高度保守,根据结构域分为A、B、C 三個亚类,木薯基因组中,存在32 个HSFs 成员,其中A 类18 个,B 类12 个,C 类2 个。HSFs参与木薯对Xpm 病原菌侵染过程。木薯MeHsf3基因表达量下调,导致木薯对细菌性枯萎病表现易感。进一步研究发现MeHsf3 转录因子通过对下游靶基因MeEDS1 和MePR4 的转录调控激活木薯对CBB 的免疫反应[13]。MeHsfB3b(MeHsf20)转录因子正向调控木薯褪黑素合成关键基因MeASMT2 表达,通过积累更多的褪黑素提高木薯抗病性[16]。
本实验室前期利用酵母双杂交技术筛选获得MeHsfB3b 的候选互作蛋白MeFKBP20 。MeFKBP20 蛋白属于FK506 结合蛋白(FK506binding protein, FKBP)家族[17]。FKBP 家族成员参与蛋白质折叠、运输、激素信号传导、植物生长和应激反应等生物学过程[18-20]。例如,小麦FKBP73、FKBP77 蛋白以及拟南芥FKBP62、FKBP65 蛋白受伤害、NaCl 胁迫和丙二醛处理诱导,进而诱导非生物胁迫响应基因的表达做出应激反应[21-22]。在植物中FKBP 型PPIase 可以作为分子伴侣与其他蛋白相互作用,调控广泛的发育过程、胁迫反应和植物防御[23]。FKBP15-2 作为辣椒疫霉RXLR效应因子PcAvr3a12 的直接靶标,正向调节植物对疫霉菌免疫反应[24]。本研究拟克隆木薯MeFKBP20 基因,分析该基因的表达模式,利用酵母双杂和双分子荧光互补验证MeFKBP20与MeHsfB3b 的互作关系及互作区域。研究结果有利于进一步解析木薯MeHsfB3b 转录因子调控褪黑素积累抵御Xpm 侵染的分子机理。
1 材料与方法
1.1 材料
1.1.1 植物材料 华南8 号木薯苗(SC8)、本生烟草(Nicotiana. benthamiana)为实验室保存株。
1.1.2 菌株 大肠杆菌DH5α 感受态细胞、农杆菌GV3101(pSoup-p19)、酵母AH109 感受态细胞购自上海唯地生物技术有限公司。病原菌XpmCHN11 为本实验室保存。
1.1.3 质粒载体 中间载体pEASY-Blunt 购自北京全式金生物技术有限公司(TransGen Biotech);酵母双杂交载体pGBKT7、pGADT7 为实验室保存;双分子荧光互补实验载体pNC-BiFC-Enc、pNC-BiFC-Ecc 为中国热带农业科学院热带生物技术研究所周鹏老师实验室提供。
1.1.4 酶及药品试剂 2×Rapid Taq Master Mix购自南京诺唯赞生物科技股份有限公司。质粒小提、琼脂糖凝胶回收、PCR 产物柱回收试剂盒等均购自北京艾德莱生物科技有限公司。SeamlessAssembly Cloning Kit 试剂盒购自中美泰和生物技术(北京)有限公司。TB Green? Premix ExTaq?购自TaKaRa 公司。RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(离心柱型DP441)购自天根生化科技( 北京) 有限公司, Q5?High-Fidelity DNA Polymerases 购自NEB 公司。引物合成及测序由深圳华大基因科技有限公司完成。
1.2 方法
1.2.1 互作蛋白MeFKBP20 基因克隆及序列分析根据Phytozome v13 数据库(https://phytozomenext.jgi.doe.gov)公布MeFKBP20 基因(登录号:Manes.07G117900)序列,使用NCBI 数据库(https://www.ncbi.nlm.nih.gov)Primer-BLAST 工具设计该基因的特异性扩增引物及qPCR 定量检测引物(表1)。以SC8 木薯叶片cDNA 作为模板,使用Q5 DNA Polymerase(50 ℃退火20 s,72 ℃延伸 50 s)进行CDS 区序列扩增。PCR 产物纯化后回收目的片段,构建至中间载体pEASY-Blunt,转化大肠杆菌DH5α,筛选阳性克隆送深圳华大基因科技有限公司Sanger 测序,选取序列正确的阳性单克隆摇菌提取重组质粒。
使用DNAMAN v6 软件进行木薯、拟南芥、麻风树、山谷栎、橡胶树、蓖麻、水稻、番木瓜、甜橙、大豆、银白杨的FKBP20 蛋白氨基酸序列比对。
1.2.2 MeFKBP20 基因表达模式分析 以SC8 木薯新叶、成熟叶、顶芽、叶柄、块根木质部、块根韧皮部、须根及病原菌XpmCHN11 侵染0、3、6 h 和1、3、6 d 叶片的cDNA 为模板,木薯Tubulin基因作内参,使用 TB Green Premix Ex Taq Ⅱ 试剂盒进行实时荧光定量PCR分析MeFKBP20 基因的表达模式。每个样品设置3 个重复,采用2-ΔΔCT法计算基因相对表达量。
1.2.3 酵母双杂交验证蛋白MeHsfB3b 与MeFKBP20 的互作关系 将MeFKBP20 基因构建至pGBKT7 载体,与空载体pGADT7 通过酵母转化液共转至AH109 酵母细胞, 涂布在SD/-Trp/-Leu(SD/TL)平板筛选阳性克隆。液体SD/TL培养基扩大培养阳性单克隆, 梯度稀释, 点SD/-Trp/-Leu (SD/TL )、SD/-Trp/-Leu/-His/-Ade(SD/TLHA)、SD/-Trp/-Leu/-His/-Ade/+X-α-Gal平板进行毒性及自激活检测。
将无毒性、无自激活活性重组质粒pGBKT7-MeFKBP20 与pGADT7-MeHsfB3b 、pGADT7-MeHsfB3b(1~127 AA)、pGADT7-MeHsfB3b(1~201 AA)、pGADT7-MeHsfB3b(127~241 AA)分别共转化AH109 酵母细胞,通过营养缺陷型培养基筛选,验证互作关系及互作区域。
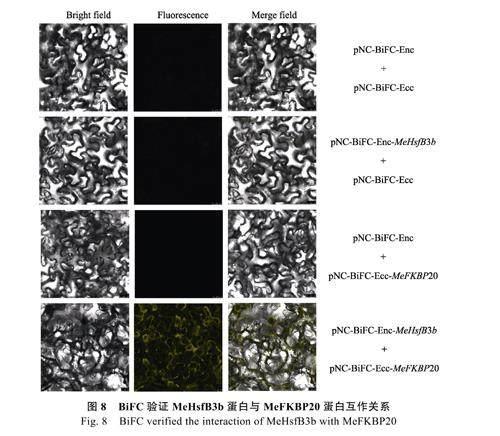
1.2.4 双分子荧光互补验证蛋白MeHsfB3b 与MeFKBP20 的互作关系 使用Nimble Cloning 試剂盒将MeHsfB3b 蛋白融合在nEYFP 的N 端获得pNC-BiFC-Enc-MeHsfB3b 载体,将MeFKBP20 蛋白融合在cEYFP 的N 端获得pNC-BiFC-Ecc-MeFKBP20 载体,转化农杆菌GV3101(pSoupp19)菌株。按照验证组(pNC-BiFC-Enc-MeHsfB3b+pNC-BiFC-Ecc-MeFKBP20)和对照组(pNC-BiFCEnc+pNC-BiFC-Ecc 、pNC-BiFC-Enc-MeHsfB3b+pNC-BiFC-Ecc 、pNC-BiFC-Enc+pNC-BiFC-Ecc-MeFKBP20)的菌液体积1∶1 混合注射本生烟草叶片,常规培养48~72 h,使用激光共聚焦显微镜观察YFP 荧光,拍照记录。
2 结果与分析
2.1 MeFKBP20 基因克隆及序列分析
根据木薯基因组数据库信息设计MeFKBP20基因的特异性引物,通过RT-PCR 扩增SC8 木薯品种的MeFKBP20 基因编码区, 结果获得约600 bp 的扩增产物(图1)。Sanger 测序显示获得1 个561 bp 基因片段,编码186 个氨基酸残基。蛋白序列比对分析发现,木薯MeFKBP20 蛋白与麻风树、橡胶树的FKBP20 同源性最高,分别为92.00%、91.43%,与山谷栎、蓖麻、番木瓜、甜橙、银白杨的FKBP20 同源性均大于84.00%,而与拟南芥、大豆、水稻的FKBP20 相似性较低,分别为82.29%、81.14%、80.11%。上述蛋白均具有完整的FKPB_C(FKBP-typepeptidyl-prolylcistransisomerase,PPIase)结构域(图2)。
2.2 MeFKBP20 基因表达模式分析
为了分析候选互作蛋白的潜在功能,通过实时荧光定量PCR研究其在不同组织部位及响应病原菌XpmCHN11 侵染的表达模式。结果发现,木薯MeFKBP20 基因在木薯成熟叶、块根木质部、块根韧皮部和须根的表达量均较高,而新叶、顶芽、叶柄的表达量则相对较低;木薯叶片在接种病原菌XpmCHN11 后,MeFKBP20 基因表达在6 h后显著升高,至接种的第6 天基因表达量较对照组增高近3.5 倍(图3)。以上结果表明,MeFKBP20基因的表达受到病原菌XpmCHN11 的诱导。
2.3 酵母双杂交点对点验证蛋白MeHsfB3b与MeFKBP20 的互作关系及互作位点
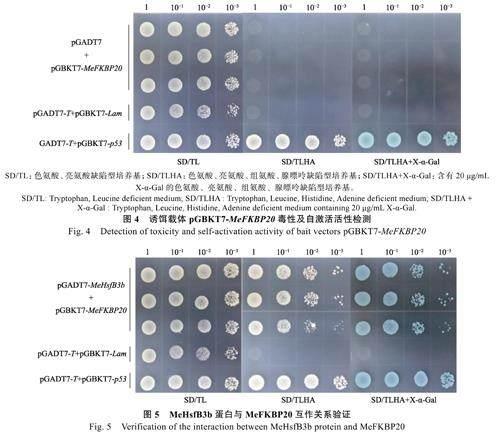
使用酵母转化液将诱饵载体pGBKT7-MeFKBP20 与空载pGADT7 共转至酵母AH109菌株,进行毒性及自激活活性检测,结果如图4所示。共转有诱饵载体pGBKT7-MeFKBP20+pGADT7 的酵母细胞,只能在SD/-Trp/-Leu 培养基生长,与阴性对照(pGADT7-T+pGBKT7-Lam)一致;而阳性对照(pGADT7-T+pGBKT7-p53)在所有缺陷型培养基均能正常生长,并且能够激活MEL1 报告基因合成α-半乳糖苷酶水解底物X-α-Gal 使菌斑呈现蓝色。以上结果表明,MeFKBP20 蛋白对酵母细胞无毒性且无自激活活性,可用于酵母双杂交点对点验证。
木薯MeHsfB3b 蛋白与MeFKBP20 蛋白酵母双杂交验证结果如图5 所示,共转pGADT7-MeHsfB3b 和pGBKT7-MeFKBP20 质粒的AH109酵母菌生长同阳性对照相似,能够在所有缺陷型培养基上正常生长,同时可以激活报告基因MEL1表达水解底物X-α-Gal 使菌斑呈现蓝色;而阴性对照则无法在SD/-Trp/-Leu/-His/-Ade 和SD/-Trp/-Leu/-His/-Ade/+X-α-Gal 培养基上生长。以上结果表明MeHsfB3b 蛋白与MeFKBP20 蛋白存在互作关系。
为了进一步研究 MeHsfB3b 蛋白与MeFKBP20蛋白的互作区域,根据MeHsfB3b 蛋白序列保守区域逐级截短为3 段(图6),分别构建至pGADT7载体。将含有MeHsfB3b 基因截短片段的重组质粒与pGBKT7-MeFKBP20 组合,共转化AH109酵母细胞,进行互作验证。结果如图7 所示,所有的菌落均可以在SD/-Trp/-Leu 培养基正常生长,而在SD/-Trp/-Leu/-His/-Ade 培养基上阴性对照与pGADT7-MeHsfB3b(1~127 aa)+pGBKT7-MeFKBP20 、pGADT7-MeHsfB3b ( 1~201 aa ) +pGBKT7-MeFKBP20 菌落均无法生长,仅含有pGADT7-MeHsfB3b ( 127~241 aa ) +pGBKT7-MeFKBP20 菌落能够正常生长并且在含有X-α-Gal 的平板变蓝色,与阳性对照一致。说明MeHsfB3b 蛋白通过201~241 aa 区域与MeFKBP20蛋白相互作用。
2.4 双分子荧光互补验证蛋白MeHsfB3b 与MeFKBP20 的互作关系
将MeHsfB3b 蛋白融合在nEYFP 的N 端、MeFKBP20 蛋白融合在cEYFP 的N 端构建BiFC验证载体,通过农杆菌介导的烟草叶片瞬时转化验证其互作关系。如图8 所示,所有对照组均无黄色荧光, 验证组pNC-BiFC-Enc-MeHsfB3b+pNC-BiFC-Ecc-MeFKBP20 在细胞膜发出黄色荧光。表明,MeHsfB3b 蛋白与MeFKBP20 蛋白在细胞膜发生相互作用。
3 讨论
热激转录因子作为植物体内重要的调控因子,广泛参与包括极端温度胁迫、干旱胁迫、盐碱胁迫的非生物胁迫响应以及病原菌、害虫造成的生物胁迫防御过程[10-11]。热激转录因子家族HsfA 亚族在其C 端具有AHA 基序的转录激活结构域, 可独立调控下游基因的表达。拟南芥AtHsfA6a 基因通过ABA 依赖性信号通路调节大量与胁迫相关的靶基因增强种子萌发期和幼苗期对盐胁迫和干旱胁迫的耐受性[25]。ZHOU 等[26]研究发现番茄受到RKNs(根结线虫属的植物寄生线虫)攻击时,HsfA1a 作为关键性调控因子接受应激信号转录表达,激活Wfi1(whitefly induced1)依赖性ROS 信号诱导受损细胞周围发生超敏反应(HR),进而防御RKNs 对植株的侵害。HsfB和HsfC 缺少该基序无转录激活活性无法调控下游基因[27]。有研究表明,HsfB 亚族可通过与其他蛋白的相互作用协同调控下游基因表达做出应激反应。番茄在热应激状态下,分子伴侣HSP90 协同HsfB1 既可作为热应激诱导基因(HS-gene)的中间阻遏物进行负调控,又可以作为其他转录因子的共激活因子被招募到管家基因(HK-gene)启动子区的Hsf 结合位点正调控基因表达[28]。木薯MeHsfB3b 基因分属于B 族,不具备转录激活结构域[29],可能通过与其他蛋白相互作用协同调控下游靶基因表达响应病原菌XpmCHN11 侵染。前期通过酵母双杂交文库筛选,获得候选互作蛋白MeFKBP20。本研究通过酵母双杂交点对点、双分子荧光互补实验证明MeHsfB3b 蛋白通过201~241 aa 区域与MeFKBP20 蛋白作用。
FKBPs 屬于FK506 结合蛋白家族,参与广泛的生物过程,包括转录调节、蛋白质折叠、信号转导和免疫抑制[30] 。CYBELLE 等[31] 发现PASTICCINO1(一种FKBP 蛋白)蛋白通过C 端结构域控制着蛋白的亚细胞分布以及与其他蛋白的相互作用,同时能够招募转录因子NAC 家族的成员,并将该转录因子靶向到细胞核中。有研究表明,过量表达辣椒FKBP15-2 可以增强植物对疫霉菌的免疫反应[24]。拟南芥敲除AtFKBP65 基因导致对丁香假单胞菌的敏感性增强,而过量表达会诱导WRKY33 和bGS2 基因转录在细胞壁积累更多的胼胝质阻止丁香假单胞菌快速侵入植物组织[32]。本研究通过对MeFKBP20 基因的表达模式分析发现该基因在华南8 号木薯多组织部位高表达,并且该基因的表达受到木薯细菌性枯萎病病原菌XpmCHN11 的诱导,表明该基因可能参与木薯对CBB 的响应过程。因此推测XpmCHN11病原菌侵染木薯诱导MeFKBP20 和MeHsfB3b 蛋白表达并相互作用,协同调控褪黑素合成基因表达,增强抗病性。在后续研究中,本课题组将通过转基因及基因编辑进行稳定的遗传转化,进一步验证MeFKBP20-MeHsfB3b 分子模块调控木薯抗病的功能,深入挖掘抗病功能基因资源,为培育抗细菌性枯萎病的木薯新种质提供理论依据和新的策略。

