大红和无刺黄龙火龙果不同发育阶段果实甜菜色素组分及含量差异分析
胡莺菊 何云 李洪立 洪青梅 濮文辉 李琼 胡文斌
关键词:火龙果;色泽;甜菜色素;组分;相关性分析;主成分分析
火龙果(Hylocereus undulatus Britt),属仙人掌科(Cactaceae)多年生攀援植物,因其色泽艳丽、风味独特、营养丰富而受到广大消费者的青睐[1-2]。在我国火龙果的种植主要集中于海南、广西、广东、云南、贵州、福建等地,为当地果农带来了良好的经济收益[3]。随着人们生活水平的提高,对果实品质也提出了新的需求。色泽作为评价火龙果果实外观品质的核心指标,对其果实及加工产品的商品价值有重要影响[4-5]。因此,改善果实色泽,提高其着色程度成为了当下育种者的主要研究方向之一。
果实色泽的形成主要源自于色素的积累,色素的种类与含量决定着果实的着色[6],常见的植物色素有花青素、甜菜色素、类胡萝卜素、叶绿素等。研究表明,火龙果果实的色素主要为甜菜色素,它在火龙果成色过程中扮演着关键角色[7-8]。甜菜色素作为一类水溶性含氮生物碱色素,主要包括以氨基酸为辅基的甜菜黄素和糖苷化的甜菜红素[9-10]。目前火龙果的商品果主要有红皮红肉、红皮白肉、黄皮白肉3 种类型,经前人研究发现,其发育过程可分为幼果期、膨大期、转色期、成熟期,幼果期甜菜色素无明显变化趋势,且3 种类型色泽的差异主要由甜菜色素导致[11-12]。目前关于火龙果中甜菜色素合成的代谢通路、调控的关键基因与转录因子等研究已有报道[13-18],但关于导致火龙果色泽差异现象的主要色素成分与变化规律还未明确。
因此,本研究以包含红皮、黄皮、红肉、白肉的具代表性的主栽品种红皮红肉型火龙果大红和黄皮白肉型火龙果无刺黄龙膨大期(坐果后13、16 d)、转色期(坐果后19、22 d)、成熟期(坐果后25、28 d)3 个时期(6 个不同发育阶段)的果实为材料,测量不同部位(果肉、果皮、萼片)色泽参数、甜菜色素总含量及甜菜色素组分和相对含量的变化,以探究火龙果果实色泽差异的形成机理,为阐述火龙果果实发育过程中的着色机制、甜菜色素的开发利用奠定理论基础。
1 材料与方法
1.1 材料
以中国热带农业科学院热带作物品种资源研究所儋州火龙果种质圃大红、无刺黄龙火龙果夏季果果实为实验材料,2 个品种夏季果果实自坐果至成熟所需时间均为28 d 左右,采样时间为6月21 日至7 月9 日。各品种采样6 次:(1)膨大期(坐果后13、16 d)2 次;(2)转色期(坐果后19、22 d)2 次;(3)成熟期(坐果后25、28 d)2 次。单次采集5 个果实,液氮速冻后用干冰冷藏运回实验室待测。
1.2 方法
1.2.1 色泽参数测定 采用BY-320 精密色差仪测量果实不同部位的a*、b*、L*值。a*、b*表示颜色组分,其中a*正值为红色,负值为绿色;b*正值为黄色,负值为蓝色;a*、b*值的绝对值越大,颜色越深。L*表示果实亮度,L*值越大,表示果实亮度越高。
1.2.2 甜菜色素测定 (1)色素提取。各时期、各部位样品分别匀浆后,准确称取匀浆样品2.00 g(精确至0.01 g)于50 mL 离心管中,加入20 mL30%乙醇水溶液,超声20 min;转速12 000×g 离心9 min 后,吸取上清液,用微孔滤膜(孔径0.22 μm)过滤样品,并保存于进样瓶中待测。
(2)甜菜色素总含量测定。甜菜色素总含量的测定参照周俊良等[19]的方法。
(3)甜菜色素组分与相对定量测定。甜菜色素组分的定性及相对定量测定参照阳辛凤等[7]的方法。以a 表示甜菜红素系列、b 表示甜菜色素代谢物系列、c 表示甜菜黄素系列,各组分分别表示为:a1(甜菜苷)、a2(丙二酰甜菜苷)、a3(Decarboxylated Phyllocactin)、a4(2-descarboxybetanidin)、a5(2,17-Decarboxyphyllocactin)、a6(decarboxylatedneo betanin)、a7(Prebetanin)、b1(甜菜苷配基)、b2(甜菜醛氨酸)、b3(环多巴)、b4(多巴)、b5(酪氨酸)、b6(色氨酸)、c1(梨果仙人掌黄质)、c2(亮氨酸-甜菜黄素)、c3(酪氨酸-甜菜黄素)。
1.3 数据处理
1.3.1 组分筛查 以Analyst 软件对样品信息进行采集,包括一级质谱信息與二级碎片信息,然后将数据导入PeakView 软件中通过实验室自建甜菜素筛查库进行检索,实现样品中甜菜素的筛查与确证。
1.3.2 数据分析 采用Microsoft Excel 和SPSS23.0 软件进行数据处理和差异显著性分析。
2 结果与分析
2.1 不同发育阶段果实色泽参数变化
2.1.1 不同发育阶段果实红绿色度值a*的变化由图1 可见,大红果肉a*值坐果后16 d 前绝对值趋近于0,坐果后16~28 d 呈逐渐升高趋势;果皮与萼片a*值坐果后13~19 d 均为负值,19~28 d 为正值且逐渐增加。无刺黄龙果肉a*值在整个发育期内绝对值均趋近于0,且差异不显著;果皮与萼片a*值在25 d 前均为负值,28 d 绝对值趋近于0。
2.1.2 不同发育阶段果实黄蓝色度值b*的变化由图2 可见,大红和无刺黄龙果肉b*值坐果后13~28 d 绝对值均趋近于0,大红果皮与萼片b*值坐果后22 d 显著增加而后下降;无刺黄龙果皮与萼片b*值坐果后13~19 d 呈平稳趋势,而后呈显著上升趋势。
2.1.3 不同发育阶段果实亮度值L*的变化 由图3 可见,大红3 个部位及无刺黄龙果肉L*值坐果后13~28 d 均呈下降趋势,无刺黄龙果皮与萼片L* 值坐果后13~19 d 差异不显著,坐果后19~28 d呈上升趋势。
2.2 不同发育阶段果实甜菜色素组分变化
2.2.1 大红不同发育阶段甜菜色素组分变化 由表1 可见,大红果肉坐果后13~16 d 未检测到甜菜色素组分,坐果后19 d 检测到5 种甜菜色素组分,分别为甜菜苷、甜菜苷配基、环多巴、多巴、梨果仙人掌黄质;坐果后22 d 检测到7 种甜菜色素组分, 在坐果后19 d 的基础上增加了Decarboxylated Phyllocactin 和2-descarboxy-betanidin;坐果后25~28 d 检测到9 种甜菜色素组分,在坐果后22 d 的基础上增加了丙二酰甜菜苷和decarboxylatedneo betanin 。大红果皮坐果后13~16 d 未检测到甜菜色素组分,坐果后19 d 检测到环多巴和多巴;坐果后22 d 检测到6 种甜菜色素组分,分别为甜菜苷、2-descarboxy-betanidin、甜菜苷配基、环多巴、多巴、梨果仙人掌黄质;坐果后25 d 在22 d 的基础上增加了丙二酰甜菜苷,坐果后28 d 共检测到9 种甜菜色素组分,在坐果后25 d 的基础上增加了Decarboxylated Phyllocactin和2,17-Decarboxyphyllocactin。大红萼片坐果后22 d 检测到了甜菜苷、环多巴、多巴和梨果仙人掌黄质4 种甜菜色素组分,坐果后25 d 和28d 分别在此基础上增加了丙二酰甜菜苷、2-descarboxy-betanidin 和2,17-Decarboxyphyllocactin。
2.2.2 无刺黄龙不同发育阶段甜菜色素组分变化由表1 可见,无刺黄龙果肉坐果后13~19 d 未检测到甜菜色素组分,坐果后22 d 检测到甜菜苷配基,坐果后25~28 d 检测到酪氨酸和甜菜苷配基。无刺黄龙果皮坐果后19 d 检测到酪氨酸,坐果后22~28 d 均检测到Prebetanin、酪氨酸、色氨酸、亮氨酸-甜菜黄素、酪氨酸-甜菜黄素5 种甜菜色素。无刺黄龙萼片坐果后22 d 检测到酪氨酸和亮氨酸-甜菜黄素,坐果后25~28 d 均检测到Prebetanin、酪氨酸、色氨酸、亮氨酸-甜菜黄素、酪氨酸-甜菜黄素。
2.2.3 大红和无刺黄龙不同发育阶段甜菜色素组分差异分析 大红果肉坐果后19 d 检测到甜菜色素组分,主要为甜菜色素代谢物,坐果后28 d 甜菜色素组分最为丰富,达到9 种;无刺黄龙果肉坐果后22 d 检测到酪氨酸,坐果后28 d 仅含2种甜菜色素,二者仅有甜菜苷配基1 种共有组分。大红和无刺黄龙果皮均坐果后19 d 开始检测到甜菜色素组分,但大红主要为甜菜醛氨酸,无刺黄龙主要为酪氨酸;大红果皮坐果后22~28 d 甜菜色素种类逐渐增加且在28 d 时主要为甜菜红素,无刺黄龙果皮22~28 d 甜菜色素种类均为5 种且主要为甜菜黄素。大红和无刺黄龙萼片均坐果后22 d 开始检测到甜菜色素组分,大红萼片坐果后25~28 d 甜菜色素种类逐渐增加,在坐果后28 d时达到7 种,无刺黄龙坐果后25~28 d 甜菜色素种类均为5 种且组分与其果皮一致。
2.3 不同发育阶段果实甜菜色素含量变化
2.3.1 大红不同发育阶段甜菜色素含量变化 由图4 及表1 可见,大红果肉坐果后13~16 d 未检测到甜菜色素,坐果后19~28 d 甜菜色素总含量逐渐增加,在28 d 达到峰值(27.28 mg/100 g)。坐果后19 d 甜菜色素组分以甜菜苷配基的相对含量最高(51.36%),坐果后22~28 d 以甜菜苷相对含量最高(33.45%~38.22%)。大红果皮甜菜色素总含量变化趋势与果肉一致,峰值(24.35 mg/100 g)较果肉略有下降。坐果后19 d 以甜菜醛氨酸相对含量最高(75.63%),坐果后22~28 d 以甜菜苷相对含量最高(43.62%~46.37%);此外,坐果后22 d梨果仙人掌黄质的相对含量达12.32%,为大红各部位、各时期的最高值。大红萼片坐果后13~19 d未检测到甜菜色素,坐果后22 d 甜菜色素含量为0.81 mg/100 g,随后逐渐增加,在坐果后28 d 达到峰值(14.98 mg/100 g)。坐果后22 d 多巴相对含量最高为55.83% , 坐果后25 d 以甜菜苷(29.88%),多巴(33.52%)相对含量较高;坐果后28 d 以甜菜苷相对含量最高(32.45%)。
2.3.2 无刺黄龙不同发育阶段甜菜色素含量变化由图4 及表1 可见,无刺黄龙果肉坐果后13~16 d未检测到甜菜色素,坐果后19~28 d 甜菜色素含量低且差異不显著。无刺黄龙果皮坐果后19 d 甜菜色素总含量为3.57 mg/100 g,仅含酪氨酸;坐果后22 d 甜菜色素总含量为4.63 mg/100 g,以亮氨酸-甜菜黄素的相对含量最高(38.76%);坐果后25 d 甜菜色素总含量为4.87 mg/100 g,坐果后28 d 含量为10.33 mg/100 g,各组分相对含量与坐果后22 d 差异不显著。无刺黄龙萼片坐果后13~22 d 未检测到甜菜色素,坐果后25 d 甜菜色素含量为4.49 mg/100 g,以亮氨酸-甜菜黄素的相对含量最高(40.4%),坐果后28 d 甜菜色素含量为5.29 mg/100 g,各组分相对含量与坐果后25 d 差异不显著。
2.3.3 大红和无刺黄龙不同发育阶段甜菜色素含量差异分析 大红果肉坐果后19 d 甜菜色素组分以甜菜苷配基含量最高,坐果后22~28 d 以甜菜苷含量最高;无刺黄龙果肉坐果后22 d 仅含酪氨酸,坐果后25~28 d 以酪氨酸含量最高。大红果皮坐果后19 d 以甜菜醛氨酸含量最高,坐果后22~28 d 以甜菜苷含量最高;无刺黄龙果皮坐果后19 d 仅含酪氨酸,坐果后22~28 d 以亮氨酸-甜菜黄素含量最高。大红萼片坐果后坐果后22~25 d 多巴含量最高,坐果后28 d 甜菜苷含量最高;无刺黄龙萼片坐果后22 d 以酪氨酸含量最高,坐果后25~28 d 以亮氨酸-甜菜黄素含量最高。
2.4 果实色泽参数与甜菜色素总含量的相关性分析
由表2 可见,大红果肉、果皮、萼片甜菜色素总含量均与a*值呈显著正相关(P<0.05),相关系数为0.817、0.827、0.904;大红果皮与萼片L*值呈显著负相关,相关系数为-0.818、-0.878。无刺黄龙果皮甜菜色素总含量与b*值呈显著正相关,相关系数为0.893;萼片甜菜色素总含量与a*、b*均呈极显著正相关(P<0.01),与L*值呈显著正相关,相关系数分别为0.994、0.928、0.821;果肉甜菜色素总含量与a*、b*、L*的相关性均未达显著水平。
2.5 果实色泽参数与甜菜色素各组分含量的相关性分析
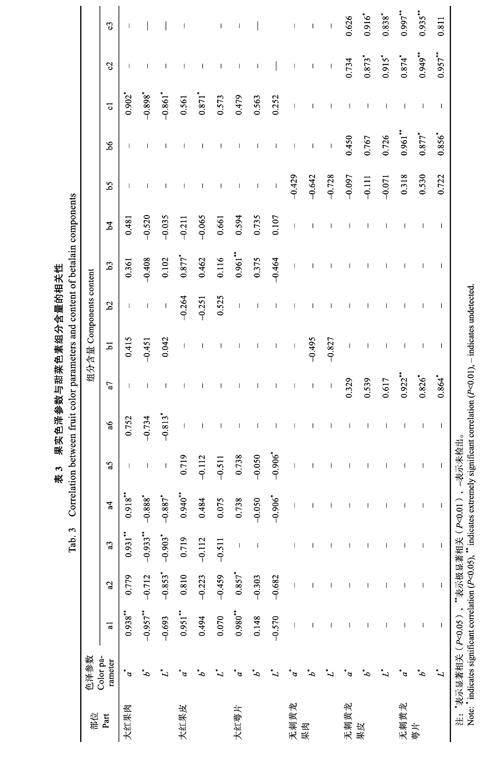
2.5.1 大红火龙果色泽参数与甜菜色素各组分含量的相关性 由表3 可见,大红果肉a*值与甜菜苷、Decarboxylated Phyllocactin、2-descarboxy-betanidin的含量均呈極显著正相关,相关系数分别为0.938、0.931、0.918;b*值与甜菜苷和DecarboxylatedPhyllocactin 呈极显著负相关,相关系数分别为?0.957、?0.933,与2-descarboxy-betanidin、梨果仙人掌黄质呈显著负相关,相关系数为?0.888、?0.898;L*值与丙二酰甜菜苷、Decarboxylated Phyllocacti、2-descarboxy-betanidin、descarboxylatedneobetanidin、梨果仙人掌黄质呈显著负相关,相关系数为?0.853、?0.903、?0.887、?0.813、?0.861。大红果皮a*值与甜菜苷、Decarboxylated Phyllocactin呈极显著正相关,相关系数为0.951、0.940,与环多巴呈显著正相关,相关系数为0.877;b*值与梨果仙人掌黄质呈显著正相关( 系数为0.871),L*值与各组分相关性均不显著。大红萼片a*值与甜菜苷、环多巴的含量呈极显著正相关,相关系数为0.989、0.961,与丙二酰甜菜苷显著相关(系数为0.857);b*值与各组分相关性均不显著;L*值与2-descarboxy-betanidin、2,17-Decarboxyphyllocactin 含量呈显著负相关,相关系数分别为?0.906、?0.906。
2.5.2 无刺黄龙火龙果色泽参数与甜菜色素各组合含量的相关性 无刺黄龙果肉与各组分含量的相关性均未达显著水平;果皮的b*、L*值均与亮氨酸-甜菜黄素、酪氨酸-甜菜黄素的含量呈显著正相关,相关系数分别为0.873、0.916、0.915、0.838;萼片b*值与亮氨酸-甜菜黄素、酪氨酸-甜菜黄素的含量呈极显著正相关,相关系数分别为0.949、0.935。
2.6 果实甜菜色素组分的主成分分析
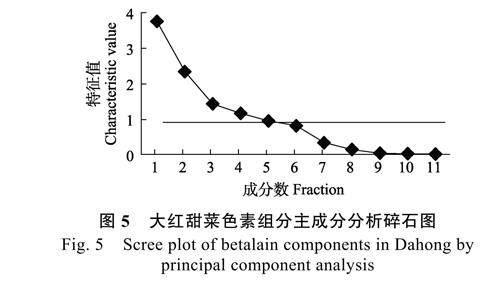
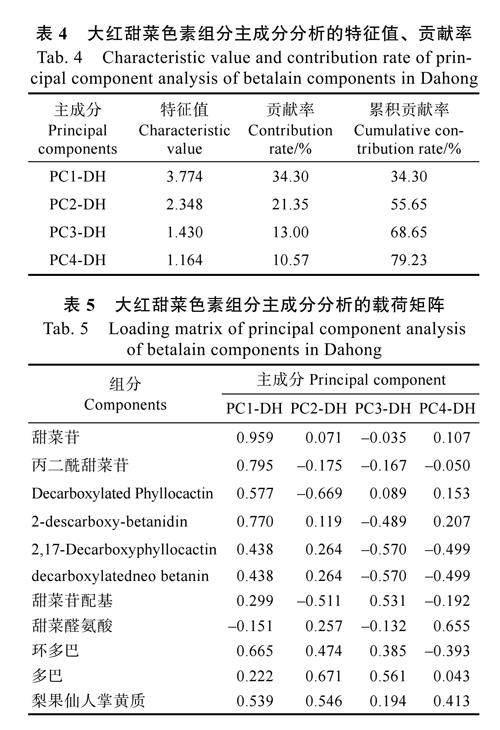
2.6.1 大红甜菜色素组分主成分分析 主成分特征值碎石图曲线的陡峭程度,可以直接反映各成分的变化趋势,进而明确主成分的提取数量。由图5 可知,大红甜菜色素前3 个主成分的特征值呈快速下降趋势,且从第8 个主成分特征值开始,碎石图曲线趋于平滑且平稳。由表4 可知,前4个主成分的特征值分别为3.774、2.348、1.430、1.164,具有较高的代表性,其累积贡献率近80%。因此,可选取前4 个主成分作为大红甜菜色素组分的分析指标。
第1 主成分甜菜红素类(PC1-DH)的方差贡献率为34.30%(表4),主要综合了甜菜苷、丙二酰甜菜苷、环多巴等组分(表5);第2 主成分甜菜红素与代谢物综合类(PC2-DH)的方差贡献率为21.35%,主要综合了2,17-Decarboxyphyllocactin、甜菜醛氨酸、环多巴等组分;第3 主成分代谢物与甜菜黄素综合类(PC3-DH)的方差贡献率为13.00%,主要综合了甜菜苷配基、环多巴、多巴、梨果仙人掌黄质等组分;第4 主成分甜菜色素综合类(PC4-DH)的方差贡献率为10.57%,主要综合了2-descarboxy-betanidin、甜菜醛氨酸、梨果仙人掌黄质等组分。
2.6.2 无刺黄龙甜菜色素组分主成分分析 通过主成分分析(图6、表6、表7)得出,在无刺黄龙火龙果中,前2 个主成分的特征值变化趋势陡峭且大于1,分别为3.703 和1.350,具较高的代表性,贡献率达84.21%。因此,可选取前2 个主成分作为无刺黄龙甜菜色素组分的分析指标。第1 主成分甜菜黄素类(PC1-WCHL)的方差贡献率为61.71%,主要综合了亮氨酸-甜菜黄素、酪氨酸-甜菜黄素、Prebetanin 等组分;第2 主成分甜菜色素综合类(PC2-WCHL)的方差贡献率为22.50%,主要综合了酪氨酸、甜菜苷配基等组分。
3 结论
色泽参数是反映果实着色变化最直观的指标之一,其数值可以准确客观地评价果实色泽变化。大红果肉a*值坐果后16 d 前趋近于0,而后逐渐增加呈现红色;果皮与萼片a*值坐果后19 d 前为负值,19~28 d 为正且呈上升趋势,b*值坐果后22 d 显著增加而后下降,表现为由绿色先转为红黄色而后转为红色。无刺黄龙果肉a*、b*值在整个发育期内趋近于0,未出现红绿、黄蓝色,果皮与萼片a*值在25 d 前为负值,28 d 绝对值趋近于0,b*值坐果后13~19 d 呈平稳趋势,而后显著上升,表现为由绿色转为黄色。与已有研究[11]对比,在红皮红肉火龙果果皮由绿色转为红色的基础上,发现了大红果皮坐果后22 d 色泽呈现红黄色,而后转为红色。
大红火龙果坐果后13~16 d 未检测到甜菜色素,19 d 以甜菜色素代谢物相对含量最高,未发生转色;22~28 d 以甜菜红素的种类及相对含量最高,且总含量逐渐增加,表现为红色逐渐加深;果皮在22 d 梨果仙人掌黄质的相对含量达12.32%,为大红各部位、各时期的最高值,表现为红黄色。无刺黄龙火龙果果肉坐果后13~16 d未检测到甜菜色素,19~28 d 甜菜色素含量低且主要为甜菜色素代谢物,未发生转色。果皮13~16 d未检测到甜菜色素,19 d 仅有酪氨酸(甜菜色素代谢物)未发生转色;22~28 d 以亮氨酸-甜菜黄素的相对含量最高,且总含量逐渐增加,表现为黄色逐渐加深。萼片13~22 d 未检测到甜菜色素,25~28 d 以亮氨酸-甜菜黄素的相对含量最高,黄色逐渐加深。由此可推测,大红火龙果的红色主要由甜菜红素导致,无刺黄龙的黄色主要由甜菜黄素导致,甜菜色素代谢物在火龙果中未呈色;此外,甜菜红素和甜菜黄素的占比会直接影响火龙果色泽的呈现。
通过相关性分析可得,大红3 个部位的a*值与甜菜色素总含量呈显著正相关,与甜菜苷的含量呈极著正相关。无刺黄龙果皮、萼片的b*值与甜菜色素总含量和亮氨酸-甜菜黄素的含量均呈显著正相关,果肉甜菜色素总含量与a*、b*、L*值的相关性均未达显著水平。对2 个品种的甜菜色素组分进行主成分分析,大红提取了4 个主成分,累积方差贡献率达79.23%;第1 主成分甜菜红素类贡献率为34.30%,主要综合了甜菜苷、丙二酰甜菜苷等组分;第2 主成分甜菜红素及代谢物综合类贡献率为21.35% , 主要综合了2,17-Decarboxyphyllocactin、甜菜醛氨酸等。无刺黄龙提取了2 个主成分,累计率达84.21%;第1主成分甜菜黄素类贡献率为61.71%,主要综合了亮氨酸-甜菜黄素、酪氨酸-甜菜黄素等组分。大红第一主成分甜菜红素类的贡献率相对较低,未达到预期水平;这可能是由于其甜菜红素种类更为丰富,单一主成分无法达到较高的贡献率。
在本研究中大红和无刺黄龙果皮与萼片随着甜菜色素的增加逐渐转色;无刺黄龙果肉仅含甜菜色素代谢物未发生转色;WYBRANIEC 等[20]指出甜菜色素是导致火龙果与其杂交种果实颜色差别的原因;SVENSON 等[21]还指出块根作物美洲落葵马铃薯红色块根鲜重所含甜菜红素与黄色块根鲜重所含甜菜黄素的占比均较高,从而影响了其块根颜色,与本研究结果相似。结合相关性和主成分分析,进一步推测,大红果实的红色主要由甜菜苷、丙二酰甜菜苷、2,17-Decarboxyphy llocactin 贡献,无刺黄龙果皮与萼片的黄色主要由亮氨酸-甜菜黄素贡献,这为火龙果色泽的评价和育种提供了新的思路。
本研究通过探讨了大红和无刺黄龙火龙果不同发育阶段色泽参数与甜菜色素总含量、组分与相对含量的变化,阐述了火龙果果实色泽差异的形成机理,为探究火龙果果实的着色机制、色泽的评价及甜菜色素的开发利用提供理论依据和技术支撑。

