CsSSK1基因调控暹罗炭疽菌胁迫应答和致病性的功能分析
鲁婧文 关小灵 李潇 张宇 缪卫国 林春花

关键词:暹罗炭疽菌;CsSSK1 基因;功能分析;药剂敏感性;致病性
微生物在环境中生长发育和繁殖,必须通过一系列复杂的细胞信号网络来感知并适应各种环境压力。双组分系统(two-component signalingsystem, TCS)是细菌、真菌、粘菌及高等植物中普遍存在的一类信号传递调节系统,在细胞应答胁迫响应、调控病原菌药剂敏感性和毒力中发挥重要作用[1]。真核生物的TCS 通常由组氨酸激酶(histidine kinase, HK)、组氨酸基团的磷酸转移蛋白(phosphotransferase, HPt)及应答调节蛋白(response regulator, RR)三部分构成[2],如模式生物酵母的双组分系统由Sln1-Ypd1-Ssk1 组成[3]。已有研究显示双组分信号蛋白对真菌病原体胁迫反应和抗药性的重要性,如尖孢镰刀菌(Fusariumoxysporum)中组氨酸激酶FHK1 缺失对高渗胁迫和氧胁迫敏感,增强对吡咯类药剂的抗性[4];稻瘟菌(Magnaporthe oryzae)中同源的组氨酸激酶HIK1 的缺失突变体对高渗透压有影响,但对致病力影响不大。同时发现稻瘟菌(M. oryzae)双组分系统2 个RR 基因(MoSSK1 和MoSKN7)共同调控稻瘟菌对渗透压和咯菌腈的敏感性[5-6]。
SSK1 是双组分系统的应答调控蛋白,在真核细胞中充当接收和传递信号的功能[7-8]。大量研究显示,病原真菌中的SSK1 与病原菌的形态建成、胁迫反应、耐药性和致病力有关,但在不同病原菌中其功能存在差异。如在稻瘟菌(M. oryzae)中的MoSSK1 参与对渗透胁迫的响应以及对咯菌腈的敏感性调控[9];在灰霉菌(Botrytis cinerea)中,SSK1 同源基因的缺失丧失产孢能力,对渗透胁迫和氧胁迫敏感,并且对异菌脲、咯菌腈和三唑酮敏感性增强[10];在大丽轮枝菌(Vertilillium dahliae)中VdSsk1 基因与病原菌的压力胁迫反应、黑色素的合成和致病力相关,还与咯菌腈、异菌脲等杀菌剂敏感性调控有关[11];而在白念珠菌(Candidaalbicans)中SSK1 缺失突变体对高盐敏感并且参与氟康唑敏感性调控[12-13];但在克鲁氏乳酸酵母菌(Kluyveromyces lactis)中SSK1 基因不影响高渗敏感性[14]; 在丝状真菌柄孢霉(Podosporaanserina)中PaSSK1 基因也不影响氟康唑敏感性[15]。此外,SSK1 在炭疽菌中的功能尚无报道。
炭疽菌(Colletotrichum spp.)是一类重要的植物病原丝状真菌,引起许多果树、蔬菜等重要经济作物的炭疽病[16]。暹罗炭疽菌(C. siamense)是胶孢炭疽菌复合群中的一个种,是我国橡胶树炭疽病的田间优势病原种,也是许多热带、亚热带作物的主要病原菌,如芒果[17]、荔枝[18]、咖啡[19]、槟榔[20]等。本课题组前期已克隆了暹罗炭疽菌CsSSK1 基因序列,本研究基于已有基础,利用同源重组替换技术,构建暹罗炭疽菌的双组分系统中CsSSK1 基因缺失突变体和回补菌株,并进行表型观察,研究结果不仅有助于进一步了解暹罗炭疽菌中的CsSSK1 基因功能,还可为深入了解病原菌如何应答胁迫反应的分子机理奠定基础。
1 材料与方法
1.1 材料
供试菌株和质粒:暹罗炭疽菌(C. siamense)HN08 菌株分离自海南省琼中新进农场橡胶树病叶,由本实验室分离、鉴定、保存,重组载体pCX62-S(含抗性基因ILV1)由本实验室前期构建并保存;酵母感受态XK-125、回补载体pXY203(S-tag 标签、潮霉素抗性基因HPH)由本实验室保存;大肠杆菌(Escherichia coli)DH5α 感受态细胞购自上海唯地生物技术有限公司。
培养基:PDA 培养基、PDS 培养基、CM 培养基、DCM 培养基、TB3 培养基、YPD 培养基、SD/-Trp培养基、LB 培养基,配置方法参照参考文献[8]。
供试药剂:99.5%氯化钠(NaCl)、98%山梨醇(sorbitol)、98%葡萄糖(glucose)、99.7%蔗糖(sucrose),均購自西陇科学股份有限公司;Congo red(刚果红)购于北京拜尔迪生物技术有限公司。使用前将99.3%咯菌腈原药(广州硕普生物科技有限公司) 用无菌水溶解, 配置成50 mg/mL 的母液;99%氟康唑原药(海南正业中农高科股份有限公司)用无菌水溶解,配置成5 mg/mL 的母液;97%戊唑醇原药(海南正业中农高科股份有限公司)用无菌水溶解,配置成50 mg/mL 的母液。
试剂:限制性内切酶XhoⅠ、EcoRⅠ、T4 连接酶购自宝生物工程(大连)有限公司;通用型DNA 纯化回收试剂盒、DNA 提取试剂盒及质粒提取试剂盒购自美国Omega 公司;溶壁酶购自广州微生物研究所;潮霉素、DIG High Prime DNALabeling and Detection Starter Kit Ⅰ购于Roche公司;引物合成和测序由生工生物工程(上海)股份有限公司完成。
主要仪器:高速冷冻离心机,Eppendorf 公司(德国);PCR 扩增仪,BIO-RAD 公司(美国);台式恒温振荡器,美国精骐有限公司。
1.2 方法
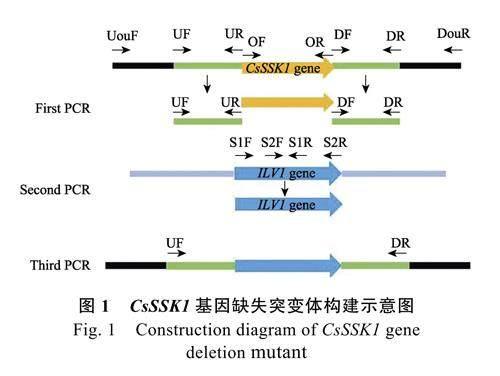
1.2.1 ΔCsSSK1 基因缺失突变菌株构建及验证根据前人的研究方法[21],利用基因同源重组法,构建缺失突变体ΔCsSSK1(图1),引物序列见表1。首先用带有ILV1 基因接头的引物对SSK1-UF/UR、SSK1-DF/DR 从野生型HN08 DNA 中扩增出CsSSK1 目的基因上下游片段,用引物S2R/S1F 从pCX62-S 载体中扩增出ILV1 基因全长,再利用融合PCR体系将扩增出的基因上下游片段与ILV1 基因片段连接起来,最后以连接的片段作为模板,用引物SSK1-UF/SSK1-DR 大量扩增融合片段,使用通用型DNA 纯化回收试剂盒回收后,获得同源重组片段。利用PEG 介导的原生质体和同源重组的方法[22],将片段转入野生型HN08 原生质体中,在含有50 μg/mL 氯嘧磺隆的DCM 平板培养基上进行筛选。
初筛得到的转化子再在含100 μg/mL 氯嘧磺隆的DCM 平板上复筛后,提取转化子DNA 进行PCR 检测(引物所在位置见图1,引物序列见表1),分别利用外部引物对SSK1-UouF/DouR、基因内部引物对SSK1-OF/OR,以及和ILV1 基因内部引物S1R、S2F 组合进行PCR 验证。此外,利用Southern Blot 技术对敲除转化子内整合的ILV1 基因拷贝数进行验证,提取野生型和ΔCsSSK1 突变体转化子DNA,用EcoRⅠ内切酶进行酶切,以ILV1 基因的PCR 片段为探针进行杂交,杂交步骤参照DIG High Prime DNA Labeling and DetectionStarter Kit Ⅰ。
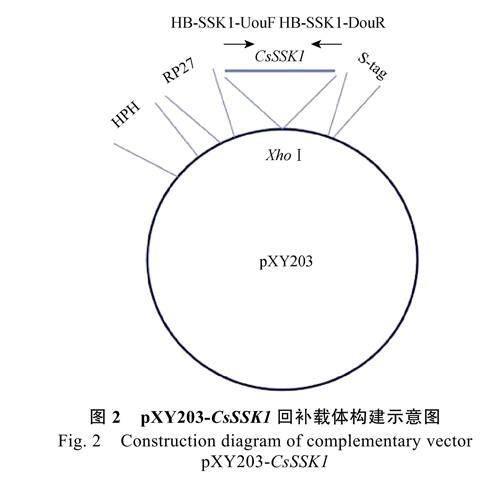
1.2.2 回补菌株ΔCsSSK1(CsSSK1)的获得 以野生型HN08 DNA 为模板,用引物HB-SSK1-UouF/UouR 扩增CsSSK1 基因及其自身启动子序列(3282 bp),将PCR 扩增片段与经XhoⅠ内切酶酶切回收的pXY203 载体一同转化到酵母菌XK-125 中,然后涂布于SD/-Trp 平板上,置于30 ℃培养3 d 后挑取酵母单克隆进行菌落PCR 验证。验证正确的质粒再转入大肠杆菌DH5α,获得回补载体pXY203-CsSSK1,将回补载体转入缺失突变体ΔCsSSK1 的原生质体中(原生质体转化步骤同上),在含有300 μg/mL 潮霉素的PDS 平板培养基上进行筛选。待长出转化子后,挑取转化子到新的含有400 μg/mL 潮霉素的PDS 平板培养基上进行复筛,用引物HB-SSK1-UouF 与载体pXY203 引物stag-R 对回补转化子进行PCR验证(引物位置见图2),最终获得含有重组质粒pXY203-CsSSK1 的回补转化子ΔCsSSK1(CsSSK1)。12.5 μL PCR 反应体系:6 μL 2×Taq PCRMaster Mix,10 μmol/L 引物各0.5 μL,0.5 μL 模板,加ddH2O 补足至12.5 μL。PCR 反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,35 个循环;最后72 ℃延伸10 min。4 ℃保存。
1.2.3 菌落形态观察及生长速率测定 将野生型HN08、突变体ΔCsSSK1 及回补菌株ΔCsSSK1(CsSSK1)分别接种于PDA 平板,培养3 d 后刮取菌丝置于PD 液体培养基中于28 ℃、150 r/min 培养5 d,用灭菌Miracloth 过滤,5000 g 离心3 min后用无菌水重悬孢子。利用血球计数板调整孢子悬浮液浓度至105 个/mL,接种于CM 培养基上,置于28 ℃培养5 d 后测量菌落直径。
1.2.4 分生孢子形态观察及产孢量和萌发率测定分生孢子形态观察:用上述方法培养野生型HN08(WT-HN08)、ΔCsSSK1、ΔCsSSK1(CsSSK1)分生孢子,分生孢子悬浮液浓度调至5×105 个/mL,备用。吸取供试菌株的分生孢子悬浮液20 μL 滴于载玻片表面,用显微镜观察孢子形态,并分别选取100 个分生孢子,测量长度和宽度,重复3 次。
产孢量统计:用4 mL 无菌水洗下平板表面的分生孢子,再用灭菌Miracloth 过滤至2 mL 离心管中,用无菌水将孢子液定容至1 mL。吸取10 μL孢子液于血球计数板上,用血球计数板在显微镜下统计分生孢子数目。
萌发率统计:用无菌水收集孢子液并将浓度调至105 个/mL 左右。取10 μL 孢子液滴至疏水玻片表面,置于保湿盒中进行保湿处理,分别在0、2、4、6、8 h 在显微镜下观察孢子萌发情况并记录,重复3 次,根据试验数据进行计算和处理。
1.2.5 胁迫响应及药剂敏感性测定 配制含药的CM 培养基,使其分别含0.5 mol/L NaCl、1.0 mol/LNaCl、1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L葡萄糖、100 μg/mL 刚果红,以及不同浓度药剂咯菌腈(0.1、0.5、1.0、5.0 μg/mL)、2.5 μg/mL氟康唑、0.5 μg/mL 戊唑醇。分生孢子悬浮液配制方法同上,取10 μL 分生孢子悬浮液(105 个/mL)接种于含药培养基平板中央,置于28 ℃培养5 d,采用“十”字交叉法測量菌落直径并拍照记录。计算抑制率,抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.6 致病力测定 用血球计数板将分生孢子悬浮液浓度调至106 个/mL,将其接种于未刺伤和刺伤的离体橡胶树叶片上,每次接种10 μL,重复30 张叶片,在接种后5 d 左右观察发病情况,拍照并测量病斑面积。
1.3 数据处理
采用 SPSS 软件对试验数据进行统计分析,应用Duncans 新复极差法进行差异显著性检验。
2 结果与分析
2.1 暹罗炭疽菌CsSSK1 基因敲除突变体及其回补菌株的获得
利用基因同源重组法, 构建缺失突变体ΔCsSSK1。在含氯嘧磺隆药剂平板上筛选获得36个转化子,经过多对引物PCR 验证,筛选获得1个缺失突变体ΔCsSSK1。PCR 验证结果见图3A,利用引物对SSK1-OF/SSK1-OR 在野生型菌株中可扩增获得1 条大小为2018 bp 的条带(泳道4),在ΔCsSSK1 突变体转化子中未检测到该序列条带(泳道8);在ΔCsSSK1 中,利用引物SSK1-UouF和ILV1 基因内部S1R 在ΔCsSSK1 突变体中可扩增到1 条大小为2280 bp 的条带(泳道6),利用SSK1-DouR 与ILV1 基因S2F 扩增到1 条大小为2548 bp 的条带(泳道7),而野生型中未扩增出相应大小的条带(泳道2 和3);用外部引物SSK1-UouF 及SSK1-DouR 在野生型菌株中可扩出1 条大小为3413 bp 的条带(泳道1),在ΔCsSSK1 突变体中扩增出1 条大小为4212 bp 的条带(泳道5)。经测序分析,显示目的基因CsSSK1(2018 bp)被ILV1 基因(2817 bp)所替换。通过Southern blot分析显示(图3B),以ILV1 基因内部序列为探针,在ΔCsSSK1 基因组DNA 中杂交仅产生1 条条带,而与野生型HN08 基因组DNA 杂交未产生条带,说明ΔCsSSK1 基因组内仅整合1 个拷贝的ILV1基因序列。研究结果说明ΔCsSSK1 确实是CsSSK1基因缺失突变体。
通过原生质体转化法,将构建的pXY203-CsSSK1 质粒载体转入ΔCsSSK1 突变体中获得回补转化子ΔCsSSK1(CsSSK1),利用引物HB-SSK1-UouF 與载体pXY203 引物stag-R 进行验证(图3A)。在缺失突变体ΔCsSSK1 中未检测到扩增条带(泳道9),而回补转化子ΔCsSSK1(CsSSK1)及回补载体pXY203-CsSSK1 可扩增到1 条大小为3382 bp 的目的条带(泳道10 和11),说明目的序列已重新转入,获得基因回补菌株ΔCsSSK1(CsSSK1)。
2.2 暹罗炭疽菌突变体ΔCsSSK1 菌株的表型观察
2.2.1 对菌落形态及生长速率的影响 在CM 培养基上突变体ΔCsSSK1 菌株的菌落形态和野生型菌株无明显差异,但菌落直径较小,菌落直径测定结果显示,ΔCsSSK1 菌株较野生型HN08 小12.50%(图4)。结果说明CsSSK1 基因影响暹罗炭疽菌菌落的生长速率。
2.2.2 对产孢量、分生孢子形态及萌发率的影响经显微观察,ΔCsSSK1 的分生孢子比WT-HN08明显较短圆(图5A),长度比WT-HN08 短22.80%,宽度增14.01%(图5B)。分生孢子产量测定结果显示,WT-HN08 的孢子浓度约为(1.43±0.056)×106 个/mL,而ΔCsSSK1 敲除突变体的孢子浓度约为(0.43±0.043)×106 个/mL,回补菌株ΔCsSSK1(CsSSK1)的孢子浓度约为(1.13±0.032)×106 个/mL,ΔCsSSK1 敲除突变体的产孢量明显减少(图5C)。结果说明CsSSK1 基因影响暹罗炭疽菌分生孢子的产孢量及分生孢子的大小。
孢子萌发率测定结果显示,在接种后0~8 h内,ΔCsSSK1 的分生孢子萌发率低于WT-HN08 和回补菌株ΔCsSSK1(CsSSK1),其中接种6 h 后,WTHN08分生孢子萌发率为82.75%±0.097%,ΔCsSSK1的萌发率为76.84%±0.10%,ΔCsSSK1(CsSSK1)的萌发率为83.95%±0.045%(图5D)。说明CsSSK1的缺失会降低暹罗炭疽菌分生孢子的萌发。
2.2.3 对盐胁迫、渗透胁迫及刚果红胁迫的反应在含有0.5、1.0 mol/L NaCl,1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L 葡萄糖、100 μg/mL 刚果红的培养基上测量供试菌株菌落直径, 与WT-HN08 相比,ΔCsSSK1 在含0.5、1.0 mol/L NaCl的平板上菌落直径减小,抑制率分别为75.3%和100%,说明ΔCsSSK1 对高盐胁迫反应敏感;ΔCsSSK1 在1.0 mol/L 山梨醇、1.0 mol/L 蔗糖、1.0 mol/L 葡萄糖平板上菌落直径减小,抑制率依次为74.0%、81.5%、77.4%,说明ΔCsSSK1 对高渗透胁迫反应敏感;此外,在100 μg/mL 刚果红平板上ΔCsSSK1 菌落直径也减小,抑制率为15.1%,说明ΔCsSSK1 对刚果红胁迫反应敏感,推测该基因影响细胞壁完整性(图6)。结果表明,CsSSK1 基因参与应答盐胁迫和渗透胁迫,可能影响细胞壁完整性。
2.2.4 对药剂胁迫反应 通过测定化学药剂咯菌腈、氟康唑和戊唑醇对供试菌株的影响,结果显示,在含咯菌腈平板上,与WT-HN08 相比,ΔCsSSK1突变体的菌落直径均极显著增加,ΔCsSSK1 在咯菌腈浓度梯度为0.1、0.5、1.0、5.0 μg/mL 的平板上,其抑制率依次为15.6%、20.0%、17.5%、30.0%;在三唑类杀菌剂氟康唑和戊唑醇平板上,ΔCsSSK1突变体的菌落直径减小,抑制率分别为21.6%和48.1%(图7)。显著性分析结果表明,CsSSK1 基因负调控炭疽菌对咯菌腈的敏感性,但正调控其对氟康唑、戊唑醇的敏感性。
2.2.5 致病力测定 在刺伤和未刺伤的橡胶树叶片上分别接种供试菌株,5 d 后测量病斑面积。结果显示,在刺伤和未刺伤叶片上,ΔCsSSK1 突变体的病斑面积均比WT-HN08 极显著减小,分别减少79.8%和86.9%(图8)。表明CsSSK1 基因参与暹罗炭疽菌的致病力调控。
3 讨论
炭疽病是橡胶树重要的叶部病害之一,目前国内外对橡胶树炭疽菌的耐药性分子机制及致病力的研究基础还较薄弱。本研究构建了CsSSK1基因敲除突变体及回补菌株,表型观察证实了暹罗炭疽菌CsSSK1 基因影响炭疽菌的菌落生长速率、分生孢子大小、产孢量及分生孢子萌发率,参与盐胁迫、渗透胁迫和刚果红胁迫反应,负调控炭疽菌对咯菌腈药剂的敏感性,正调控其对氟康唑和戊唑醇的敏感性,且影响致病力。
SSK1 作为双组分系统的应答调节蛋白,在病原菌中具有许多功能,但不同病原真菌的SSK1基因功能存在差异。很多研究均显示,SSK1 可参与渗透胁迫反应,如稻瘟菌(Magnaporthe oryzae)与灰霉菌(Botrytis cinerea)中的SSK1 同源基因等[9-10]; 但克鲁氏乳酸酵母菌(Kluyveromyceslactis)中的SSK1 基因缺失对高渗透压的敏感性无影响[14]。在药剂敏感性调控方面,不同病原菌中该基因缺失对药剂敏感性的表型也不尽相同。有研究显示该基因缺失可对吡咯类等药剂表现抗性,如稻瘟菌中的MoSSK1[9]和链格孢菌(Alternaria alternata)中的SSK1[23];但在部分真菌中的表现却相反,如灰霉菌中SSK1 的缺失对异菌脲、咯菌腈和三唑酮3 种杀菌剂更敏感,在白念珠菌(Candida albicans)中CaSSK1 突变体对氟康唑敏感[12-13];也有些病原菌,如丝状真菌柄孢霉(Podospora anserina)中,ΔPaSSK1 突变株对氟康唑不敏感[15]。并且不同病原菌在致病力方面也存在差异,灰霉菌中的SSK1 同源基因Brrg-1 不参与毒力调控;而大丽轮枝菌(Verticillium dahliae)中的VdSsk1、莱氏野村菌(Nomuraea rileyi)中的Nrssk1、禾谷镰刀菌(Fusarium graminearum)中的FgRrg-l(同源于酿酒酵母的Ssk1)均参与致病力的调控[11, 24-25]。本研究对暹罗炭疽菌的CsSSK1 基因功能进行分析发现,CsSSK1 基因的缺失不仅对盐胁迫和渗透胁迫敏感,对咯菌腈抗性增强,还对刚果红、氟康唑和戊唑醇敏感性增强,并且使炭疽菌致病力降低,研究结果说明在不同病原真菌中的SSK1 基因功能存在一定差异。但CsSSK1 基因的这些功能对调控炭疽菌的胁迫响应、耐药性、致病力等分子机制尚无相关研究,后续可进一步分析CsSSK1 的互作蛋白及上下游调控因子,可为深入了解CsSSK1 如何影响相关功能进行深入分析,为解析炭疽菌致病机理和应答抗逆反应的分子机理奠定基础。

