抗磷脂综合征并发颅内静脉窦血栓临床特点
赵久良,张 遥,孙伊多,王 迁,李梦涛,徐 东,曾小峰
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿病学教育部重点实验室,北京 100730)
抗磷脂综合征(antiphospholipid syndrome,APS)是一种以反复血管性血栓事件、自发性流产、血小板减少等为主要临床表现,伴有抗磷脂抗体中度或高度阳性的非炎症性自身免疫性疾病。APS通常可分为原发APS和继发APS,后者往往继发于系统性红斑狼疮、干燥综合征等结缔组织病。APS临床表现复杂多样,全身各个系统均可以受累,中枢神经系统是容易受累的重要脏器之一。颅内静脉窦血栓形成(cerebral venous sinus thrombosis,CVST)在APS中较少见,临床症状无明显特异性,早期诊断困难,部分病例进展迅速,容易误诊漏诊,因而增加患者致残甚至死亡的风险。国内外对APS并发CVST报道仅限于个案,缺少大样本量研究,本文回顾性分析近10年北京协和医院住院诊治的APS并发CVST的临床资料,并与性别、年龄均匹配的非APS并发CVST患者的临床特点及实验室检查进行比较,筛查CVST可能的高危因素,期望增加临床医生的认识,做到早期诊断、早期治疗,改善结局。
对象和方法
研究对象和分组
收集2004年1月至2014年12月于北京协和医院住院治疗的APS并发CVST患者(病例组)的临床资料。APS诊断符合2006年悉尼国际APS会诊修订的分类标准[1],部分APS患者继发于系统性红斑狼疮(systemic lupus erythematosus,SLE),符合1997年美国风湿病协会SLE的诊断标准[2]。CVST的诊断主要采取临床表现及头颅磁共振成像(magnetic resonance imaging,MRI)联合磁共振静脉成像(magnetic resonance venography,MRV)检查,部分患者行全脑数字减影血管造影(digital substraction angiography,DSA)进一步核实,MRV或DSA显示1个或者多个静脉窦部分或者完全充盈缺损则诊断CVST。病因筛查:通过详细询问病史和体格检查除外恶性肿瘤、口服避孕药、妊娠期、围产期、头面部外伤及感染等可能病因。以1∶3进行配对,对照组为同一时期北京协和医院住院治疗的非CVST的APS患者,与病例组年龄相差3岁。
方法
分析APS并发CVST患者的一般状况、神经系统症状和体征、脑脊液变化、实验室检查、影像学、治疗和转归等临床资料。病例组与对照组就临床特点及实验室检查结果进行比较,分析颅内静脉窦血栓高危因素。
统计学处理
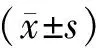
结 果
一般情况
APS并发CVST患者共14例,占同期APS住院患者的3.3%(14428),其中女性8例(57.1%),男性6例(42.9%),中位年龄为34.5(22.0,48.5)岁。14例APS并发CVST患者中,10例(71.4%)为原发性APS,4例(28.6%)继发于SLE,无继发于其他结缔组织病病例。
对照组纳入42例患者,女性24例(57.1%),中位年龄为35.0(21.8,49.0)岁;其中30例(71.4%)为原发性APS,12例(28.6%)继发于SLE。
与对照组比较,病例组中位病程较短(3.5个月vs.12.0个月),但差异无统计学意义(P=0.053)(表1)。
APS相关临床表现
病例组患者皮肤表现(网状青斑、皮肤溃疡、下肢浅表性静脉炎)及其他静脉血栓事件和动脉血栓事件与对照组比较,差异均无统计学意义(P>0.05)。
病例组补体水平降低发生率明显高于对照组,差异有统计学意义(57.1%vs.19.0%,P=0.006);两组在血红蛋白水平降低、血小板减少、D-二聚体升高、红细胞沉降率增高、抗核抗体阳性、抗人球蛋白试验阳性、抗磷脂抗体阳性比较,差异无统计学意义(P>0.05)(表2)。
单因素Logistic回归分析显示,补体降低比值比为5.667(95%CI:1.530~20.982,P=0.009)。
CVST相关临床表现
病例组中,12例(85.7%)出现头痛,5例(35.7%)出现恶心、呕吐,6例(42.9%)在病程中曾经出现意识障碍,3例(21.4%)表现为抽搐,3例(21.4%)出现肢体活动障碍,4例(28.6%)脑膜刺激征阳性,8例(57.1%)出现视盘水肿(表3)。
1例患者因为血小板重度减低未能完善腰穿检查,另外13例完善腰穿检查的患者中,12例(92.3%)出现脑脊液(cerebro-spinal fluid,CSF)压力升高,其中5例(38.5%)>330 mm H2O,5例(38.5%)CSF蛋白升高,仅有1例(7.7%)CSF中WBC升高,随后检查发现并发脑膜炎。
14例患者均完善头颅CT检查,仅4例(28.6%)有异常发现,包括3例(21.4%)表现为脑组织水肿,2例(14.3%)出现典型的束带征和空三角征。所有患者均进行了头MRI检查,9例(64.3%)患者有异常发现,表现为脑组织水肿。所有患者均进行了MRV检查,其中横窦受累13例(92.9%),乙状窦9例(64.3%),上矢状窦6例(42.9%),下矢状窦4例(28.6%),直窦2例(14.3%),窦汇2例(14.3%)。
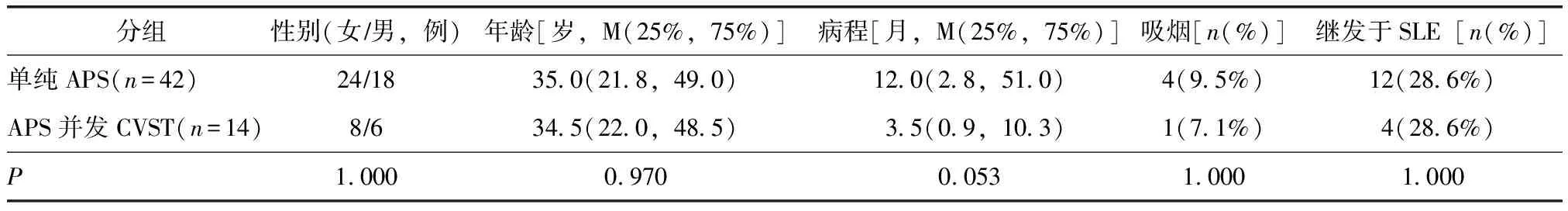
表1 两组患者基线人口统计学资料
APS:抗磷脂综合征;CVST:颅内静脉窦血栓形成
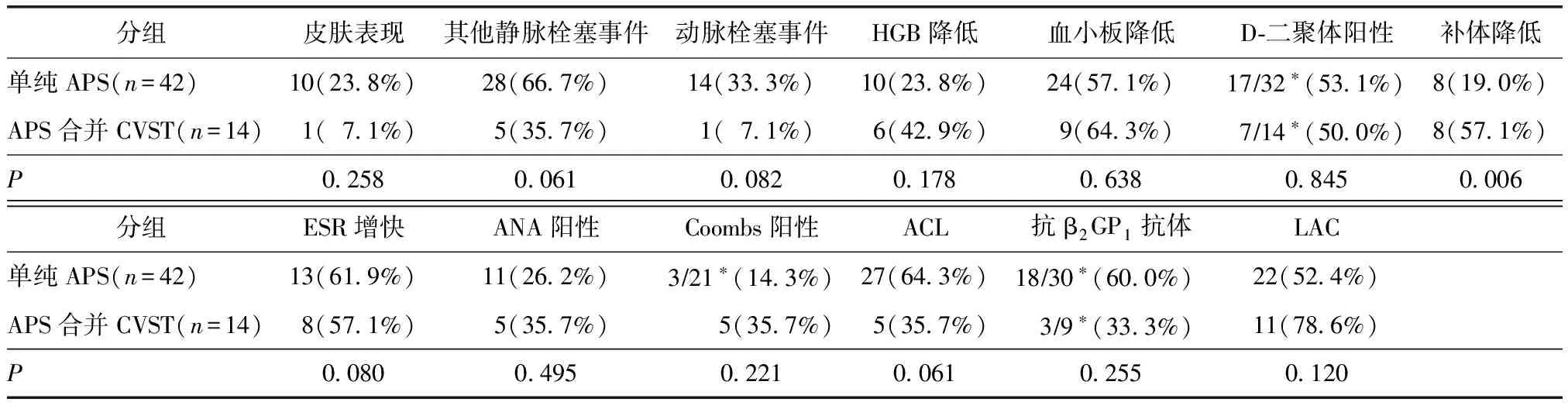
表2 两组患者临床特征比较
*实际检查人数;APS:抗磷脂综合征;CVST:颅内静脉窦血栓形成;HGB血红蛋白;ESR:红细胞沉降率;ANA:抗核抗体;Coombs:抗人球蛋白抗体;ACL:抗心磷脂抗体;抗β2GP1抗体:抗β2糖蛋白1抗体;LAC:狼疮抗凝物4例(28.6%)进行了DSA检查,均见病灶部位静脉窦不显影或者显影不良,与MRV完全一致。
治疗及转归
除1例患者因考虑无急性症状,并且已经形成颅内静脉侧枝循环,仅接受阿司匹林抗血小板治疗之外。其余13例患者均接受抗凝治疗。其中2例患者接受了静脉窦内尿激酶溶栓治疗,序贯应用低分子肝素抗凝,11例患者直接应用低分子肝素抗凝,出院前过渡为口服华法林抗凝,同时所有患者均接受脱水降颅压治疗。10例患者接受大剂量激素及免疫抑制剂治疗,免疫抑制剂包括环磷酰胺、环孢菌素等。仅1例患者治疗过程中意识障碍明显加重,最终放弃治疗出院,其余13例患者病情改善,规律抗凝治疗,未再出现病情复发(表3)。
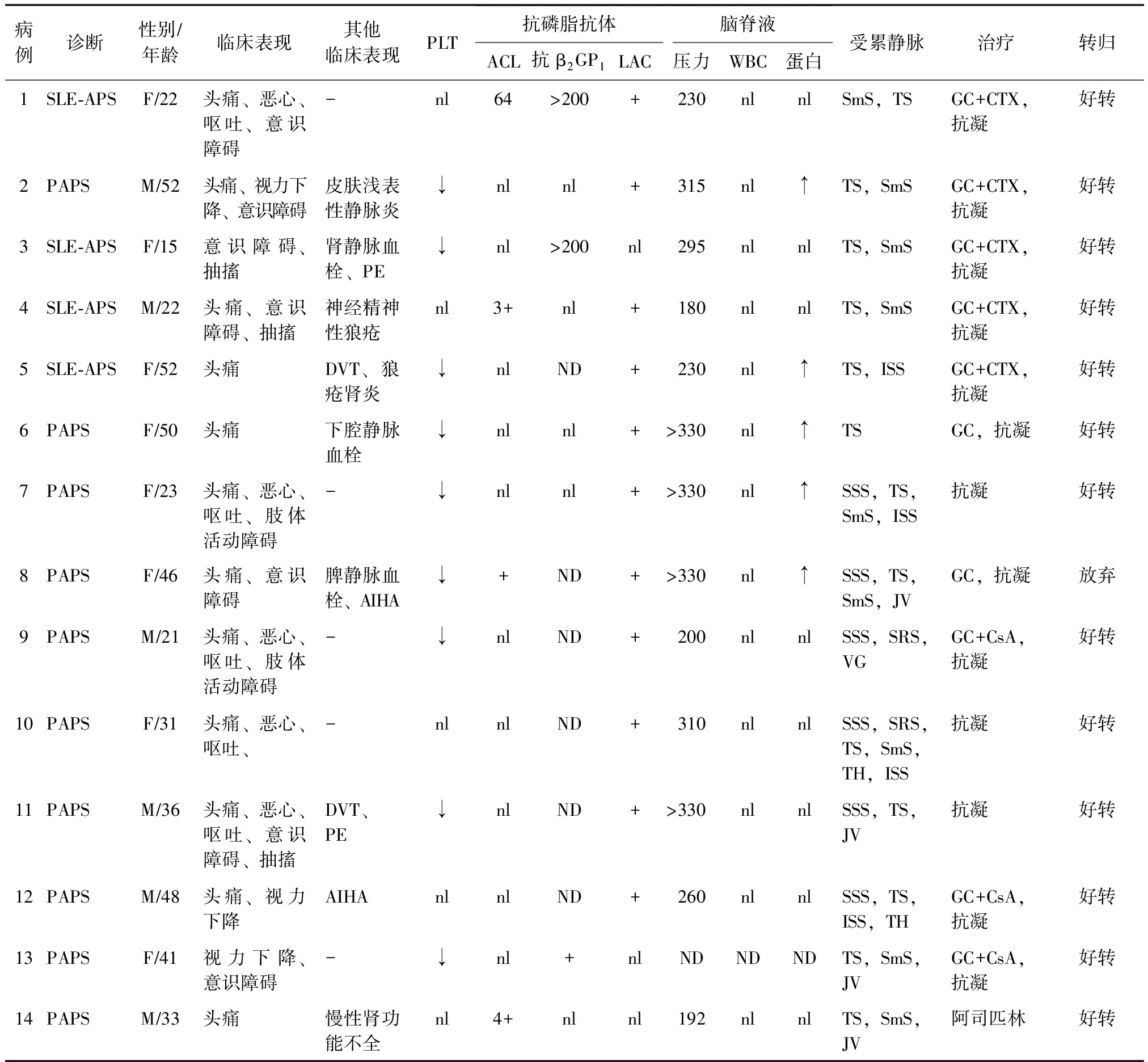
表3 APS并发CVST患者临床特点
APS:抗磷脂综合征;CVST:颅内静脉窦血栓形成;PLT:血小板;ACL:抗心磷脂抗体;抗β2GP1:抗β2糖蛋白1抗体;LAC:狼疮抗凝物;WBC:白细胞计数;SSS:上矢状窦;ISS:下矢状窦;TS:横窦;TH:窦汇;SRS:直窦;SmS:乙状窦;VG:大脑大静脉;JV:颈静脉;SV:皮层静脉;PE:肺栓塞;DVT:深静脉血栓;AIHA:自身免疫性溶血性贫血;CsA:环孢菌素;GC:糖皮质激素;CTX:环磷酰胺;nl:正常;ND:未做
讨 论
中枢神经系统是APS患者容易受累的重要脏器之一,可以为APS的首发症状,亦可以在病程中出现,临床表现复杂多变,包括脑缺血事件、癫痫、痴呆、认知功能障碍、头痛、精神心理障碍、舞蹈症、横贯性脊髓炎等[3],其中最常见的为脑血管病变。CVST作为一种罕见的脑血管病变,其起病隐匿,临床表现多种多样,缺乏特异性,早期诊断及早期治疗可以明显降低该病的死亡率,并且明显提高预后,值得进行总结,以期提高风湿免疫科医生的认识。
CVST病因复杂,容易漏诊及误诊,头痛多为首发症状,本组14例患者中12例表现有头痛,占85.7%,颅高压患者亦可表现为呕吐,视乳头水肿,视力下降和意识障碍等,少部分患者出现抽搐,肢体瘫痪等局灶性神经功能缺损的症状,抗磷脂综合征是常见原因之一,建议CVST患者常规筛查抗磷脂抗体,警惕APS。APS患者临床上出现头痛、恶心、呕吐、意识障碍等症状时需高度警惕CVST可能性,尽早行头颅MRI+MRV评估明确诊断。
MRI结合MVR是诊断CVST的首选检查方法,据有高度敏感性,也为早期确诊提供重要依据[4],并且能够准确描述静脉窦血栓形成的部位。本研究14例患者均进行了MRI和MRV检查,MRV检查提示所有患者均有受累静脉窦不同程度的闭塞,不规则狭窄或者充盈缺损。根据近期文献报道,CVST好发部位依次为横窦(86%)、上矢状窦(62%)、直窦(18%)、皮层静脉(17%)、颈静脉(12%)等[5-7]。这与APS相关CVST易发部位与文献中一致,横窦、乙状窦最常见,其次为上、下矢状窦,并且大多数患者存在2处及2处以上的静脉窦血栓形成。
实验室检查方面,与对照组比较,病例组患者补体降低的发生率显著升高,为57.1%,明显高于对照组的19.0%。APS动物模型实验研究显示,经典途径的补体活化与抗磷脂综合征的血栓事件之间显著相关[8]。抗磷脂抗体使得补体活化并产生C5a,与中性粒细胞结合并使其活化,最终导致组织因子的表达[9]。基于该项实验研究,有研究者提出补体C3和C5可能成为治疗抗磷脂综合征的潜在药物靶点[10],因而APS患者并发低补体血症可能提示存在血栓栓塞事件。本文14例APS患者中6例患者继发于SLE,根据王立等[7]临床观察研究,SLE并发CVST患者往往原发病病情活动,其补体降低发生率为61.5%(8/13),尽管对照组存在相同匹配的继发APS患者,但仍然存在SLE病情是否活动的混杂因素,因此可能需要在较大样本量的原发性APS观察研究中进一步证实。CVST发生的常见原因除血液高凝倾向、头面部外伤及感染等因素外,全身炎症性病变亦是血栓形成因素之一[5],如系统性红斑狼疮、肉芽肿性多血管炎、炎症性肠病和白塞病等,在该情况下会出现ESR、超敏C反应蛋白等炎性指标升高,本研究病例组和对照组ESR升高发生率无明显差异,可能与病例组71.4%患者为原发性APS相关。病例组的狼疮抗凝物阳性率高达78.6%,而对照组阳性率为54.2%,提示狼疮抗凝物阳性可能为APS患者出现静脉窦血栓的危险因素。这与多篇文献中报道结果相一致,目前狼疮抗凝物被认为是APS患者血栓事件最强的危险因素[11],其OR值为3.6~9.4[12-13]。但本研究病例组和对照组狼疮抗凝物阳性率差异无统计学意义,这可能与本研究样本量不够大有关,期待将来较大样本量的前瞻性队列研究进一步证实。
CVST的主要治疗手段为去除诱因和抗凝治疗,急性期应用低分子肝素抗凝至关重要,可以阻止血栓进一步扩大,并提高血栓再通率,推荐序贯予口服华法林长期抗凝治疗[14]。病例组中10例患者由于血小板减低、或者自身免疫性溶血性贫血、或继发于SLE而加用激素及免疫抑制剂治疗,1例患者由于临床无急性症状,并且影像学提示颅内静脉已经形成侧枝循环,而单用抗血小板治疗。经过积极的治疗,本组13/14例患者好转,规律抗凝治疗后未出现病情复发,而其他原因所致的CVST死亡率高达8%~14%[15-16],提示APS并发CVST经过积极治疗,其预后优于其他诱因所致的CVST或者特发性CVST。
综上所述,CVST是APS的少见中枢神经系统并发症之一,部分患者以CVST为APS首发症状,早期诊断难度较大。对于无感染、外伤、手术等明确诱因的CVST患者需要及时筛查抗磷脂抗体,警惕APS可能。对于APS患者临床上出现头痛、视物模糊、恶心、呕吐等颅高压相关症状时,需要高度警惕CVST可能,应尽早完善头颅影像学评估,做到早期诊断、早期治疗,且APS患者出现低补体血症、狼疮抗凝物阳性可能为出现CVST的危险因素之一。经过积极的抗凝和降颅压治疗,大部分患者病情可得以控制和好转,少部分患者预后较差,临床医生应予以足够重视。
[1]Miyakis S,Lockshin MD,Atsumi T,et al.International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS)[J].J Thromb Haemost,2006,4:295-306.
[2]Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40:1725.
[3]Miroslav M,Mislav C,Marko R,et al.Antiphos- pholipid syndrome and central nervous system[J].Clin Neurol Neurosurg,2010,112:602-608.
[4]Terazzi E,Mittino D,Rudà R,et al.Cerebral venous thrombosis:a retrospective multicentre study of 48 patients[J].Neurol Sci,2005,25:311-315.
[5]Stam J.Thrombosis of the cerebral veins and sinuses[J].N Engl J Med,2005,352:1791-1798.
[6]Ferro JM,Canhao P,Stam J,et al.Prognosis of cerebral vein and dural sinus thrombosis:results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT)[J].Stroke,2004,35:664-670.
[7]王立,陈华,张奉春,等.系统性红斑狼疮合并静脉窦血栓的临床特点[J].中华临床免疫和变态反应杂志,2014,8:113-118.
[8]Fischetti F,Durigutto P,Pellis V,et al.Thrombus formation induced by antibodies to beta 2-glycoprotein I is complement dependent and requires a priming factor[J].Blood,2005,106:2340-2346.
[9]Pierangeli SS,Girardi G,Vega-Ostertagm M,et al.Espinola and J.Salmon Requirement of activation of complement C3 and C5 for antiphospholipid antibody-mediated thrombophilia[J].Arthritis Rheum,2005,52:2120-2124.
[10] Shapira I,Andrade D,Allen SL,et al.Brief report:induction of sustained remission in recurrent catastrophic antiphospholipid syndrome via inhibition of terminal complement with eculizumab[J].Arthritis Rheum,2012,64:2719-2723.
[11] Devreese KM.Antiphospholipid antibodies:evaluation of the thrombotic risk[J].Thromb Res,2012,130 Suppl 1:S37-40.
[12] Ginsberg JS,Wells PS,Brill-Edwards P,et al.Antiphospholipid antibodies and venous thromboembolism[J].Blood,1995,86:3685-3691.
[13] Galli M,Luciani D,Bertolini G,et al.Lupus anticoagulants are stronger risk factors for thrombosis than anticardiolipin antibodies in the antiphospholipid syndrome:a systematic review of the literature[J].Blood,2003,101:1827-1832.
[14] Martinelli I.Cerebral vein thrombosis[J].Thrombosis Research,2013,131:S51-S54.
[15] Dentali F,Gianni M,Crowther MA,et al.Natural history of cerebral vein thrombosis:a systematic review[J].Blood,2006,108:1129-1134.
[16] Girot M,Ferro JM,Canhao P,et al.Predictors of outcome in patients with cerebral venous thrombosis and intracerebral hemorrhage[J].Stroke,2007,38:337-342.

