肺表面活性蛋白D基因多态性与华中地区过敏性鼻炎遗传易感性
邓玉琴,陶泽璋,孔勇刚,许 昱,陈始明,肖伯奎
(武汉大学人民医院耳鼻咽喉-头颈外科,武汉 430060)
过敏性鼻炎(allergic rhinitis,AR)已成为全球共同关注的疾病[1]。目前认为,过敏性鼻炎是一种由遗传因素和环境因素共同导致的多基因、免疫性疾病[2]。遗传和环境因素共同决定疾病的发生,但对于大多数过敏性鼻炎患者其易感因素仍不清楚,寻找过敏性鼻炎易感基因己成为国际上研究的热点。
单核苷酸多态性(single-nucleotide polymorphisms,SNP)是人基因组最为广泛的遗传变异,它体现人群个体差异的DNA序列变化中最基本和最常见的形式,人DNA变异的90%由SNP贡献。近年来,人们对肺表面活性物质相关蛋白在肺外组织中显示出的强大炎症和免疫调节功能越来越关注[3-4],特别是发现其家族成员的SNP与细支气管炎、肺结核、肺泡蛋白沉积症、囊性纤维病呈显著相关性。肺表面活性蛋白D(surfactant protein D,SP-D)属于肺表面活性物质相关蛋白中的一员,人类SP-D基因位于染色体10q21~q24。目前,已鉴定人类SP-D编码区存在3个位点SNP,即Met11Thr(rs721917)、Ala160Thr(rs2243639)和Ser270Thr(rs3088308),其中已发现Met11Thr位点的SNP与结核[5]、呼吸道合胞体病毒[6]、呼吸窘迫综合征[7]和甲型流感病毒[8]感染有关。研究显示,SP-D的Met11Thr位点多态性可能与哮喘有关[9]。哮喘与过敏性鼻炎具有相似的遗传学背景,SP-D的SNP是否与过敏性鼻炎有关,尚未见国内外有关研究报道。本研究收集具备相似生活环境的我国南方就诊患者作为研究对象,利用焦磷酸测序技术检测SP-D在上述3个位点的SNP,并分析3个位点不同基因型的血清总IgE和特异性IgE之间的关系,以探讨SP-D的SNP与过敏性鼻炎的关联性。
资料和方法
对象与分组
根据中华医学会耳鼻喉科学分会武夷山会议过敏性鼻炎诊断标准[10],选择就诊于武汉大学人民医院耳鼻咽喉-头颈外科216例[113例女性,103例男性,平均年龄为(34.3±14.38)岁]过敏性鼻炎患者,所有患者均有过敏性鼻炎的典型症状,并经粉尘螨、屋尘螨、艾蒿、豚草、花粉等8种过敏原皮肤点刺试验检测(阿罗格点刺液,德国)和6种过敏原血清特异性IgE(户尘螨/粉尘螨、矮豚草/高葎草、霉菌、动物皮屑等)检测,至少有1种过敏原反应试验阳性以上(表1),试验结果与病史相一致。
正常对照组84名,其中40名女性,44男性,平均年龄为(43.3±11.53)岁。对照组均无过敏性鼻炎、哮喘等过敏性疾病病史,皮肤点刺试验和过敏原血清特异性IgE检测结果均为阴性。

表1 216例过敏性鼻炎患者过敏原检测结果
所有研究对象均是汉族成年人群,居住在我国南方地区。通过问卷调查和当场询问的方式询问每例患者的病史资料,包括家族史、母孕期有无致敏及用药史、出生时是否早产、生活环境、是否养宠物等,建立详尽的病史资料档案。
方法
基因组DNA提取:采外周静脉血5ml,EDTA-K2抗凝,-20℃暂存,按基因组DNA提取试剂盒(血液DNA提取试剂盒,北京天根生物工程有限公司)操作说明提取DNA,-20℃保存。
引物设计和合成:所有寡核苷酸引物均由大连宝生物公司合成,设计引物序列见表2。
聚合酶链反应:聚合酶链反应(polymerase chain reaction,PCR)体积50 μl,含10×PCR反应缓冲液4 μl,25mM MgCl2、25mM dNTP各1 μl,100 μM PCR正向引物及反向引物各1 μl,Taq DNA聚合酶2U及2 μl(约200 ng)基因组DNA模板。PCR反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,共循环30次,随后72℃延伸5 min。所有过程均在ABI公司9700型PCR仪上完成。
单链DNA模板的制备:rs3088308的PCR反向引物为5′端生物素标记,rs721917及rs2243639的引物均为正向。在40 μl PCR扩增产物中加入36 μl结合缓冲液(Pyrosequencing AB公司试剂)及4 μl链亲和素(strepta-vidin)包被的磁珠,室温下孵育5 min,用Pyrosequencing AB公司专用单链纯化装置吸取吸附有PCR产物的琼脂糖珠。依次用70%乙醇,变性缓冲液,清洗缓冲液各清洗15 s,然后将琼脂糖珠转移到预先加有45 μl退火缓冲液(含0.3uM测序引物)的pyro96孔板中。
焦磷酸测序:实时焦磷酸测序在PSQ96微测序仪进行,采用Pyrosequencing公司PSQ96 SQATM试剂盒,参照试剂盒操作说明进行。将PSQTM 96孔板中,置于80℃变性2 min,待冷却至室温后,将96孔板放入PSQ96测序仪样本舱中,PSQ96-SQATM酶混合物(包括DNA Polym erase、ATP Sulfurylase、Luciferase和Apyrase)和底物混合物(包括APS和Luciferin)加入SQA反应筒中,测序反应自动进行[11-12]。测序反应图像和数据由PSQ96 MA2.1软件分析处理,得到SNP测定结果。
血清IgE检测:利用人免疫球蛋白酶联免疫吸附试验试剂盒检测血清中总IgE水平。采用敏筛过敏原定量检测系统检测患者血清中户尘螨/粉尘螨等6种过敏原特异性IgE水平。血清特异性IgE水平>0.35 kU/L表示该过敏原阳性。
统计学分析
采用SHEsis在线软件(http://analysis.bio-x.cn/myAnalysis.php)分析是否符合Hardy-Weinberg平衡定律和连锁不平衡。基因型和等位基因频率采用频率计数法计算,基因型及组间等位基因频率比较采用四格表χ2检验或四格表确切概率法。使用SPSS(13.0版本)软件中方差分析(ANOVA)比较不同基因型与血清特异性IgE之间的关系,所有统计检验均为双侧概率检验,P<0.05为差异有统计学意义。
结 果
焦磷酸测序分析及基因型鉴定
过敏性鼻炎组和对照组SP-D 3个位点的基因型分布均符合Hardy-Weinberg平衡定律(均P>0.05)。
过敏性鼻炎组rs721917位点CC基因型频率及等位基因C的频率均高于对照组,差异有统计学意义(P值分别为0.007和0.006)。rs2243639及 rs3088308位点基因型频率和等位基因频率在过敏性鼻炎组和对照组间差异无统计学意义(均P>0.05)(表3)。
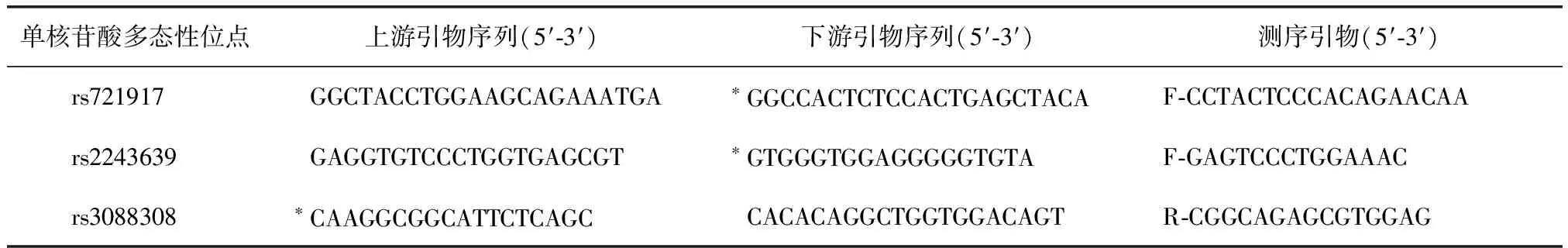
表2 肺表面活性蛋白D单核苷酸多态性引物序列
*:生物素标记;F:正向引物;R:反向引物
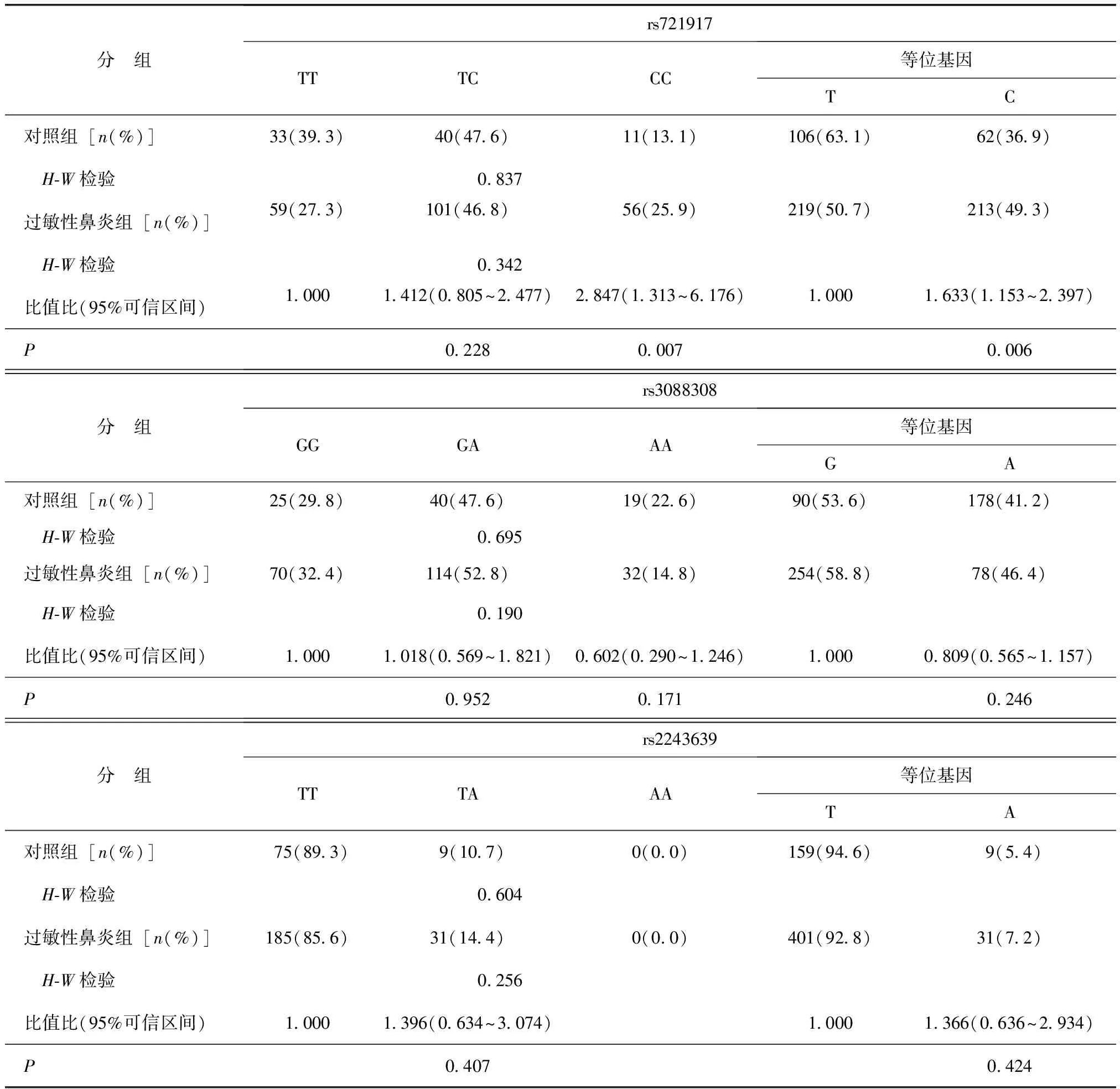
表3 两组肺表面活性蛋白D基因位点基因型、等位基因比较
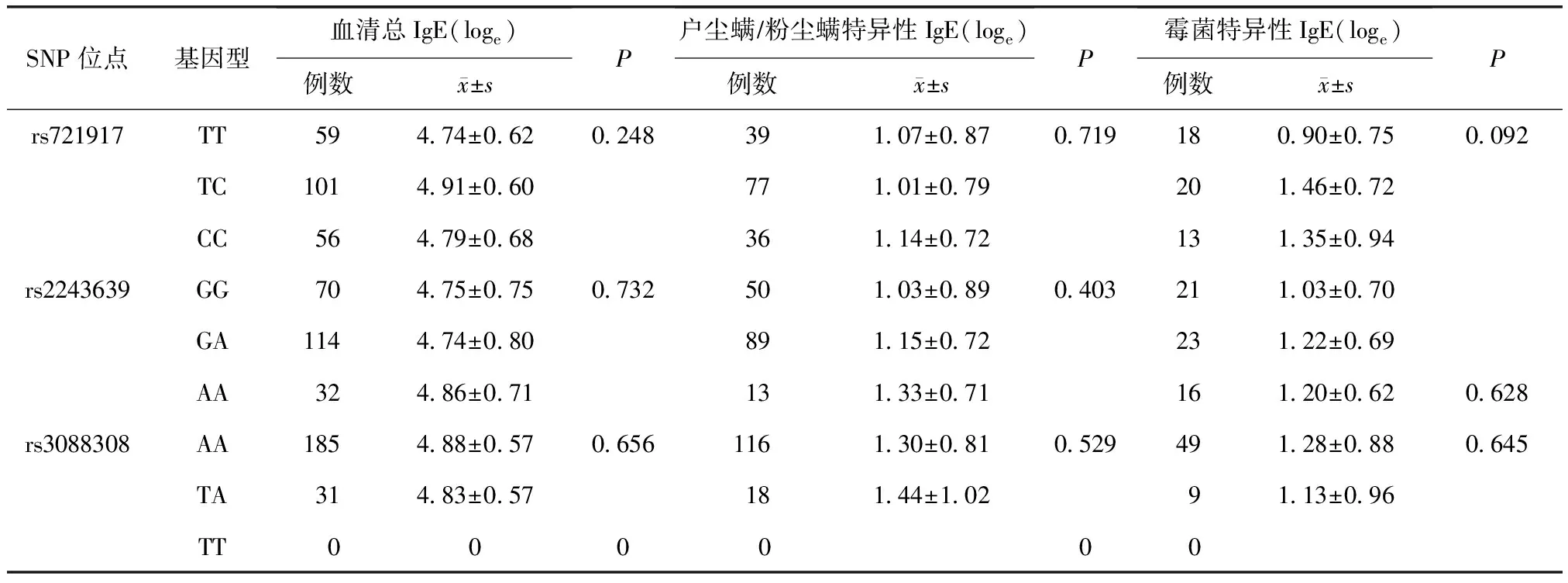
表4 肺表面活性蛋白D单核苷酸多态性与血清总IgE及特异性IgE的关系
利用SHEsis软件对SP-D3个位点进行两两LD分析,结果显示位点rs721917与rs2243639之间D′=0.048,D′<0.7;rs2243639及rs3088308位点之间D′=0.078,D′<0.7。无统计学意义上的连锁不平衡现象,因而未行单倍体分析。
SP-D单核苷酸多态性与血清总IgE及特异性IgE的关系
所有血清总IgE及特异性IgE值均转化为以e为底的自然对数值(loge)进行比较。过敏性鼻炎组上述3个位点不同基因型间血清总IgE及户尘螨/粉尘螨和霉菌特异性IgE间差异无统计学差异(均P>0.05)(表4)。
讨 论
人类基因组SNP研究所揭示的人种、人群和个体之间DNA序列的差异以及这些差异所表现的意义将对疾病的诊断、治疗和预防带来革命性的变化[13]。焦磷酸测序技术正是新一代DNA序列差异分析技术之一,具体原理是:引物与模板DNA退火后,在DNA聚合酶、ATP硫酸化酶、荧光素酶和三磷酸腺苷双磷酸酶4种酶的协同作用下,将引物上每一个dNTP的聚合与一次荧光信号的释放偶联起来,通过荧光信号的形式实时记录模板DNA的核苷酸序列。该技术的特点是对DNA的序列分析无须进行电泳,DNA片段无须荧光标记。
已报道的SP-D单核苷酸多态性检测方法有多种,其中聚合酶链式反应和限制性片段长度多态性技术应用得最多[14-15],这种方法结果可靠但存在许多不足,实验过程需要酶切,延长了检测时间;检测过程繁琐;不能精确确定突变位置及突变类型等。本研究焦磷酸测序在聚合酶链式反应扩增后,可在2 h内对结果进行自动化分析,明显缩短了实验时间。另外,传统的测序法1周期只能做十几个样品,而PSQ96MA系统一次可完成96个样品的分析,具有高通量的特点。因此,焦磷酸测序适用于大样本量人群的相关基因DNA单核苷酸多态性的分析。
国外已有研究提示SP-D的SNP与过敏性哮喘及气道炎性疾病的关系[5-9,16],研究对象大多为居住在西方国家的人群。然而,SP-D的SNP与亚洲人群过敏性鼻炎的关系尚未见报道。为避免不同种族人群之间的基因差异和生活环境差异,本研究实验对象均为汉族并生活在中国南方地区。在本研究中,过敏性鼻炎组rs721917位点的CC基因型频率及等位基因C的频率显著高于对照组,从基因型频率的相对风险分析发现,CC基因型患过敏性鼻炎的风险是TT型的2.847倍(比值比=2.847,95%可信区间为1.313~6.176),有C等位基因者患过敏性鼻炎的危险性增加了1.633倍(比值比=1.633,95%可信区间为1.153~2.397),提示rs721917位点等位基因C可能是中国汉族人群过敏性鼻炎的易感基因。rs2243639及rs3088308位点的基因型频率和等位基因频率在过敏性鼻炎组和对照组之间差异无统计学意义,说明这两个位点在过敏性鼻炎中不起关键性的作用。
SP-D在抵御炎症性细菌、病毒和抑制过敏性炎症方面发挥着重要的作用[17]。有报道指出rs721917位点的CC基因型影响血浆SP-D水平,甚至可能影响SP-D正常的结构及功能,与TT基因型相比,CC基因型血浆中SP-D含量要低得多[18]。国外学者也发现SP-D该位点的CC基因型多态性增加了结核病[5]及流感病毒A感染[8]的危险性。因此,推测rs721917位点的CC基因型可能通过影响体内SP-D水平,使SP-D抑制炎症反应的保护性功能降低,进而导致发生过敏性鼻炎的危险性增大。然而,与本研究不同的是,Krueger等[16]研究发现SP-D的rs721917,rs2243639及rs3088308三个位点的多态性与法国儿童哮喘发生无明显关联。另有研究发现,SP-D同一个位点的CC基因型与黑人儿童的遗传过敏症有相关性,但是CC基因型降低了该研究人群中发生遗传过敏症的机会[9]。究其原因,受试对象的遗传学背景,种族,生活环境及不同年龄段特征存在差异,另外,本研究采用焦磷酸测序法也不同于以上两位学者的研究,以上这些因素可能都会影响结果的不同。
研究显示在炎性反应调节方面,与不同受体分子结合,SP-D发挥双重调节作用。当SP-A及SP-D植物凝集素区(CRD区域)与上皮细胞或抗原递呈细胞上的SIRP-α受体结合,可抑制炎性反应细胞产生促炎因子,维持抑炎性反应环境;当SP-A及SP-D胶原尾部与巨噬细胞上的钙网织蛋白或CD91受体结合,可促进促炎性细胞因子的产生,加快对病原体的清除[19]。提示SP-D的rs721917位点SNP可能影响了SP-D胶原尾部或植物凝集素区的正常结构,促使SP-D与不同的受体结合,发生促进或抑制炎性反应作用。正是因为SP-D这种双重调节作用,同时又从一侧面解释了为何SP-D SNP在本研究中增大了过敏性鼻炎的易感性,而在国外研究中降低了黑人儿童遗传过敏症的易感性。
体内血清总IgE水平与过敏性疾病的发病密切相关。IgE是Ⅰ型变态反应最主要的介质,总IgE即各种特异性IgE抗体的总和。总IgE升高并不表示一定患有变态反应性疾病,总IgE水平正常并不能排除过敏性疾病的可能,但其作为诊断参考仍具有重要参考价值。SP-D可阻止过敏原特异性IgE与肥大细胞和嗜碱细胞膜表面的Fc-RI相连接,抑制炎症介质生成(组胺、白三烯等)[3]。另外,由于不同地区过敏原的分布具有差异性,南方地区梅雨季节较长,温暖湿润,利于螨类和霉菌滋生,最常见的过敏原是螨类和霉菌[20]。因而,本研究分别比较过敏性鼻炎组3个位点不同基因型对应的血清总IgE水平以及南方地区常见的过敏原螨类和霉菌血清特异性IgE值之间的差异。研究结果显示,过敏性鼻炎患者rs721917、rs2243639及rs3088308这3个位点对应的血清总IgE水平以及特异性IgE值之间差异无明显统计学意义,提示SP-D并不直接参与调控IgE的合成,其与过敏性鼻炎患者血清IgE水平的确切关系尚需进一步大样本的实验研究。
本研究利用焦磷酸测序方法发现,SP-D的rs721917位点单核苷酸多态性与我国汉族南方地区人群的过敏性鼻炎的发生有关。对于SP-D基因多态性在过敏性鼻炎发生、发展过程中的可能作用仍需进一步进行大样本、多地域、多民族广泛深入的协同研究,从而为过敏性鼻炎的筛查、基因治疗和发展特异性药物疗法奠定基础,对防治过敏性鼻炎开辟新方向提供理论依据。
[1]Togias A.Rhinitis and asthma:evidence for respiratory system integration[J].J Allergy Clin Immunol,2003,111:1171-1184.
[2]Weiss ST,Raby BA.Asthma genetics 2003[J].Hum Mol Genet,2004,13:83-89.
[3]Wright JR.Immunoregulatory functions of surfactant proteins[J].Nat Rev Imunol,2005,5:58-68.
[4]Brandt EB,Mingler MK.Surfactant protein D alters allergic lung responses in mice and human subjects[J].J Allergy Clin Immunol,2008,121:1140-1147.
[5]Floros J,Lin HM,Garcia A,et al.Surfactant protein genetic marker alleles identify a subgroup of tuberculosis in a Mexican population[J].J Infect Dis 2000,182:1473.
[6]Lahti M,Lofgren J,Marttila R,et al.Surfactant protein D gene polymorphism associated with severe respiratory syncytial virus infection[J].Pediatr Res,2002,51:696
[7]Thomas NJ,Fan R,Diangelo S,et al.Haplotypes of the surfactant protein genes A and D as susceptibility factors for the development of respiratory distress syndrome[J].Acta Paediatr,2007,96:985-989.
[8]Kevan LH,Mitchell RW,Tesfaldet T,et al.Reduced influenza viral neutralizing activity of natural human trimers of surfactant protein D[J].Respirat Res,2007,8:9.
[9]Eric BB,Melissa KM,Michelle DS,et al.Surfactant protein D alters allergic lung responses in mice and human subjects[J].J Allergy Clin Munol,2008,121:1140-1150.
[10] 中华耳鼻咽喉头颈外科杂志编委会鼻科组,中华医学会耳鼻咽喉头颈外科学分会鼻科学组.过敏性鼻炎诊断和治疗指南(2009年,武夷山)[J].中华耳鼻咽喉头颈外科杂志,2009,44:977-978.
[11] Okada Y,Nakamura K,Adachi A,et al.Development of a single-tube PCR-pyrosequencing method for the simultaneous and rapid detection of four variant alleles of CYP2C9 gene polymorphism[J].J Clin Pharmacy Ther,2008,33:187-192.
[12] Pavlovic J,Papagaroufalis C,Xanthou M,et al.Genetic variants of surfactant proteins A,B,and D in bronchopulmonary dysplasia[J].Dis Markers,2006,22:227-232.
[13] Kruglyak L,Nickerson DA.Variation is the spice of life[J].Nat Genet,2001,27:234-236.
[14] DiAngelo S,Lin Z,Wang G,et al.Novel,non-radioactive,simple and multiplex PCR-cRFLP methods for genotyping human SP-A and SP-D marker alleles[J].Dis Markers,1999,15:269.
[15] Glas J,Beynon V,Bachstein B,et al.Increased plasma concentration of surfactant protein D in chronic periodontitis independent of SFTPD genotype:potential role as a biomarker[J].Tissue Antigens,2008,4:1-8.
[16] Krueger M,Puthothu B,Gropp E,et al.Amino acid variants in Surfactant protein D are not associated with bronchial asthma[J].Pediatr Allergy Immunol,2006,17:77-81.
[17] Kishore U,Greenhough TJ,Waters P,et al.Surfactant proteins SP-A and SP-D:Structure,function and receptors[J].Molecular Immunology,2006,43:1293-1315.
[18] Leth LR,Garred P,Jensenius H,et al.A common polymorphism in the SFTPD gene influences assembly,function,and concentration of surfactant protein D[J].J Immunol,2005,174:1532-1538.
[19] Gardai SJ,Xiao YQ,Dickinson M,et al.By binding SIRP or calreticulinCD91,lung collectins act as dual function surveillance molecules to suppress or enhance inflammation[J].Cell,2003,115:13.
[20] 肖伯奎,邓玉琴,陶泽璋.134例过敏性鼻炎患者敏筛试验检测结果分析[J].临床耳鼻咽喉头颈外科杂志,2008,22:214-216.

