组织蛋白酶S在原发性干燥综合征中的临床意义
李 霞,张丽丽,费允云,赵 岩
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,北京 100730)
原发性干燥综合征(primary Sjögren’s syndrome,pSS)是一种主要累及外分泌腺体的自身免疫性疾病,常伴抗核抗体(anti-nuclear antibody,ANA)、抗SSA和(或)抗SSB抗体阳性,目前病因及发病机制尚未阐明。本研究通过探讨pSS患者与健康对照组血清组织蛋白酶(Cathepsin,Cat) S的水平,分析Cat S与临床疾病活动度评分及实验室指标的相关性,并检测唇腺组织Cat S的表达。
资料和方法
对象和分组
pSS组:收集2014年12月至2015年12月于北京协和医院门诊就诊的pSS患者,入选标准为符合2002年pSS国际分类诊断标准[1]和2012年美国风湿病学会干燥综合征分类诊断标准[2],且均未经过糖皮质激素和免疫抑制剂治疗。排除标准:颈、头、面部放疗史、丙型肝炎病毒感染、艾滋病、淋巴瘤、结节病、移植物抗宿主病、应用抗乙酰胆碱药(如阿托品、莨菪碱、颠茄等)。根据IgG水平,将pSS患者分为高免疫球蛋白(简称高球)组(IgG>25 g/L)和非高球组(IgG≤25 g/L)。
健康对照组:同期北京协和医院健康体检中心的体检者,所有体检者经过详细查体及实验室检查,排除自身免疫性相关疾病及家族史,无心脏、肝肾疾病史,无过敏性疾病史等。
所有纳入对象均经过北京协和医院伦理委员会批准,并且签署知情同意书。
方法
资料收集:采集详细的临床资料,包括症状、体征,口腔科检查(唾液流率、腮腺造影或唇腺活检)、眼科检查(膜破碎时间、Schirmmer试验、角膜荧光染色),以及实验室检测指标(血常规、尿常规和沉渣分析、肝肾功能电解质、免疫球蛋白及补体、ANA、类风湿因子、抗SSA和抗SSB抗体、抗着丝点抗体)。此外,根据器官受累不同选择性完善胸部高分辨CT、肾脏超声等检查。所有患者根据欧洲抗风湿联盟pSS疾病活动度(EULAR Sjögren’s syndrome disease activity index,ESSDAI)评分[3]进行评估。
标本采集及酶联免疫吸附法检测:所有纳入对象均采集清晨空腹静脉血,经离心取血清后立即冻存于-80℃冰箱以备后续检测。酶联免疫吸附法检测总Cat S和pro-Cat S(R&D公司,货号分别为DY1183和DY2223),按照试剂盒说明书进行操作。两者之差作为active-Cat S的结果。
免疫组化:选取pSS组患者有典型灶性淋巴细胞浸润的唇腺活检组织及单纯口干症患者作为对照,进行Cat S (R&D公司,货号AF1183)免疫组化,按照试剂盒说明书进行操作。
统计学分析
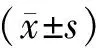
结 果
一般资料
pSS组共37例患者,其中男1例,女36例,中位年龄47(21~77)岁。评估ESSDAI为(2.49±0.28)分。高球组5例,ESSDAI为(4.40±2.07)分;非高球组32例,ESSDAI为(2.21±1.55)分,两组差异有统计学意义(P<0.01)。
健康对照组男性2例,女性31例,中位年龄45(25~67)岁。pSS组和健康对照组性别、年龄比较差异无统计学意义(P>0.05)。
血清总Cat S、pro-Cat S和active-Cat S水平比较
pSS组血清总Cat S、pro-Cat S和active-Cat S表达水平高于健康对照组,差异具有统计学差异(P<0.05)(表1)。
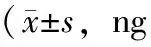
表1 pSS组与健康对照组血清Cat S水平比较
Cat S:组织蛋白酶S;pSS:原发性干燥综合征
37例pSS患者,高球组和非高球组血清总Cat S、pro-Cat S和active-Cat S水平比较,差异无统计学意义(P>0.05)(表2)。
Cat S水平与临床指标相关性分析
pSS患者血清总Cat S、pro-Cat S和active-Cat S与血清IgG水平、ESSDAI评分之间无相关性(图1)。
血清Cat S预测pSS诊断
以2002年pSS国际分类诊断标准作为参照,ROC分析发现,血清总Cat S、pro-Cat S和active-Cat S水平pSS组和健康对照组比较差异有统计学意义(均P<0.01)(表3、图2)。
唇腺组织免疫组化分析
pSS患者唇腺组织腺上皮细胞(图3A-a)、淋巴细胞(图3A-b)和导管上皮细胞(图3A-c)均有Cat S表达;口干症者显示散在淋巴细胞浸润,并未见明显Cat S表达(图3B)。
讨 论
pSS是一种主要侵犯外分泌腺体的慢性、自身免疫性疾病,又名为自身免疫性外分泌腺体上皮细胞炎。患者血清中多存在多克隆高免疫球蛋白血症以及多种自身抗体如ANA、抗SSA和(或)抗SSB抗体及抗着丝点抗体等的阳性,提示B细胞高度活化是疾病发生、发展的重要机制之一[4]。而自身抗原通过抗原提呈细胞(antigen presenting cells,APC)的提呈,是B细胞活化的早期重要步骤[5]。
Cat S作为组织蛋白酶家族中的一员,于20世纪70年代首先在造血细胞的内体中被发现[6],主要表达在人体的专职APC如B细胞、单核-巨噬细胞和树突状细胞中,也表达于非专职APC如上皮细胞中,在体内自身抗原提呈、细胞外基质重塑、损伤修复、血管生成等多种病理和生理过程中发挥重要的调节功能[7],提示其可能参与自身免疫性疾病的发病过程。国内研究发现,类风湿关节炎患者血清Cat S表达升高,与疾病活动度具有弱相关性[8];而在国内pSS研究中尚未见报道。深入研究Cat S在pSS表达水平的变化,可为其诊断以及治疗提供新的生物学标志物和潜在的治疗靶点[9]。
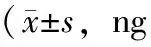
表2 pSS高球组和非高球组ESSDAI及血清Cat S水平比较
Cat S:组织蛋白酶S
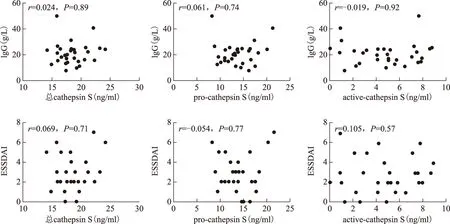
图1pSS组血清总Cat S,pro-Cat S和active-Cat S水平与临床指标相关性分析
FigFig1Correlation analysis between the serum total-,pro- and active-Cat S with serum IgG and ESSDAI
Cat S:组织蛋白酶S;pSS:原发性干燥综合征;ESSDAI:欧洲抗风湿联盟pSS疾病活动度
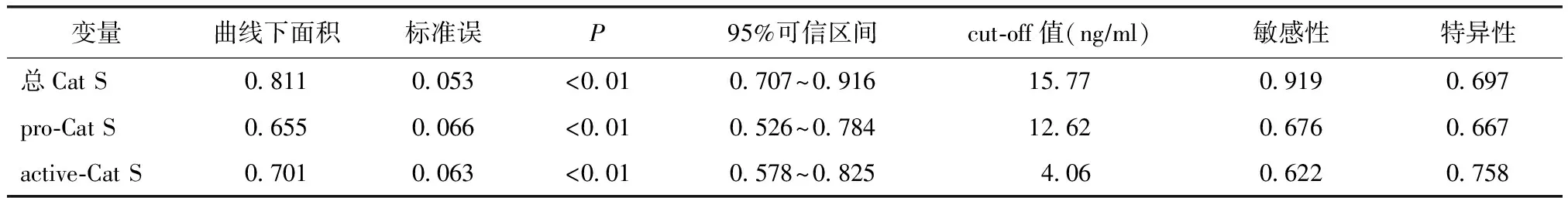
表3 Cat S受试者工作特征曲线分析
Cat S:组织蛋白酶S
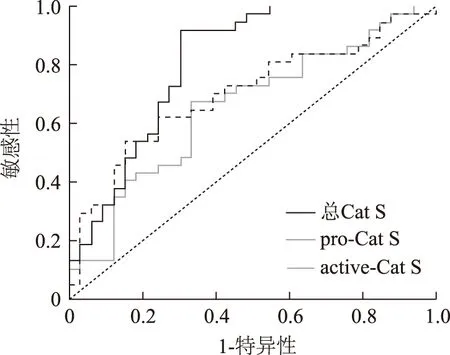
图2血清总、pro-和active-Cat S受试者工作特征曲线分析
FigFig2Receiver operating characteristic curve of serum total-,pro- and active-Cat S
Cat S:组织蛋白酶S
Cat S在pSS发病机制中的作用成为近年研究的热点,尤其是在SS动物模型中的研究居多。研究显示,非肥胖型糖尿病(non-obese diabetes,NOD)小鼠泪腺腺泡表达Cat S增加,泪液Cat S的活性升高[10]。由于泪液中的Cat S可破坏角膜中的蛋白,从而损害眼球表面的完整性,可能是pSS患者出现干燥性角结膜炎的机制之一。同样地,NFSsld小鼠唾液腺及脾的内源性Cat S活性升高,经过选择性Cat S抑制剂治疗后,唾液腺淋巴细胞灶性浸润的病变显著减轻,而且泪液、唾液流率升高,血清中抗120KD α-fodrin抗体的产生被抑制[9]。这为以Cat S为靶点的治疗提供了依据,同时,国外各种特异性Cat S抑制剂的不断研发[11],为靶向治疗带来了希望。细胞实验研究发现,NFSsld小鼠唾液腺上皮细胞(MSG)较淋巴结及脾内淋巴细胞表达更多的主要组织相容性抗原(major histocompatibility complex,MHC)Ⅱ类分子[9]。正常小鼠MSG经过干扰素(interferon,IFN)-γ刺激后可诱导表达更多的MHCⅡ类分子,并且此过程可被选择性Cat S抑制剂而抑制,由此推断Cat S可参与MHC Ⅱ类分子的成熟及促进其表达于APC的表面,进而有助于抗原提呈的过程[12]。一项关于SS患者的研究显示,SS患者泪液中Cat S的生物学活性是HCs的近41.1倍,并且患者泪液越少,CatS活性越高,表明泪液Cat S活性与患者干眼症的严重程度相关[13]。迄今为止,国内外对于Cat S在SS患者外周血的浓度和唇腺中的表达尚未见报道。
本文首次探讨pSS患者血清及唇腺组织中Cat S的表达变化,发现总Cat S及其前体和活性形式在pSS患者血清中表达均显著升高,提示pSS患者不仅合成Cat S增加,而且活性形式的表达亦明显升高。此外,通过ROC曲线分析显示总Cat S对于pSS具有辅助诊断价值,因此可能成为一种新的生物标志物。唇腺组织免疫组化结果发现,pSS患者伴典型灶性淋巴细胞浸润的唇腺组织高表达Cat S。并且,该酶不仅表达于淋巴细胞区,还表达于腺上皮细胞及导管上皮细胞,表明上皮细胞在病理状态下可转化为非专职APC,参与自身抗原的提呈,进而导致T、B细胞的活化,在pSS发病初期可能具有举足轻重的地位。同时国外研究表明Cat S具有降解细胞外基质的功能[14],因此有利于淋巴细胞的迁移,通过分泌细胞因子IFN-γ及趋化因子CXCL13等[15],最终导致唾液腺的破坏,外分泌功能受损,出现临床症状。
综上所述,pSS患者血清及唇腺组织中Cat S表达增加,且血清中活性形式Cat S也显著增加,提示其可能通过增强自身抗原呈递、降解细胞外基质、促进淋巴细胞浸润等作用,在pSS患者发病中起到至关重要的作用,这也为pSS患者可能提供了一种新的辅助血清学标志物及潜在的治疗新靶点。
(本文图3见插页Ⅰ)
[1]Vitali C,Bombardieri S,Jonsson R,et al.Classification criteria for Sjogren’s syndrome:a revised version of the European criteria proposed by the American-European Consensus Group[J].Ann Rheum Dis,2002,61:554-558.
[2]Shiboski SC,Shiboski CH,Criswell L,et al.American College of Rheumatology classification criteria for Sjogren’s syndrome:a data-driven,expert consensus approach in the Sjogren’s International Collaborative Clinical Alliance cohort[J].Arthritis Care Res (Hoboken),2012,64:475-487.
[3]Seror R,Ravaud P,Bowman SJ,et al.EULAR Sjogren’s syndrome disease activity index:development of a consensus systemic disease activity index for primary Sjogren’s syndrome[J].Ann Rheum Dis,2010,69:1103-1109.
[4]Maslinska M,Przygodzka M,Kwiatkowska B,et al.Sjogren’s syndrome:still not fully understood disease[J].Rheumatol Int,2015,35:233-241.
[5]Roche PA,Furuta K.The ins and outs of MHC class Ⅱ-mediated antigen processing and presentation[J].Nat Rev Immunol,2015,15:203-216.
[6]Gupta S,Singh RK,Dastidar S,et al.Cysteine cathepsin S as an immunomodulatory target:present and future trends[J].Expert Opin Ther Targets,2008,12:291-299.
[7]Wang B,Sun J,Kitamoto S,et al.Cathepsin S controls angiogenesis and tumor growth via matrix-derived angiogenic factors[J].J Biol Chem,2006,281:6020-6029.
[8]赵进军,胡子有,欧阳晴晴,等.类风湿关节炎患者血清中组织蛋白酶S的表达及与DAS-28的相关性[J].临床内科杂志,2015,32:680-682.
[9]Saegusa K,Ishimaru N,Yanagi K,et al.Cathepsin S inhibitor prevents autoantigen presentation and autoimmunity[J].J Clin Invest,2002,110:361-369.
[10] Li X,Wu K,Edman M,et al.Increased expression of cathepsins and obesity-induced proinflammatory cytokines in lacrimal glands of male NOD mouse[J].Invest Ophthalmol Vis Sci,2010,51:5019-5029.
[11] Lee-Dutra A,Wiener DK,Sun S.Cathepsin S inhibitors:2004-2010[J].Expert Opin Ther Pat,2011,21:311-337.
[12] Riese RJ,Wolf PR,Bromme D,et al.Essential role for cathepsin S in MHC class Ⅱ-associated invariant chain processing and peptide loading[J].Immunity,1996,4:357-366.
[13] Hamm-Alvarez SF,Janga SR,Edman MC,et al.Tear cathepsin S as a candidate biomarker for Sjogren’s syndrome[J].Arthritis Rheumatol,2014,66:1872-1881.
[14] Fonovic M,Turk B.Cysteine cathepsins and extracellular matrix degradation[J].Biochim Biophys Acta,2014,1840:2560-2570.
[15] Luciano N,Valentini V,Calabro A,et al.One year in review 2015:Sjogren’s syndrome[J].Clin Exp Rheumatol,2015,33:259-271.

