链格孢变应原皮试液用于链格孢变态反应性疾病诊断的有效性和安全性
王瑞琦,王良录,李 宏,孙劲旅,文利平,顾建青,关 凯,尹 佳
(中国医学科学院 北京协和医学院 北京协和医院变态反应科,北京 100730)
链格孢(Alternariaalternata)属半知菌亚门、丝孢菌纲、丝孢菌目、暗色孢科、链格孢属,其孢子可在空气中广泛播散,是我国常见的致敏真菌。真菌变态反应的患病率与地理及气候条件相关,在某些地区可高达30%[1],但链格孢引起变态反应性疾病的患病率目前尚不清楚。Mari等[2]对4962例呼吸道变态反应性疾病患者的调查结果显示,19%的患者对一种或多种真菌变应原皮肤试验阳性,真菌变应原皮肤试验阳性患者中66%对链格孢皮试阳性。岳凤敏等[3]对28种常见气传真菌致敏性分析结果显示,200例真菌变态反应患者中105例链格孢皮内试验阳性(52.5%)。国外研究结果显示,应用链格孢进行免疫治疗,可有效缓解链格孢变态反应患者的鼻炎及哮喘症状[4]。
链格孢变应原注射原液(Alternariaalternataextract)是进行链格孢皮内试验和免疫治疗的基础制剂,北京协和医院研制的链格孢变应原注射原液已在临床安全应用逾50年,本研究用链格孢变应原注射原液1∶100稀释液对受试者做皮内试验,分别以变态反应专科医生临床综合诊断和血清特异性IgE(specific IgE,sIgE)检测结果为金标准和相对金标准,回顾性评价该皮内试验用于诊断链格孢变态反应的有效性及安全性。
材料和方法
病例选择
入选标准:(1)受试者年龄为4~75岁(含4岁和75岁),男女不限;(2)2009年4月至2010年8月在北京协和医院变态反应科就诊者;(3)于入选当天已在北京协和医院变态反应科完成20种常规吸入变应原皮内试验者;(4)于入选当天已在北京协和医院变态反应科用Thermo Fisher公司Immuno CAP®系统完成至少一种吸入变应原血清sIgE检测者;(5)已签署知情同意书。
排除标准:(1)仅有吸入变应原皮内试验结果;(2)仅有变应原血清sIgE试验结果;(3)使用非Thermo Fisher公司Immuno CAP®系统检测血清sIgE;(4)在进行皮肤试验前3 d内曾口服短效抗组胺药物或3周内口服长效抗组胺药物;(5)有严重变态反应性疾病史者;(6)有皮肤划痕征者;(7)做皮内试验时正患或2周内曾患皮肤湿疹、皮肤感染、皮炎或外伤者;(8)试验前1 d内口服超过相当于泼尼松10 mgd剂量的糖皮质激素者;(9)试验前1 d内在将进行皮肤试验的上臂部使用糖皮质激素油膏者;(10)4周内服用全身糖皮质激素者;(11)有严重影响全身状态的疾病者;(12)处在变态反应性疾病急性发作期者,如变应性哮喘;(13)有肾上腺素禁忌证者;(14)妊娠期及哺乳期妇女;(15)研究者认为不适合参加试验的其他情况。
剔除标准:(1)皮肤试验中阳性对照为阴性或阴性对照为阳性结果者;(2)无任何记录者。
观察方法
2009年4月10日至2010年8月10日在北京协和医院变态反应科就诊并已完成20种常规吸入变应原(包括链格孢)皮内试验和至少1种吸入变应原(包括链格孢)血清sIgE检测的患者至少1000例。对其链格孢皮内试验和血清sIgE结果进行登记,由登记的变态反应专科医生做出临床综合诊断(以患者病史、症状、体征结合链格孢血清sIgE结果综合判断)。登记入组当天详细询问患者在完成皮内试验之后是否出现不良反应。
分别以变态反应专科医生临床综合诊断作金标准,以血清sIgE检测结果作相对金标准,评价链格孢变应原注射原液1∶100稀释液皮内试验的灵敏度、特异度、阳性预期值和阴性预期值。
分析不良反应发生情况,对链格孢变应原注射原液1∶100稀释液用于皮内试验的安全性进行评价。
皮内试验方法
链格孢变应原注射原液及阳性对照液均由新华联协和药业有限公司提供,其中链格孢变应原注射原液浓度为1∶20(WV),阳性对照液分别为0.1 mgml和0.01 mgml磷酸组胺[5]。阴性对照液为变应原溶媒,由山西太原制药厂生产。进行皮内试验前,将链格孢变应原注射原液与变应原溶媒按1∶100新鲜配制成皮试液,2~8℃避光保存,有效期4周。所有皮内试验由5位有经验的护士完成。皮内试验方法和结果判读详见参考文献[6],阴性者以“-”表示,阳性者依反应程度轻重分为4级,分别以“+”“++”“+++”“++++”表示。
血清sIgE检测
采用Thermo Fisher公司Immuno CAP®系统(荧光酶联免疫法)检测。血清sIgE<0.35 kUAL(0级)者为阴性,血清sIgE≥0.35 kUAL者为阳性,依sIgE含量高低又可分为6级,即1级(≥0.35且<0.7 kUAL),2级(≥0.7且<3.5 kUAL),3级(≥3.5且<17.5 kUAL),4级(≥17.5且<50 kUAL),5级(≥50且<100 kUAL),6级(≥100 kUAL)。
不良反应分类
局部不良反应:变应原皮内试验后,局部出现风团和红晕,此为正常的阳性反应,但若风团和红晕反应过大(风团直径大于40 mm),应视为局部不良反应。皮肤试验5~6 h后在注射局部可出现迟发相反应,轻者24 h可消退,重者则需2~3 d至1周方可逐渐消退,迟发相反应也应视为局部不良反应。
全身不良反应:指皮内试验后在注射处以外的组织和(或)器官出现症状[7-8]。轻度全身反应可表现为变态反应性鼻结膜炎症状,如喷嚏、流涕、眼痒、结膜肿胀等;中度全身反应可表现为在出现局部不良反应的同时,伴有急性荨麻疹或血管性水肿,亦可表现为干咳、胸闷、憋气和哮喘发作;重度全身反应表现为过敏性休克。
统计学方法
使用SPSS 17.0统计软件,对连续变量描述观察值的数量、均值、标准差、中位数、最小值和最大值,对分类变量描述其每一种类的例数和百分比。以皮肤试验的反应程度作为诊断变量,通过四格表形式给出诊断试验结果,计算灵敏度、特异度、阳性预测值、阴性预测值和准确度等,并绘制受试者工作特征曲线(receiver operating characteristic curve,ROC曲线),计算ROC曲线下面积。对sIgE检测阳性组的数据,进行sIgE阳性级别与皮肤试验反应程度的等级相关性分析。未作特殊说明,统计检验均采用双侧检验,检验水准为0.05。
结 果
一般情况
入组受试者共1043例,剔除16例(剔除原因为组胺对照阴性或变应原溶媒对照阳性),最终有效性评价1027例,安全性评价1043例。
1043例受试者中,男469例,女574例;年龄4~75岁,平均年龄(33.40±14.46)岁(1例受试者年龄资料缺失)。所有受试者中变应性鼻炎患者占87.34%(9111043),变应性哮喘患者占57.05%(5951043),变应性结膜炎患者占30.58%(3191043),荨麻疹、变应性咳嗽和湿疹患者分别占4.99%(521043)、3.84%(401043)和1.73%(181043),其他变态反应性疾病患者占0.58%(61043)。
有效性评价
主要评价指标:以变态反应专科医生临床综合诊断作为金标准。以链格孢皮内试验结果≥“+”为诊断界值时,临床综合诊断和链格孢皮内试验均为阳性者78例,均为阴性者661例,链格孢皮内试验灵敏度为0.886 4(95%可信区间为0.820 1~0.952 7),特异度为0.894 5(95%可信区间为0.872 3~0.916 6),阳性预测值为0.500 0,阴性预测值为0.985 1,准确度为0.893 6。以链格孢皮内试验结果≥“++”为诊断界值时,临床综合诊断和链格孢皮内试验均为阳性者51例,两者均为阴性者731例,链格孢皮内试验灵敏度为0.579 5(95%可信区间为0.476 4~0.682 7),特异度为0.989 2(95%可信区间为0.981 7~0.996 6),阳性预测值为0.864 4,阴性预测值为0.951 8,准确度为0.945 6(表1~3)。
以变态反应专科医生临床综合诊断作为金标准,链格孢皮内试验结果≥“+”为诊断界值时,ROC曲线下面积为0.915,95%可信区间为(0.874~0.956)(图1)。
次要评价指标:以血清sIgE检测结果作为相对金标准。以链格孢皮内试验结果≥“+”为诊断界值时,血清sIgE和链格孢皮内试验均为阳性者77例,均为阴性者34例,链格孢皮内试验灵敏度为0.927 7(95%可信区间为0.872 0~0.983 4),特异度为0.531 3(95%可信区间为0.409 0~0.653 5),阳性预测值为0.719 6,阴性预测值为0.850 0,准确度为0.755 1。以链格孢皮内试验结果≥“++”为诊断界值时,血清sIgE和链格孢皮内试验均为阳性者47例,两者均为阴性者61例,链格孢皮内试验灵敏度为0.566 3(95%可信区间为0.459 6~0.672 9),特异度为0.953 1(95%可信区间为0.901 3~1.000 0),阳性预测值为0.940 0,阴性预测值为0.628 9,准确度为0.734 7(表4~6)。
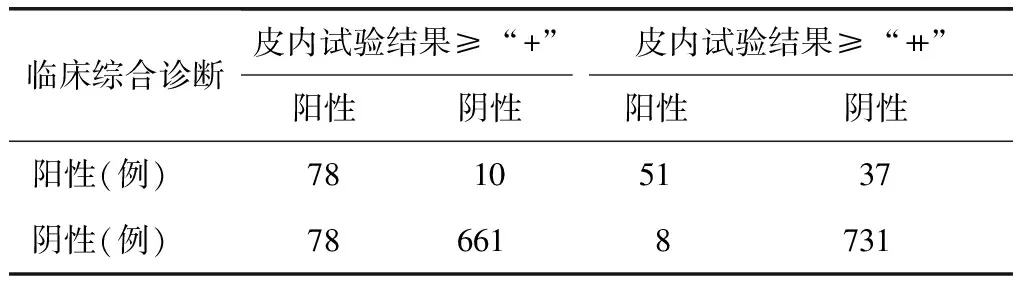
表1 皮内试验结果与临床综合诊断比较
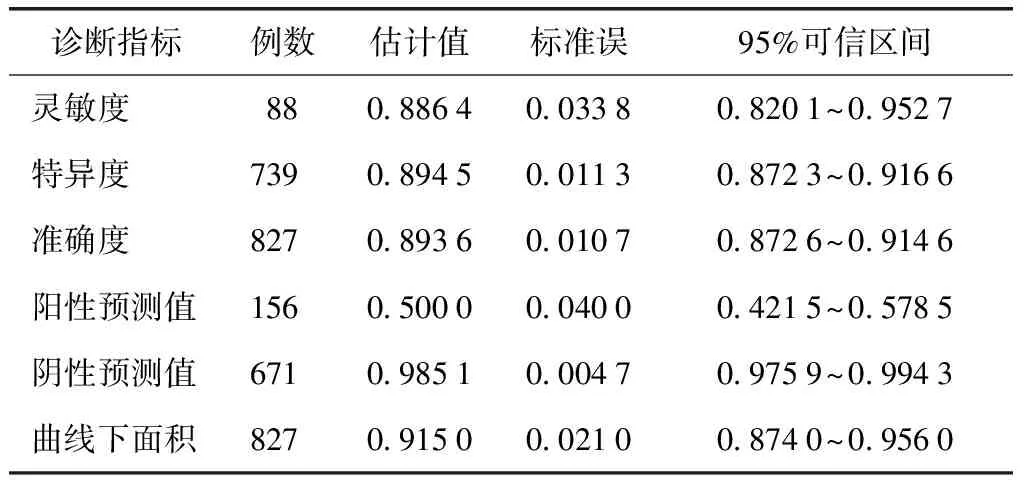
表2 以皮内试验结果≥“+”为界值的诊断价值*
*以变态反应专科医生临床综合诊断为金标准
探索性研究:链格孢血清sIgE阳性组中,血清sIgE水平与链格孢变应原注射液原液1∶100稀释液皮肤试验反应程度的等级相关系数为0.628 00(P<0.000 1)(表7),在α=0.05水准下可以认为血清sIgE水平与皮肤试验反应程度存在正相关。
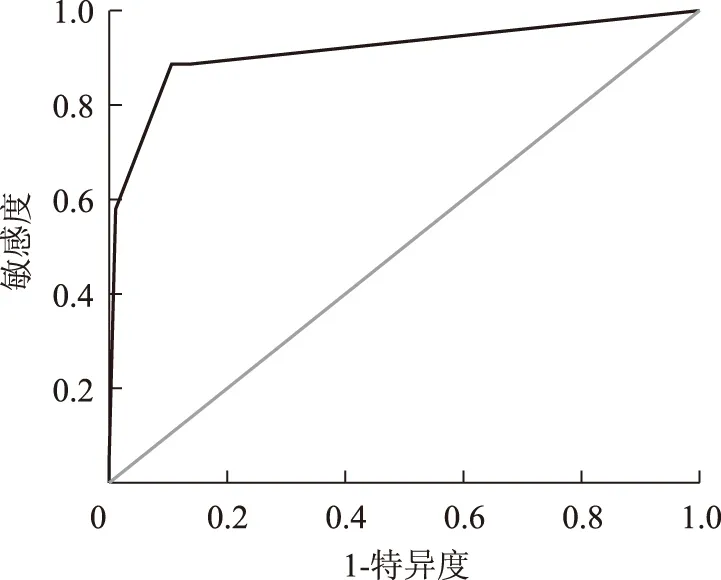
图1链格孢皮内试验受试者工作特征曲线
FigFig1Receiver operating characteristic curve of intradermal test withAlternariaalternateextract
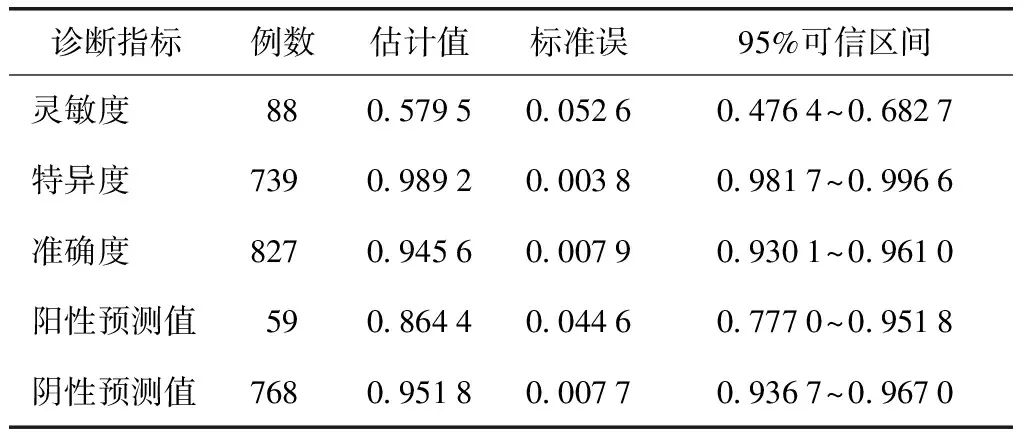
表3 以皮内试验结果≥“++”为界值的诊断价值*
*以变态反应专科医生临床综合诊断为金标准

表4 皮内试验结果与血清sIgE结果比较
安全性分析
1043例受试者中,仅5例在进行皮内试验后出现与链格孢变应原有关的不良反应,占0.48%,均为局部不良反应,其中1例注射部位持续红肿超过24 h,1例出现注射部位硬结,均占总人数的0.01%。未发现与链格孢变应原有关的全身性不良反应。
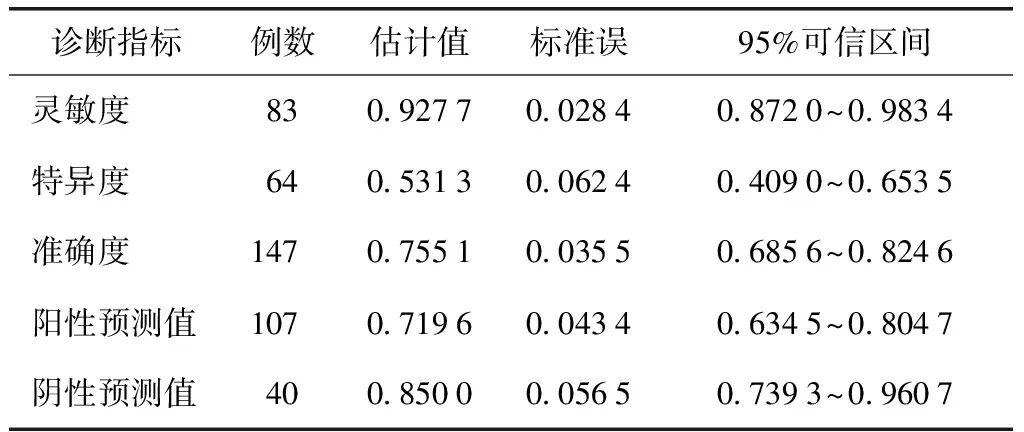
表5 以皮内试验结果≥“+”为界值的诊断价值*
*以sIgE检测结果为相对金标准
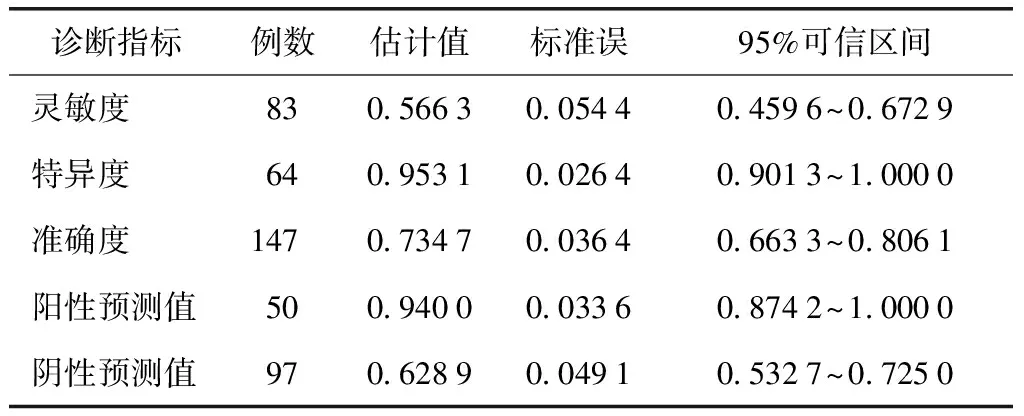
表6 以皮内试验结果≥“++”为界值的诊断价值*
*以sIgE检测结果为相对金标准
讨 论
变应原特异性诊断包括体内试验和体外试验两大类:体内试验包括皮肤试验和变应原激发试验;体外试验特指血清变应原sIgE检测。严格意义而言,只有规范的激发试验才是变应原特异性诊断的金标准,但由于该试验存在潜在的危险性,对医护人员及抢救设备条件要求较高,不能广泛开展,因而在临床实践中很少使用。皮肤试验是一种古老的变应原检测方法,至今应用已有百余年。目前,Thermo Fisher公司Immuno CAP®系统采用荧光酶联免疫法检测变应原sIgE的方法,是国际上公认的最可靠的变应原体外诊断方法。据文献报道,皮肤试验与荧光酶联免疫法sIgE检测有较好的相关性[9-11]。在激发试验不可行的前提下,变应原特异性诊断的金标准应涵盖临床病史、症状和体征,变应原体内试验和变应原体外试验等项内容,只有综合参考上述临床和体内、体外检查结果才能做出比较准确的变应原特异性诊断[12]。
本研究采用临床病史、症状、体征和血清sIgE检测做出的临床综合诊断作为变应原特异性诊断的金标准,评价用链格孢变应原原液1∶100稀释液皮内试验诊断链格孢变态反应的临床应用价值,同时以sIgE检测结果作为相对金标准,评价链格孢变应原皮内试验诊断链格孢变态反应的临床价值。
当以临床综合诊断作金标准时,分别以皮内试验结果≥“+”和≥“++”为诊断界值,链格孢变应原原液1∶100稀释液皮内试验的灵敏度分别为0.886 4和0.579 5;特异度分别为0.894 5和0.989 2,准确度分别为0.893 6和0.945 6,阳性预测值分别为0.500 0和0.864 4,阴性预测值分别为0.985 1和0.951 8。可见,以皮内试验结果≥“++”为诊断界值比以≥“+”为诊断界值的准确度和特异度稍高,但灵敏度明显降低,阳性预测值明显升高。
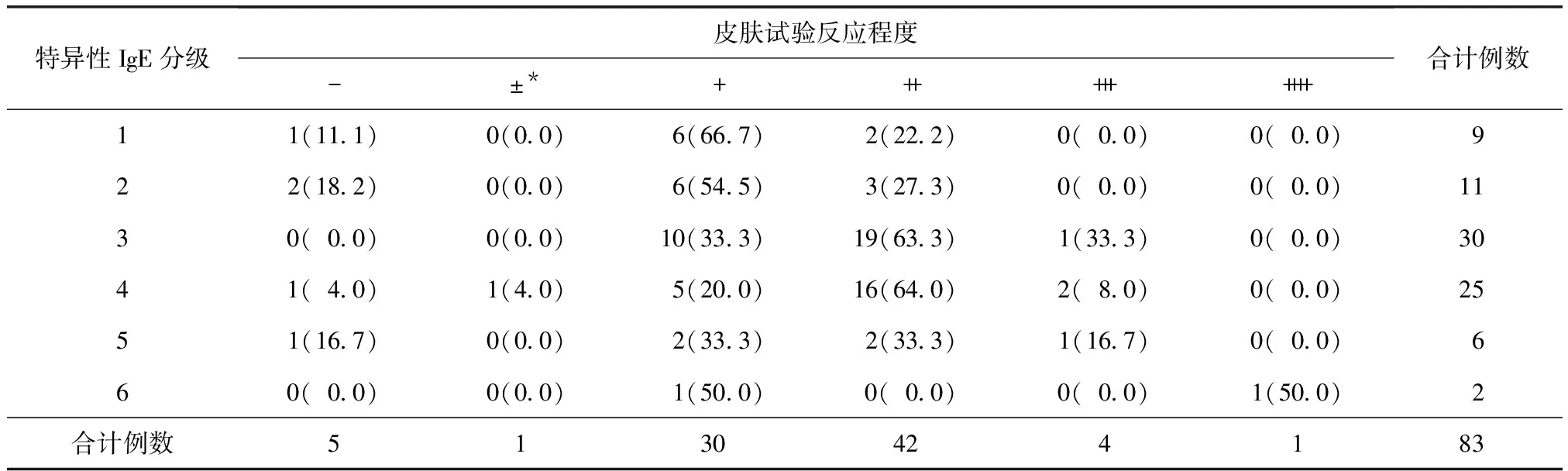
表7 血清sIgE水平与皮肤试验反应程度
*临床上变应原皮内试验风团直径<5 mm,但接近5 mm时判断为“±”,表示可疑阳性
ROC曲线下面积可以综合评价一个诊断试验的灵敏度和特异度,可以通过检验总体ROC曲线下面积是否等于0.5来评价某诊断试验是否有价值。本试验中,以皮内试验结果≥“+”为诊断界值的AUC(曲线下面积)为0.915,95%的可信区间为(0.874~0.956),因此可以认为链格孢变应原原液1∶100稀释液皮内试验诊断链格孢变态反应的临床应用诊断价值较高。
以链格孢sIgE检测结果作为相对金标准,分别以皮内试验结果≥“+”和≥“++”为诊断界值,链格孢变应原原液1∶100稀释液皮内试验的灵敏度分别为0.927 7和0.566 3;特异度分别为0.531 3和0.953 1,准确度分别为0.755 1和0.734 9,阳性预测值分别为0.719 6和0.940 0,阴性预测值分别为0.850 0和0.628 9。可见,以皮内试验结果≥“++”为诊断界值比以≥“+”为诊断界值的准确度差异不大,但特异度明显升高,灵敏度明显降低,阳性预测值明显升高。
皮肤试验结果受皮试液、皮试设备、操作者手法,受试者皮肤条件以及合并用药等多方面影响,有可能出现假阳性或假阴性反应[13-14]。传统认为,皮内试验的灵敏度高,但容易出现假阳性反应。假阳性反应与皮试操作者的技术,变应原浸液的纯度和生物效价,患者的皮肤反应状态等因素有关。皮内试验的假阴性结果,可能与皮试操作者的技术,患者接受免疫治疗以及皮肤条件和试验部位相关。有文献报告,免疫治疗可使皮肤对相应变应原的反应性降低,幼儿和50岁以上个体的皮肤反应性降低,上臂肘窝处的皮肤比腕部敏感,尺侧皮肤较桡侧敏感,上背部的皮肤比下背部敏感[15]。本研究的皮内试验由5位护士操作,由于个体操作手法的误差,可能导致假阳性和假阴性结果。
以临床综合诊断作金标准,以皮试≥“+”作诊断界值,链格孢变应原原液1∶100稀释液皮内试验的特异度、阴性预测值,以及准确度均达90%左右,且ROC曲线下面积为0.915,说明皮内试验≥“+”具有较高诊断价值。无论以临床综合诊断还是以血清sIgE检测作标准,当以皮试≥“+”作诊断界值时,试验灵敏度都很高,但阳性预测值低;当以≥“++”作诊断界值时,试验灵敏度明显降低,但阳性预测值升高。可见,皮内试验的假阳性率较高。当不具备sIgE检测条件,单纯应用皮内试验结合临床病史诊断变态反应性疾病时,选择皮内试验≥“++”作为诊断界值,可明显降低将非变态反应误诊为变态反应的可能性。但一味提高皮肤试验的诊断界值,会降低灵敏度,造成将变态反应误诊为非变态反应的可能,故综合评估皮肤试验、sIgE检测,以及临床病史才能更准确的做出变应原特异性诊断。
对链格孢血清sIgE阳性水平与皮肤试验反应程度所做的等级相关性研究显示,sIgE阳性1级者,皮试多为“+”(66.7%);sIgE阳性3级、4级者,皮试多为“++”(63.3%和64.0%);皮试≥“+++”者共5例,sIgE均≥3级。经统计学分析,血清sIgE阳性水平与链格孢变应原注射液原液1∶100稀释液皮肤试验反应程度的等级相关系数为0.628 00(P<0.000 1),说明两者存在正相关。
在全部1043例受试者中,仅有5例在进行皮内试验后出现与链格孢变应原有关的不良反应(皮试结果均≥“+++),均为局部不良反应,占受试者总人数的0.48%。其中1例注射部位持续红肿超过24小时,1例出现注射部位硬结,均占总人数的0.01%。未发现与链格孢变应原有关的全身性不良反应。
综上所述,链格孢变应原注射原液1∶100稀释液进行皮肤试验,具有操作简单,安全,高灵敏度,高特异性的优点,可用于链格孢引起的变应性疾病的辅助诊断,还可为特异性免疫治疗提供可靠的客观依据。
[1]Horner WE,Helbling A,Salvaggio JE,et al.Fungal allergens[J].Clin Microbiol Rev.1995,8:161-179.
[2]Mari A,Schneider P,Wally V.Sensitization to fungi:epidemiology,comparative skin test and IgE reactivity to fungal extracts[J].Clin Exp Allergy,2003,33:1429-1438.
[3]岳凤敏,杨秀敏,何海娟.28种常见气传真菌的致敏性分析[J].中华微生物学和免疫学杂志,1996,16:42-44.
[4]Tabar AI,Lizaso MT,Garcia BE,et al.Double-blind,placebo-controlled study of Alternaria alternata immunotherapy:clinical efficacy and safety[J].Pediatr Allergy Immunol,2008,19:67-75.
[5]乔秉善.变态反应学实验技术[M].2版.北京:中国协和医科大学出版社,2002:6-36.
[6]叶世泰.变态反应学[M].北京:科学出版社,1998:104-117.
[7]Ivarez-Cuesta E,Bousquet JW,Canonica G,et al.Standards for practical allergen-specific immunotherapy[J].Allergy,2006,82:61.
[8]关凯,文昭明.变应原免疫治疗致全身反应[J].中华临床免疫和变态反应杂志,2011,5:298-302.
[9]尹佳,岳凤敏,王良录,等.夏秋季花粉症患者合并过敏性鼻炎和过敏性哮喘关系的情况及其相互关系研究[J].中华医学杂志,2005,85:1683-1687.
[10] chwindt CD,Hutcheson PS,Leu SY,et al.Role of intradermal skin tests in the evaluation of clinically relevant respiratory allergy assessed using patient history and nasal challenges[J].Ann Allergy Asthma Immunol,2005,94:627-633.
[11] Williams PB,Dolen WK,Koepke JW,et al.Comparison of skin testing and three in vitro assays for specific IgE in the clinical evaluation of immediate hypersensitivity[J].Ann Allergy,1992,68:35-45.
[12] 尹佳,王瑞琦,何海娟,等.皮内试验和血清特异性IgE检测在诊断葎草花粉症中的临床价值[J].中华医学杂志,2006,86:1906-1911.
[13] Jr.Adkinson NF,Bochner BS,Busse WW,et al.Adkinson:Middleton’s allergy:principles and practice[M].7th ed.England:Mosby-Wolfe,2008:1266-1280.
[14] Norman P,Lichtenstein L,Ishizaka K.Diagnostic test in ragweed hay fever:a comparison of direct skin tests,IgE antibody measurement,and basophile histamine release[J].J Allergy Clin Immunol,1973,52:210.
[15] Garcia-Ortega P,Merelo A,Marrugat J,et al.Decrease of skin and bronchial sensitization following short-intensive scheduled immunotherapy in mite allergic asthma[J].Chest,1993,103:183-187.

