Krüppel样因子4抑制高糖刺激MES-13细胞炎症的机制
糖尿病肾脏疾病(DKD)是糖尿病(DM)的严重并发症之一,在每年新进展至ESRD的患者中,DKD所占比例逐年升高。炎症反应是DKD发病的重要机制之一,而白细胞介素(IL-6)、单核趋化蛋白1(MCP-1)是DKD炎症机制中的重要指标[1]。Krüppel样因子4(KLF4)又名胃肠富集KLF(gut-enriched Krüppel-like factor,GKLF)[2],它可以调控IL-6[3]、MCP-1、iNOS[4]等因子表达,影响核因子κB(NF-κB)信号通路[5],从而发挥抗炎或促炎作用。在肾脏炎症方面,KLF4可调控HK-2细胞中MIF、MCP-1的表达[6],但KLF4在肾小球系膜细胞中是否有表达,以及它对高糖刺激的肾小球系膜细胞炎症是否同样具有调控作用,尚未见报道。因此,本研究拟采用体外培养肾小球系膜细胞模型,使用高糖刺激后,观察KLF4及炎症指标IL-6、MCP-1的表达变化,从而探讨DKD细胞模型中KLF4与炎症反应的关系。
DNA甲基化是表观遗传学的一种修饰方式,它参与了体内多项生理病理过程,而5-氮杂胞苷(5-Azacytidine,5-Az),是最常用的甲基化抑制剂。在糖尿病肾病中,DNA甲基化水平明显升高[7],KLF4的表达水平与其转录子甲基化水平负相关,应用5-Az后,KLF4表达水平升高[8,9],我们前期研究发现,应用5-Az后,可以上调转化生长因子β1(TGF-β1)刺激的人HK-2细胞中KLF4表达[10]。因此,本研究中,我们拟采用5-Az抑制高糖刺激的肾小球系膜细胞的甲基化过程,观察KLF4及炎症指标IL-6、MCP-1的变化,从而进一步寻找KLF4调控DKD炎症反应的可能机制。为探寻DKD的发病机制,寻找DKD的潜在治疗靶点提供理论依据。
材料与方法
实验材料
小鼠肾小球系膜细胞(MES-13) 由ATCC提供。
主要仪器 实时荧光定量PCR仪:美国Applied Biosystems公司、Axygen、ABI;SDS PAGE凝胶电泳与转膜设备、化学发光成像系统:Bio - Rad公司;核酸定量仪NanoDrop Lite、细胞恒温培养箱:Thermo;凝胶成像系统5000 Plus:SAGECREATION。
主要试剂 羊抗兔IgG/HRP标记、羊抗鼠IgG/HRP标记:武汉博士德公司;Anti- KLF抗体:Abcam公司、proteintech公司;5-氮杂胞嘧啶核苷:Sigma;Anti-IL-6抗体、Anti-MCP-1抗体:Proteintech公司;Anti-GAPDH抗体:南京凯基公司;KLF4 引物、GAPDH 引物、IL-6 引物、MCP-1 引物:GeneCopoeia公司;mRNA逆转录试剂盒:Thermo;KOD -Plus- Neo:TOYOBO;QIAprep Spin Miniprep Kit:QIAGEN;Positive clone测序:生工生物工程(上海)有限公司。
实验方法
细胞培养 将MES-13细胞株复苏后,用含低糖(5.5 mmol/L D-葡萄糖)DMEM的25 cm2细胞培养瓶在恒温细胞培养箱(37℃,5% CO2)内进行培养。根据细胞生长状态,按1∶ 2~1∶ 4比例传代。
细胞分组
高糖处理不同时间点的MES-13细胞实验将细胞接种于六孔培养板或60 mm培养皿,使用低糖DMEM完全培养基培养培养,当细胞生长至融合程度约70%~80%后,更换细胞培养基为高糖(30 mmol/L D-葡萄糖)DMEM完全培养基,分别于0h,6h,12h,24h,36h,48h,72h提取细胞内总蛋白,使用WB测KLF4蛋白表达,选取最佳刺激时间。
不同浓度5-Az干预高糖处理48h的MES-13细胞实验将细胞接种于六孔培养板或60 mm培养皿,使用低糖DMEM完全培养基培养,当细胞生长至融合程度约70%~80%后,更换细胞培养基,将实验分为低糖组,高渗组(30 mmol/L甘露醇),高糖+不同浓度5-Az组(0.5 μmol/L,1 μmol/L,2 μmol/L,5 μmol/L)。培养48h,分别提取各组细胞总蛋白,使用Westen Blot检测各组KLF4、IL-6、MCP-1蛋白的表达,选取5-Az最佳干预浓度。
5-Az(5 μmol/L)干预高糖处理48h的MES-13细胞实验将细胞接种于六孔培养板或60 mm培养皿,以低糖DMEM完全培养基培养,当细胞生长至融合程度约70%~80%后更换细胞培养基,将实验分为低糖组、高渗组、高糖组,高糖+5-Az(5 μmol/L)组。培养48h分别提取各组细胞总RNA,使用Real-Time PCR检测KLF4、IL-6、MCP-1 mRNA表达。
慢病毒转染KLF4基因至MES-13细胞的细胞实验将质粒转入MES-13细胞中,细胞分为空白质粒组(Lv-NC)和KLF4基因组(Lv-KLF4),细胞接种于六孔培养板或60 mm培养皿,以低糖DMEM完全培养基培养培养,当细胞生长至融合程度约70%~80%后,更换细胞培养基为高糖DMEM完全培养基,0h、48h时分别提取各组细胞总RNA,使用Real-Time PCR检测KLF4、IL-6、MCP-1 mRNA表达。
Western Blot 将各组MES-13细胞从细胞恒温培养箱中取出,弃旧完全培养基,用PBS溶液冲洗3次后,加入适量RIPA裂解液(强)及PMSF裂解细胞,提取细胞裂解液离心,留取上清液,测定目标样品蛋白浓度。将待测蛋白样品按每孔20~50 μg上样,然后进行电泳、转膜。封闭2h后,洗去封闭液,根据目的蛋白分子量,将PVDF膜裁成若干条带状小膜,将裁剪的PVDF膜分别放入已配好的含有不同目的蛋白一抗稀释液(KLF4、IL-6、MCP-1、GAPDH)的离心管中,4℃摇床上孵育过夜。洗脱一抗后,根据目的蛋白种属来源,使用目的蛋白抗体种属相对应的二抗孵育液孵育1~2h。洗脱二抗,加入ECL工作液至化学发光成像系统中进行显影。使用成像分析系统扫描分析发光结果,应用图像分析软件Image J进行目的蛋白和内参GAPDH吸光度分析。
Real-Time PCR 在GeneBank网站中查找小鼠KLF4、IL-6、MCP-1的基因序列,从GeneCopoeia订购KLF4、IL-6、MCP-1、GAPDH引物。KLF4引物:forward 5′-GAATTCATGAGGCAGCCACCTGGC-3′,reverse 5′-GGATCCTTAAAAATGCCTCTTCATGTG-3′;IL-6引物:forward 5′-CTGGGTACCGGATCCTGAGAGTGTGTTTT-3′,reverse 5’-GCAAGCTTGGAACTTCATAGCGGTTTCT-3’;MCP-1引物:forward 5′-CAGGTCTCTGTCACGCTTCT-3′,reverse 5′-AGTATTCATGGAAGGGAATAG-3′;GAPDH引物:forward 5′-ATCACTGCCACCCAGAAGACT-3′,reverse 5′-CATGCCAGTGAGCTTCCCGTT-3′。严格按北京全式金生物技术有限公司提供的试剂盒提取各组细胞总RNA、测定总RNA浓度、合成cDNA、PCR扩增。
构建KLF4过表达质粒 根据KLF4基因引物序列:forward 5′-GAATTCATGAGGCAGCCACCTGGC-3′;reverse 5′-GGATCCTTAAAAATGCCTCTTCATGTG-3′合成KLF4-CDS序列。按QIAGEN质粒小抽说明书提取质粒,测定载体片段的浓度。将目的片段进行扩增及酶切后,测定目的片段的浓度。按载体:目的片段=1∶ 7的摩尔比例计算载体和目的片段所需的体积比,于22℃连接60 min。取10 μl连接产物加入感受态细胞中于冰上(4℃)放置30 min,之后于42℃水浴中热击90 S,再迅速置于冰上(4℃)放置2~3 min。加入500 μl不含抗生素的SOC培养基于37 ℃,225 r/min振荡培养45 min。离心后弃上清液,将管底的菌液吹打散开,加入到含有载体上对应抗性(氨苄或卡那等)的培养平板中,用灭菌的涂布器涂匀倒置于37℃恒温培养箱内过夜培养。挑取若干个单菌落,进行小量摇菌培养,送测序公司进行测序鉴定。
统计学分析研究结果采用均数±标准差表示,运用GraphPad Prism5作图并进行统计学分析。统计方法为每两组之间的单因素方差分析,P<0.05为差异有统计学意义。
结 果
高糖处理不同时间点的MES-13细胞中KLF4蛋白表达KLF4蛋白在MES-13细胞中有表达。高糖处理组与未经过高糖处理组(0h)相比,KLF4蛋白表达水平于高糖处理24h时出现下调(P<0.05),于高糖处理36h、48h、72h时,出现明显下调(P<0.01)(图1)。因高糖处理48h后,KLF4蛋白表达下降明显,故在后续的实验中,选择48h为高糖刺激时间。
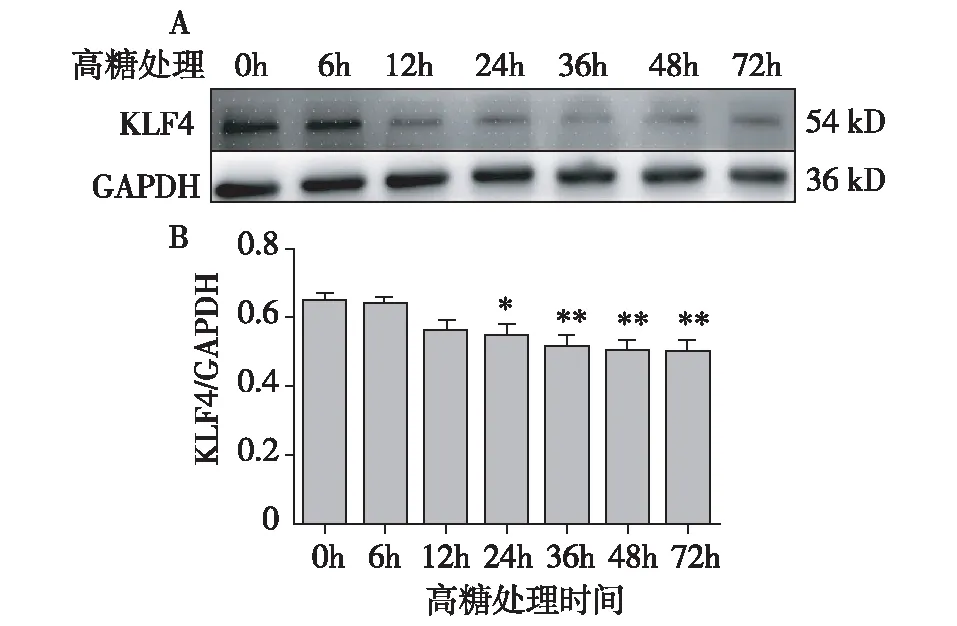
图1 高糖处理不同时间点的MES-13细胞中KLF4蛋白表达
不同浓度5-Az对高糖处理MES-13细胞中KLF4、IL-6、MCP-1蛋白表达的影响高渗组与低糖组相比,KLF4、IL-6蛋白表达无明显差异,MCP-1蛋白表达水平明显上调(P<0.001)。高糖组与低糖组相比,KLF4蛋白表达水平出现明显下调(P<0.001),IL-6蛋白(P<0.01)、MCP-1蛋白(P<0.001)表达水平明显上调。高糖+5-Az组与高糖组相比,5-Az浓度为0.5 μmol/L、1 μmol/L时,KLF4蛋白表达虽有上调,但无统计学差异,5-Az浓度为2 μmol/L、5 μmol/L时,KLF4蛋白表达水平明显上调(P<0.01)。5-Az浓度为0.5 μmol/L时,IL-6蛋白表达即有下调,但无统计学意义。不同5-Az浓度(1 μmol/L、2 μmol/L,5 μmol/L)时,IL-6蛋白表达均有明显下调(P<0.001)。不同5-Az浓度(0.5 μmol/L、1 μmol/L、2 μmol/L、5 μmol/L)时,MCP-1蛋白表达均有明显下调(P<0.001)(图2)。从以上结果中可见,当5-Az浓度为5 μmol/L时,5-Az对KLF4、IL-6、MCP-1蛋白表达均有明显影响,故我们选择5 μmol/L作为5-Az的干预浓度。
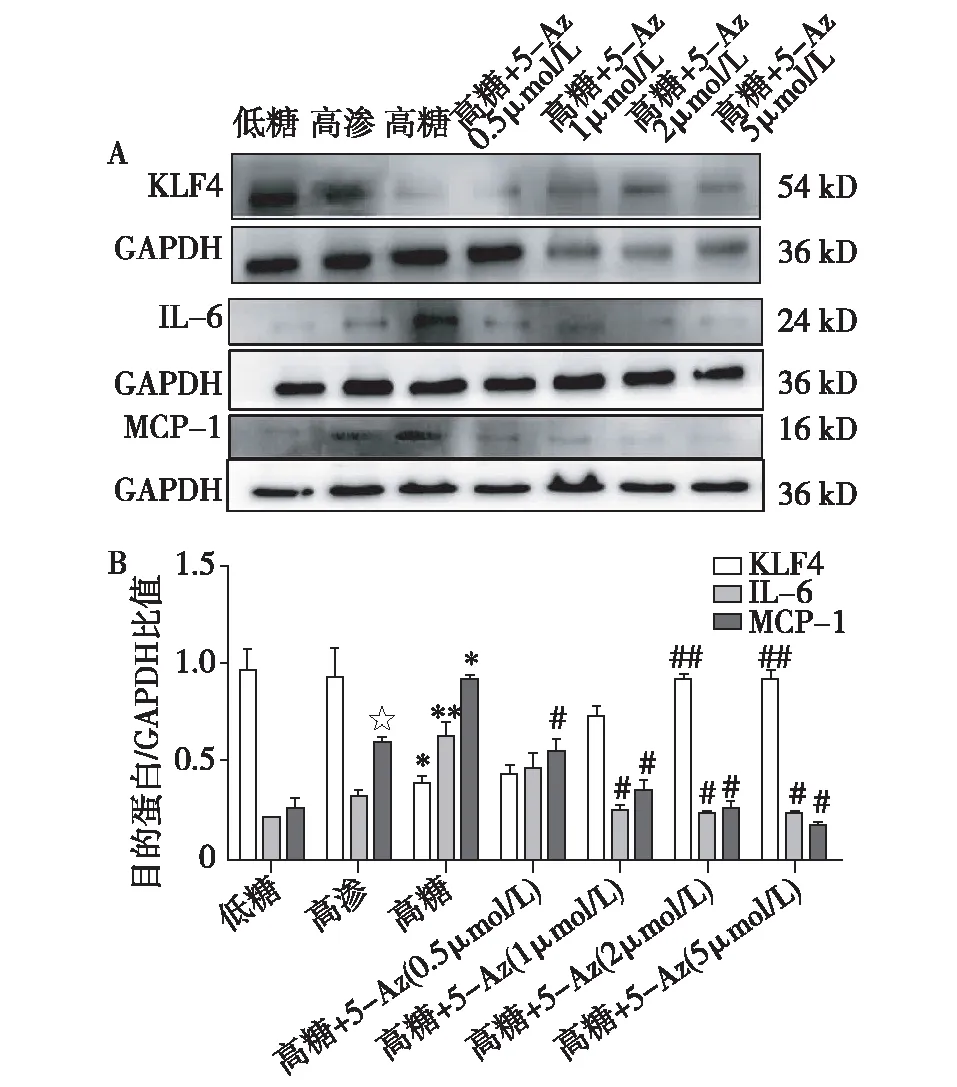
图2 不同浓度5-Az对高糖处理48h的MES-13细胞中KLF4、IL-6、MCP-1蛋白表达的影响
KLF4、IL-6、MCP-1基因在MES-13细胞的表达Lv-KLF4组与Lv-NC组相比,KLF4 mRNA表达明显增加,IL-6、MCP-1 mRNA表达无明显变化。Lv-NC(hi)组与Lv-NC组相比,KLF4 mRNA表达水平明显下调,IL-6、MCP-1 mRNA表达水平明显上调。Lv-KLF4(hi)组与Lv-NC(hi)组相比,KLF4 mRNA表达水平明显上调,IL-6、MCP-1 mRNA表达水平明显下调(图3)。
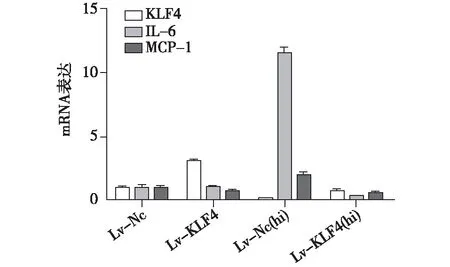
图3 KLF4、IL-6、MCP-1基因在MES-13细胞的表达
5-Az对高糖处理的MES-13细胞KLF4、IL-6、MCP-1 mRNA表达的影响高渗组与低糖组相比,KLF4 mRNA表达水平无明显变化,IL-6、MCP-1 mRNA表达水平均稍有上调,但无统计学差异。高糖组与低糖组相比,KLF4 mRNA表达水平明显下调(P<0.01),IL-6 mRNA(P<0.01)、MCP-1 mRNA(P<0.001)表达水平明显上调,而高糖+5-Az(5 μmol/L)组与高糖组相比,KLF4 mRNA表达水平明显上调(P<0.001),IL-6 mRNA(P<0.05)、MCP-1 mRNA(P<0.01)表达水平明显下调(图4)。
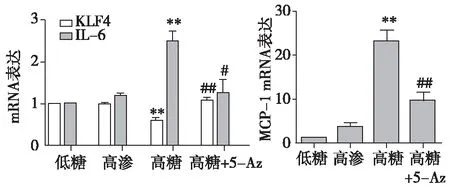
图4 5-Az(5 μmol/L)对高糖处理48h的MES-13细胞中KLF4、IL-6、MCP-1 mRNA表达的影响
讨 论
DKD是DM常见的微血管病变,已成为ESRD的主要原发病之一[11]。DKD的发病是多因素共同作用的结果,其中炎症反应越来越被人关注。在高血糖、肾素-血管紧张素-醛固酮系统激活等病理状态下,肾脏中可出现大量单核/巨噬细胞的浸润,且浸润的炎性细胞和肾脏固有细胞都可产生释放多种炎性因子,如MCP-1、IL-6等,这些炎症因子能通过自分泌、旁分泌的方式,放大炎症反应,最终可引起肾小球硬化和肾小管间质纤维化。
KLF4羧基端有高度保守的DNA结合域,氨基端含高度变异的转录调节域,因此可通过与其他因子相互作用,决定KLF4转录调节活性[12]。KLF4在组织器官中有重要生理功能,参与了许多重要的病理过程,如炎症调控、肾纤维化等[13-14]。KLF4能抑制IL-6、IL-1β、IL-10启动子转录活性,下调IL-6、IL-1β表达,上调IL-10表达[3,10,18],还可以调节NF-κB炎性反应通路,改善结肠[15]、心肌组织[10]和血管内皮细胞炎症[16]。KLF4还可调控巨噬细胞标记蛋白表达,影响巨噬细胞极化[4,17]、促进骨髓来源的抑制性细胞(MDSCs)聚集,发挥抗炎作用[19]。然而,KLF4也可使动脉发生粥样硬化[21],可活化如TNF-α、 IL-1α等促炎因子,可与Smad的共激活物p300/CBP相互作用,诱导iNOS生成,发挥促炎作用[20,22]。总之,在调控炎症方面,KLF4在不同组织和细胞中,发挥抗炎或促炎的作用,其调控炎症反应的机制存有差异。
KLF4在哺乳动物体内广泛表达,但在肾小球系膜细胞中是否表达仍不清楚,而DKD作为一种以炎症反应为主要特征之一的疾病,KLF4在DKD中的表达情况仍未见报道。因此,在本研究中,我们采用高糖刺激肾小球系膜细胞(MES-13细胞)建立糖尿病体外模型,明确KLF4在肾小球系膜细胞中的表达。本研究结果发现,KLF4蛋白在MES-13细胞中存在表达。而且在高糖处理MES-13细胞不同时间后,KLF4蛋白于高糖处理24h开始下调,于高糖处理36h、48h、72h时,出现明显下调。由此可见,KLF4蛋白可能参与了DKD的发生发展过程。
Mreich等[6]的研究表明,在高糖刺激的人肾小管上皮细胞(HK-2细胞)及小鼠DKD模型中,KLF4表达明显下调。而在HK-2细胞纤维化模型中,KLF4可降低TGF-β1干预诱导的炎性蛋白MIF、MCP-1表达上调,提示KLF4可抑制HK-2细胞的炎症反应。但KLF4对高糖处理的肾小球系膜细胞炎症的调控尚未见文献报道。为探讨DKD中KLF4对炎症调控的机制,我们在高糖处理MES-13细胞后,观察KLF4和炎症指标IL-6、MCP-1的表达变化。结果显示,高糖(30 mmol/L)处理MES-13细胞48h后,与低糖组及高渗对照组相比,KLF4的mRNA和蛋白表达均明显下调,而IL-6、MCP-1的mRNA和蛋白表达则显著上调。这提示在糖尿病肾病发病过程中,存在明显炎症反应,这与之前的报道相符合[23-24],而KLF4可能参与了IL-6、MCP-1表达的调控。为证实这一设想,我们将KLF4基因通过慢病毒转染至MES-13细胞中,在高糖刺激0h、48h时,分别检测KLF4、IL-6、MCP-1 mRNA表达水平,结果提示:在高糖刺激0h的MES-13细胞中,KLF4质粒组与空白质粒组相比,KLF4 mRNA表达水平明显上调,而IL-6、MCP-1 mRNA表达水平无明显变化。高糖刺激细胞48h后,在空白质粒组细胞中,KLF4 mRNA表达水平下调,而IL-6、MCP-1 mRNA表达水平明显上调,而KLF4质粒组与空白质粒组相比,KLF4 mRNA表达水平明显上调,而IL-6、MCP-1 mRNA表达水平出现明显下降。这说明在高糖刺激的MES-13细胞中,KLF4可抑制IL-6、MCP-1的表达而减轻细胞的炎症反应。
表观遗传学可在不改变DNA序列的前提下,调节基因或蛋白的表达。DNA甲基化是表观遗传学的重要组成部分。DNA甲基化在蛋白尿、炎症反应、EMT等多种病理过程中均发挥了重要的作用。甲基化抑制剂5-Az可降低DNA甲基化水平被广泛应用于肿瘤、EMT的研究。宫颈癌组织较正常宫颈组织相比,KLF4 mRNA表达水平显著下调,且其表达与启动子甲基化表现出显著的负相关。应用5-Az后,KLF4的mRNA和蛋白质在宫颈癌细胞中的含量明显增加[8]。同样有研究发现[9],5-Az可减少DNMT-1的表达,从而恢复KLF4在套细胞淋巴瘤细胞系中的表达。我们的前期研究也发现[10],在TGF-β1刺激的人HK-2细胞中,5-Az可抑制DNA甲基转移酶1导致的KLF4启动子过甲基化,上调KLF4的表达水平,减轻人HK-2细胞上皮EMT过程。同时Zhang等[7]在DKD模型中发现,DNMT-1、核因子Sp1、NF-κB-p65因子的表达水平显著增加。5-Aza可抑制Sp1/NF-κB p65-DNMT1通路,减轻糖尿病小鼠的蛋白尿。因此,我们推测KLF4在高糖处理的MES-13细胞中表达降低,与KLF4启动子过甲基化有关。故为探讨糖尿病肾病中KLF4对炎症调控的机制,我们应用不同浓度的5-Az,抑制DNA甲基化过程,观察其对KLF4和炎症因子IL-6、MCP-1表达的影响。本研究发现,高糖+5-Az组与高糖组相比,5-Az浓度为2 μmol/L、5 μmol/L时,KLF4蛋白表达水平明显上调。相反,IL-6蛋白表达在5-Az浓度为1 μmol/L、2 μmol/L、5 μmol/L时,出现显著下调。MCP-1蛋白表达则在5-Az浓度0.5 μmol/L、1 μmol/L、2 μmol/L、5 μmol/L时,均有明显下调。进一步用qPCR方法检测KLF4、IL-6、MCP-1的mRNA表达。结果显示,高糖+5-Az干预组与高糖处理组相比,KLF4 mRNA表达明显上调,IL-6、MCP-1 mRNA表达明显下调。这些结果提示,5-AZ可上调高糖处理的MES-13细胞中的KLF4表达,减少IL-6、MCP-1表达。由此可见,使用5-Az抑制DNA甲基化过程后,在KLF4蛋白上调的同时,肾小球系膜细胞的炎症反应明显减轻,提示糖尿病肾病发病过程中,KLF4表达下调很可能与DNA甲基化有关,而抑制DNA甲基化后,可使KLF4表达上调,炎症反应减轻。但KLF4启动子区域是否发生DNA甲基化,仍需后续研究进一步验证,如KLF4启动子甲基化水平检测。
综上所述,本研究通过高糖刺激肾小球系膜细胞建立体外DKD模型,观察高糖刺激后MES-13细胞中KLF4、IL-6、MCP-1的表达,提示KLF4蛋白可能参与了DKD的发生发展过程。而采用甲基化抑制剂5-Az干预后,可恢复KLF4 mRNA和蛋白表达,减轻IL-6和MCP-1 蛋白及mRNA上调的程度,表明KLF4蛋白表达的恢复可减轻DKD的炎症反应,其机制可能与KLF4启动子区域DNA甲基化相关。本研究为探讨DKD的发病机制及寻找新的治疗靶点提供了理论依据。

