免疫调节剂治疗系统性轻链型淀粉样变性
系统性轻链型淀粉样变性(AL淀粉样变性)是一种少见的浆细胞疾病,是由于克隆性浆细胞产生的轻链中正常的α螺旋结构被异常的β片层结构所取代,形成不可溶的淀粉样纤维丝沉积在组织器官而导致系统性疾病。AL淀粉样变性是最常见的系统性淀粉样变性的类型,常累及多个脏器。受累脏器的数目及严重程度,尤其是心脏受累程度,与治疗方案的选择及预后密切相关。AL淀粉样变性治疗的目标是降低血中游离轻链的水平,从而改善器官功能,延长生存期。
免疫调节剂(IMiDs)能通过多种机制产生抗肿瘤效应,最初用于多发性骨髓瘤(MM)的治疗,后逐渐应用到单克隆免疫球蛋白病(包括AL淀粉样变性)的治疗。目前IMiDs已发展至第三代。沙利度胺为第一代的IMiDs,是人工合成的谷氨酸衍生物,目前已广泛用于治疗MM及AL淀粉样变性[1]。来那度胺是第二代的IMiDs,是沙利度胺的类似物,其毒性更小、疗效更强。体外研究发现,其活性是沙利度胺的50~2 000倍[2]。泊马度胺是应用于临床的第三代IMiDs,它通过多种方式抑制骨髓瘤细胞,尤其是抑制新生血管形成,诱导骨髓瘤细胞凋亡,对发病机制与克隆性浆细胞有关的AL淀粉样变性有一定的疗效,促进肿瘤坏死因子α(TNF-α)-mRNA降解的作用显著高于沙利度胺及来那度胺,但目前国内尚未上市。本文将对IMiDs的作用机制及其在AL淀粉样变性治疗中的应用进行综述。
IMiDs的作用机制
IMiDs主要从5个方面发挥抗肿瘤作用:(1)IMiDs能共刺激CD3+T细胞,并能促进CD4+和CD8+T细胞增生及白细胞介素2(IL-2)和干扰素γ(IFNγ)的产生,增加NK细胞及NKT细胞杀伤克隆性浆细胞的效应[3];同时IMiDs可通过下调叉头蛋白P3(FOXP3) mRNA的表达而抑制调节性T细胞(Treg)的增生,减弱肿瘤细胞的免疫耐受,促进免疫细胞对肿瘤细胞的免疫应答[4];(2)通过细胞周期蛋白依赖激酶(CDK)途径下调核因子κB(NF-κB)的活性,产生直接抗肿瘤效应[4]。最近研究显示,这一效应与IMiDs促进淋巴转录因子Ikaros家族锌指1(IKZF1)及IKZF3的降解有关[5-6];(3)抑制蛋白激酶B(AKT)磷酸化,影响磷脂酰肌醇3激酶(PI3K)/AKT信号通路,从而调节骨髓间质细胞分泌TNF-α、血管内皮生长因子(VEGF)及成纤维细胞生长因子β(FGF-β)等血管内皮细胞迁移趋化因子,抑制血管新生[4,7];(4)影响骨髓微环境与恶性浆细胞之间的相互作用[8];(5)抗炎作用:这一作用与IMiDs抗骨髓瘤细胞之间的关系并不是十分明确,可能与其抑制环氧化酶2(COX-2)的表达有关[9]。
沙利度胺
沙利度胺单药治疗非初治的AL淀粉样变性的血液学反应率(HR)为0%~25%,血液学完全缓解(CR)及器官反应(OR)率为0%[10-11]。常见的不良事件(AEs)为乏力(94%)、水肿(67%~75%)及便秘(67%~69%)、嗜睡(67%),3或4级AEs总体发生率为50%~65%,最常见为水肿(33%)、呼吸困难(19%)等[10-11]。
地塞米松与沙利度胺(TD)联用有协同效应,疗效优于单药治疗,但在不良反应方面优势并不明显。TD方案治疗31例非初治患者[12],中位随访32个月, HR 48%(CR 19%),OR 26%,中位反应时间为3.6个月,3或4级AEs率65%,最常见的为症状性心动过缓(26%)、乏力(13%)。沙利度胺联合地塞米松及马法兰(MTD)三药联合治疗22例纽约心脏协会(NYHA)心功能分级为IV级的患者[13],中位随访28.3个月,HR 36%(CR 5%),18%(4例)获得心脏反应,中位生存期为5.3月,16例死亡(14例心衰,2例猝死),仅4例获得心脏反应的患者存活。6例发生3或4级AEs,其中水肿2例,肾功能衰竭、心动过缓、脓毒血症及动脉栓塞各1例。Wechalekar等[14]研究中,沙利度胺联合地塞米松及环磷酰胺(CTD)三药联合治疗75例(31例初治)患者,并根据患者年龄、水肿严重程度及NYHA心功能分级调整环磷酰胺及地塞米松剂量(24例减量),中位随访22个月, HR 74%(CR 21%),OR 33%。中位总体生存期(OS)为41个月,CR及部分缓解(PR)患者3年估计OS分别为100%及82%。8%患者不能耐受而终止治疗,治疗相关死亡率(TRM)为4%,所有患者均有乏力及便秘(1级),足量CTD组AEs发生率显著高于减量CTD方案组,32%患者因发生3或4级AEs需要减量。而Venner等[15]研究与上述研究结果类似。
综上,沙利度胺对初治及复发患者均有一定的疗效,TD方案疗效优于单药治疗,三药联合虽能提高HR,但CR率无明显提高,治疗过程中的主要AEs为乏力、水肿、便秘及窦性心动过缓等(表1)。
来那度胺
来那度胺治疗AL淀粉样变性的疗效有限,主要与地塞米松联用,也有三药联用(联合环磷酰胺/马法兰)。来那度胺联合地塞米松(LD)治疗22例患者,HR 41%(初治vs非初治:44%vs38%),OR 23%(初治vs非初治:15%vs33%)。中位随访17个月,中位HR时间为6.2月,而中位器官反应时间为9.4月[16]。3或4级AEs发生率为86%,最常见的3或4级AEs为中性粒细胞减少(45%)、血小板减少(27%)、皮疹(18%)、感染(18%)及乏力(18%),2例出现血栓栓塞[16]。另一研究中,LD治疗34例患者,HR 67%(CR 29%),OR 41%,中位HR时间为6个疗程。3或4级AEs常见为乏力(35%)及骨髓抑制(35%)[17]。LD治疗非初治患者,HR 41%~61%(CR 0~20%)[18-19]。Palladini等[18]研究中OR仅为4%,中位OS为14月,3或4级AEs发生率50%(12例),包括血小板减少4例,中性粒细胞减少3例,肾衰竭及皮疹各2例,致死性脑出血1例。Mahmood等[19]研究中2年的OS为84%,3或4级AEs发生率为27%(23例),包括中性粒细胞减少14例,脓毒血症4例,腹泻及皮疹各3例,血栓1例。
对于初治患者,来那度胺联合地塞米松及环磷酰胺(CLD)与来那度胺联合地塞米松及马法兰(MLD)方案在疗效方面无显著差别(HR 46%vs58%,CR 14%vs23%,OR 32%vs50%),但CLD的AEs似乎低于MLD(3或4级AEs,25%vs80%)[20-21]。MLD常见AEs为血液系统反应(31%,包括贫血、中性粒细胞减少、血小板减少等),其次为胃肠道反应(16%,主要为恶心,其次为便秘及腹泻)[21-22]。对于非初治患者,CLD及MLD在疗效及AEs方面无明显差别。CLD方案的HR为55%~62%(CR 5%~11%),OR 19%~31%,中位的OS为36~37.8个月,2年的OS为41%,3或4级AEs的总体发生率57%~74%[22-24]。最常见的AEs为骨髓抑制,其次为下肢水肿、乏力及便秘。3或4级AEs发生率为74%,其中血液系统毒性46%(中性粒细胞及白细胞减少、贫血、血小板减少),非血液系统毒性71%(皮疹、血栓及肺炎最常见)[22]。而MLD方案的HR 50%(CR 7%),OR率仅为11%,3或4级AEs的总体发生率88%,中位OS尚未达到,目前研究尚在进行中[25]。
目前来那度胺主要应用于复发/难治患者的治疗,常见不良反应为骨髓抑制,且加用烷化剂后,骨髓抑制发生率增加,但两药联合及三药联合之间的优劣尚需要进一步的随机对照研究(表1)。
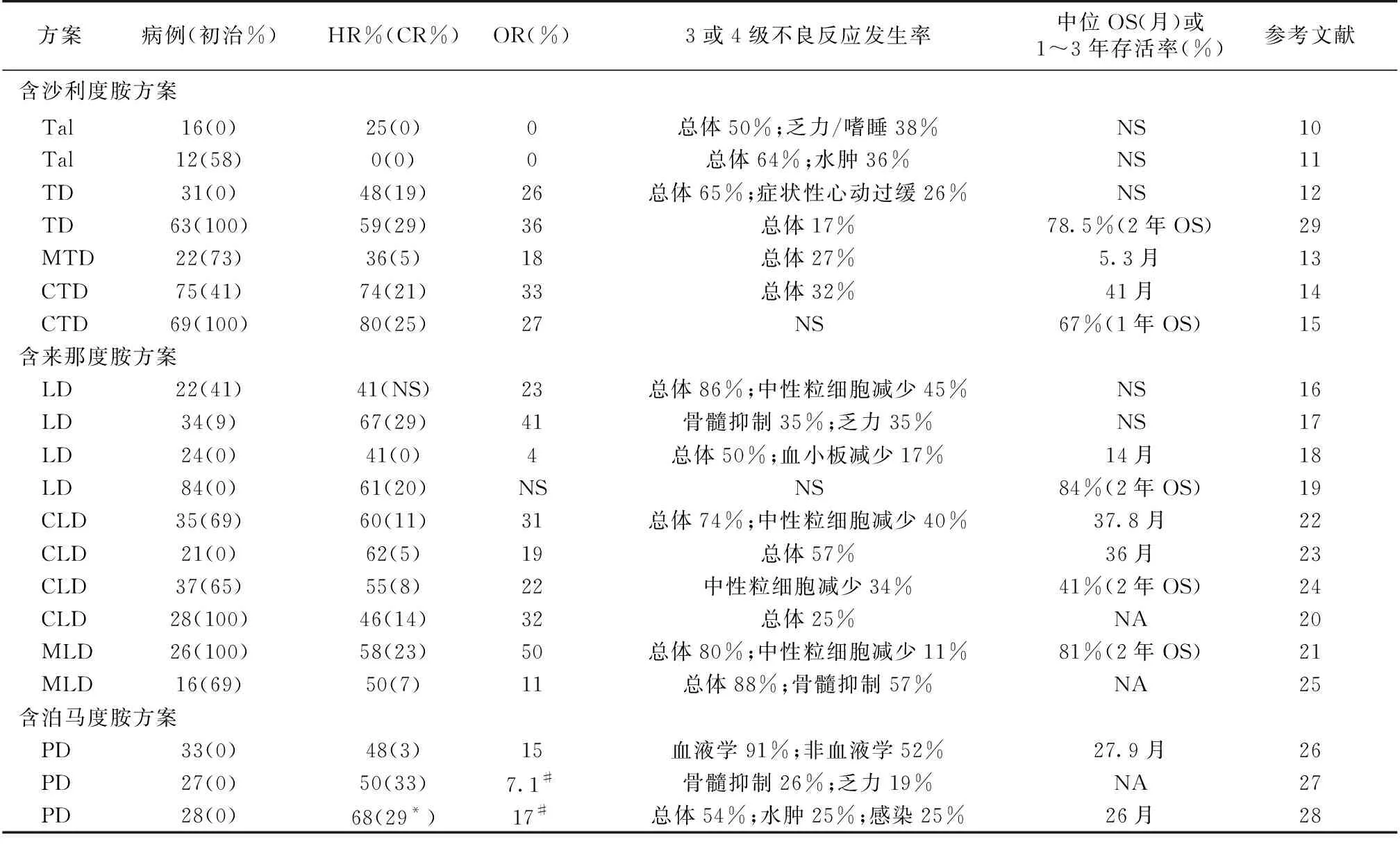
表1 免疫调节剂治疗系统性轻链型淀粉样变性国内外研究结果
泊马度胺
目前泊马度胺仅用于复发/难治患者的治疗。Dispenzieri等[26]采用PD治疗33例患者(47%患者曾接受来那度胺治疗,43%曾接受硼替佐米治疗),HR 48%(CR 3%),中位HR时间为1.9月,5例获得OR(15%),中位随访28.1月,17例死亡,1年的OS为76%。3或4级以上血液学AEs高达91%,常见为血液学AEs(n=15)、心血管AEs(n=10)及感染(n=9)[26]。Sanchorawala等[27]采用不同剂量的泊马度胺治疗27例患者,最大耐受剂量为4 mg/d,HR 50%,中位反应时间为3疗程,中位随访17.1月,中位OS尚未达到。常见的3或4级以上AEs为骨髓抑制(n=7,26%)、乏力(n=5,18.5%)。Palladini等[28]研究中,PD治疗28例既往经硼替佐米、烷化剂及免疫调节剂治疗患者,HR 68%(非常好的部分缓解及以上29%),中位反应时间为1个月,因疾病进展或AEs而中断治疗的患者分别为14例及8例。常见的1或2级AEs为发热(54%)、中性粒细胞减少(43%)及皮疹(14%),2例出现周围神经病变加重,15例(54%)患者发生了3或4级AEs,最常见的为水肿(25%)及感染(25%)(表1)。
IMiDs治疗的建议及存在的问题
根据AL淀粉样变性诊治指南[30],初治患者建议以硼替佐米为基础的方案或自体外周血干细胞移植(ASCT)作为一线治疗,而IMiDs因疗效及耐受性问题,主要作为复发/难治患者的治疗。但以沙利度胺为基础的方案治疗费用相对低廉,且不需要住院治疗,因此国内仍有部分患者选择TD方案作为一线治疗。我中心报道TD治疗63例初治患者,中位随访28个月,HR 58.7%(CR 28.6%),OR 36.5%,肾脏和心脏缓解分别为36.5%及15.9%,2年生存率为78.5%。常见的不良反应为外周神经病变(23.8%)、胃肠道反应(17.4%)、乏力(11.1%)、皮疹(6.3%)等,3或4级AEs发生率17.4%[29]。但该研究中纳入疗效分析患者脏器受累相对较轻、一般情况较好,且能持续治疗6个月以上,TD的有效率可能被高估。因此,TD主要作为硼替佐米或ASCT治疗复发后的挽救治疗或维持治疗,部分可耐受患者可作为一线治疗。
而LD则主要作为复发难治患者的挽救治疗或其他治疗副作用较大(尤其是神经毒性)患者的治疗。但LD治疗的AEs较明显,骨髓抑制、皮疹、急性肾损伤等,因此在用药过程中,尤其是早期,需密切监测血常规及肾功能,并且需要根据肾功能水平调整剂量。我中心采用LD治疗10例(7例纳入疗效分析)复发难治患者,治疗前根据肾功能调整剂量,3例HR(1例CR),2例OR,常见不良反应为骨髓抑制(4例)、血清肌酐升高、皮疹及乏力(各3例),3或4级AEs发生率30%[31]。而对于TD或LD疗效不佳的患者,国外研究中有采用三药联合治疗的尝试,但无明确研究证实,三药联合在疗效及安全性方面优于两药联合。泊马度胺在国内还未上市,我们缺乏此方面的用药经验。
值得重视的是,IMiDs治疗早期(1~6疗程)可能引起脑钠肽(BNP)及N端前体脑钠肽(NT-proBNP)的升高,尽管长期观察结果显示这种升高对患者的预后无显著影响,且大部分患者最终能降至基线水平,但短期内发生后影响对疗效的判断及病情的观察[23,26]。目前其发生机制尚不清楚,因此在治疗早期,需要密切监测并判断,心肌标志物的升高是由于药物的影响还是疾病的进展所致。
小结:IMiDS治疗AL淀粉样变性安全有效,已成为AL治疗的重要部分。但与MN患者相比,AL淀粉样变性患者对治疗的耐受性更差,因此IMiDs仍主要用于部分复发/难治AL淀粉样变性患者的一线治疗,多与有协同作用的地塞米松联合用药。如疗效欠佳,部分耐受性好的患者可考虑三药联用。由于目前缺乏大型的临床随机对照研究,不同IMiDs之间及两药联合和三药联合的优劣不清楚。IMiDs治疗的过程中需密切关注其毒副作用,随时调整治疗方案。泊马度胺为目前最新的IMiDs,研究显示其AEs低于前两者,且用药不受肾功能的影响,为治疗AL淀粉样变性最有前景的IMiDs。

