炎症小体与肾脏疾病
固有免疫作为宿主抵抗病原微生物入侵的第一道防线,在抗感染免疫中发挥极为重要的作用。它可以通过胞膜和胞质的模式识别受体(pattern recognization receptor,PRR)识别各种感染性及非感染性的刺激,包括病原相关分子模式(pathogen associated molecular pattern,PAMP)和危险相关分子模式(danger-associated molecular pattern,DAMP),进而激活下游信号通路,启动机体的免疫反应。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体是一种由NLRP3、半胱氨酸天冬氨酸蛋白酶(ASC)、凋亡相关斑点样蛋白(caspase-1)组成的多蛋白复合体,随着近年来对炎症小体研究和认识的深入,发现其参与了自身免疫疾病、感染和非感染疾病,同样在肾脏疾病的发生发展中也发挥了重要作用,该文主要依据最新研究探讨炎症小体在肾脏疾病中的作用。
炎症小体
目前已发现四类PRR:Toll样受体(toll-like receptors,TLR)、核苷酸结合寡聚化结构域(nucleotide binding oligomerization domain,NOD)样受体(NOD-like receptors,NLR)、视黄酸诱导基因1样受体和C型凝集素样受体。目前的研究发现NLR是一种细胞内PRR,是细胞内一种感应分子,大多数炎症小体均含有NLR结构,如NLRP1、NLRP2、NLRP3、NLRP6、NLRP12和NLRC4,当细胞受到刺激并且NLR识别受体后可形成炎症小体。除了NLRP1外,NLR蛋白由三种结构域构成,中间部分是NACHT核苷酸结合结构域,主要在激活过程中介导自身寡聚化,C端是富含亮氨酸结构域(LRR),介导自身调控和识别PAMPs或DAMPs,N端是效应结构域(NLRP含有PYD结构域,而NLRC4含有CARD结构域),主要介导蛋白之间的相互作用[1]。NLRP3炎症小体最具代表性。NLRP3炎症小体是一组多蛋白组成的分子,由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和Pro-caspase-1组成的多蛋白复合体。受到刺激后,NLRP3 N末端PYD结构域与ASC的PYD结构域相互作用,从而促进了Pro-caspase-1的募集和活化,使无活性的Pro-caspase-1转变成有活性的caspase-1,caspase-1一旦激活可在细胞质中切割促炎细胞因子Pro-IL-1β和Pro-IL-18使其成熟并释放到胞外[2](图1)。
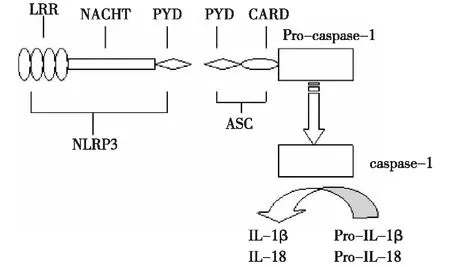
图1 NLRP3炎症小体结构及生物学功能
炎症小体的活化与调控
NLRP3炎症小体能感受胞质内多种微生物产物和代谢性应激。通过识别PAMP(细菌、病毒、细菌核酸残基、脂多糖等)和DAMP[ATP、活性氧(ROS)、尿酸盐结晶、高糖、双糖链蛋白聚糖等]等受体,经过一系列信号通路激活NLRP3炎症小体。炎症小体的活化需要启动和激活两种信号。第一种信号为启动信号,在启动过程中来自细胞膜上的TLR、肿瘤坏死因子受体(TNF)或IL-1R识别PAMP、DAMP等刺激信号,通过TLR2/MyD88/NF-κB通路来诱导pro-IL-1β、pro-IL-18的转录和翻译[2-3]。第二种信号为激活信号,起到NLRP3炎症小体的组装及炎症因子成熟的作用,目前研究发现NLRP3炎症小体激活通过P2X7R通道钾流出、ROS和溶酶体破坏模式这三种模型进行。通过这两种信号,使游离的NLRP3变成具有生物学活性的物质,进而发挥其生物学活性。另有研究显示,NLRP3炎症小体激活与线粒体功能障碍、钙离子通道及内质网的应激有关[4]。目前的研究仍然未知其具体的机制。此外,肾脏中的NLRP3还可通过非经典途径,如通过TGF-β信号传导,上皮-间质转化和纤维化发挥其作用[5]。
炎症小体也存在严密调控。内源性microRNA miR-223通过与NLRP3 mRNA的3′非翻译区结合而发挥对NLRP3基因表达的控制,从而将其靶向降解。Ⅰ型IFNs可通过两种不同的方式抑制NLRP3炎症小体,其中一种影响启动,而另一种影响激活[2]。Yang等[6]发现孤儿核受体小异二聚体伴侣通过与NLRP3竞争结合ASC,从而负调节NLRP3炎症小体。
肾脏NLRP3炎症小体相关基因的表达
肾脏炎症反应是对感染性或非感染性激活物产生的免疫应答,先前的研究表明炎症小体相关分子mRNA可在人类及小鼠肾脏中表达。有研究显示肾小球足细胞可表达NLRP3、ASC、caspase-1[7]。也有研究显示肾小管上皮细胞可表达NLRP3和炎症小体成分ASC和caspase-1[5]。而Lichtnekert等[8]观察到肾组织中的树突状细胞等免疫细胞可表达NLRP3所有成分,单独的肾小球细胞不能活化caspase-1和分泌成熟的IL-1β,表明肾脏中非免疫细胞不能诱导炎症信号,而免疫细胞是可以诱导的。目前的研究对于肾脏中具体哪种细胞表达功能性炎症小体还不清楚的。需要进一步的研究来证实。
炎症小体与肾脏疾病
炎症小体与慢性肾脏病(CKD) 炎症反应显著促进了CKD的进展,通过激活NLRP3-ASC-caspase-1轴来诱导和分泌炎症细胞因子(如IL-1β和IL-18等),这些因子在CKD发生发展中起重要作用。无论是在肾小球细胞、肾小管细胞和肾间质中,还是在浸润的炎症细胞中,NLRP3均参与了肾脏病的发生和发展(表1)。在狼疮模型小鼠的足细胞中观察到NLRP3炎症小体被激活,肾组织损害和足细胞足突破坏,同时出现了蛋白尿[9]。在糖尿病肾病小鼠肾小球内皮细胞和足细胞中可见NLRP3和caspase-1明显表达,当敲除小鼠NLRP3或caspase-1时,小鼠尿蛋白量明显减少[10]。NLRP3敲除的小鼠明显减弱了高同型半胱氨酸诱导的足细胞损伤和肾小球硬化症的发展[7]。在肥胖相关的足细胞损伤小鼠模型中,敲除ASC后表现出足细胞NLPR3炎症小体激活的降低,同时尿蛋白减少和肾小球硬化减轻[11]。NLRP3炎症小体参与了肾间质损伤,Ikeda等[12]在白蛋白负荷诱导的肾小管间质损伤小鼠中发现NLRP3、ASC、caspase-1表达显著增加,成熟IL-1β的分泌增多,肾小管间质损伤明显加重。通过单侧输尿管梗阻(UUO)诱导肾小管间质炎症模型中,NLRP3敲除小鼠相比野生型小鼠肾小管损伤和间质纤维化明显减少[13]。在白蛋白负荷诱导的小鼠肾小管损伤模型中观察到NLRP3/caspase-1/炎症细胞因子级联激活,细胞凋亡和细胞表型转变,同时出现了严重的管状结构损伤和肾小管细胞凋亡[14]。这说明了NLRP3也参与了肾小管损伤。高尿酸血症是心血管疾病和肾脏疾病的重要危险因素,在体外用尿酸刺激人近端肾小管上皮细胞时,显著的增加了NLRP3的表达和IL-1β的活化[15]。同样在体外高糖刺激人肾小球系膜细胞时,NLRP3、caspase-1、IL-1β的表达呈时间依赖性增加[16]。
除了在动物实验和体外研究中,NLRP3炎症小体在人肾脏病发生发展也起到了重要作用。在人类肾活检组织中,包括IgA肾病、狼疮性肾炎、微小病变、高血压肾损害和继发性局灶节段性肾小球硬化,均检出NLRP3 mRNA的表达较正常组织明显增加,并且与肾功能损害呈正相关,表明NLRP3可能参与CKD发病机制[13]。在狼疮性肾炎患者肾小球足细胞中检出NLRP3的表达,同时尿蛋白也增加,表明NLRP3的激活与足细胞损伤和蛋白尿的形成有关[9]。在系膜增生性肾小球肾炎患者肾小管上皮细胞中发现,NLRP3、caspase-1、IL-1β和IL-18的表达分泌明显增多,肾小管上皮细胞变性,管腔萎缩,炎性细胞浸润,且肾间质内炎性细胞也表达上述因子[17]。Granata等[18]在接受血液透析的CKD患者外周血单核细胞中检测到NLRP3炎症小体组分和促炎细胞因子的基因表达增加,caspase-1、IL-1β和IL-18的水平明显高于健康对照组。这说明了NLPR3-ASC-caspase-1轴参与了肾脏病的发生与发展。
Lichtnekert等[8]研究显示在抗肾小球基膜新月体肾炎模型中,内源性肾小球细胞不能通过NLPR3-ASC-caspase-1轴诱导肾小球肾炎,而存在于肾间质的树突状细胞能够激活该轴分泌IL-1β。表明该过程独立于NLRP3炎症小体,也不依赖ASC介导的caspase-1激活。另一研究显示在肾毒性血清肾炎模型中,敲除小鼠NLRP3和ASC基因,肾小球损伤和相关的炎症反应与野生型相比显著减弱。在ASC敲除小鼠中观察到活性IL-1β的分泌减少,而在NLRP3敲除小鼠中未观察到改变。表明独立于NLRP3炎症小体的另一个潜在的分子机制有关。这可能与肾小球肾炎期间以NLRP3介导的方式肾小球炎症蛋白,高迁移率族蛋白1的释放相关[19]。因此,显示出NLRP3对肾脏疾病作用的复杂性。

表1 NLRP3炎症小体在慢性肾脏病中的作用
炎症小体与急性肾损伤(AKI) NLRP3炎症小体在AKI的发生发展过程中也发挥了重要作用(表2)。在缺血再灌注肾损伤(IRI)小鼠中,肾小管上皮细胞NLRP3表达明显增加,肾小管上皮细胞出现坏死,刷状缘脱落,管状扩张,血清肌酐、血尿素氮和尿蛋白排泄显著增加,说明肾小管上皮细胞中的NLRP3炎症小体在IRI诱导的肾损伤中起关键作用[20]。NLRP3炎症小体也参与了造影剂及横纹肌溶解引起的AKI,沉默NLRP3后明显改善了肾小管上皮细胞变性、凋亡及炎细胞的浸润[21-22]。Cao等[23]研究显示在脓毒症诱导的AKI模型中,肾脏中NLRP3,ASC和caspase-1的表达增加,中性粒细胞浸润明显增高,同时出现了血清肌酐增高,NLRP3的敲除逆转了嗜中性粒细胞的浸润和肌酐增高。同样在人类新月体性肾小球肾炎和急性肾小管坏死等患者的肾组织中检出NLRP3明显表达[13]。
然而有趣的是,Iyer等[24]建立的IRI模型,发现NLRP3敲除后明显改善肾功能损伤,减少肾间质嗜中性粒细胞浸润,而ASC敲除的小鼠对AKI的上述改变无明显的影响,可能NLRP3炎症小体有不依赖于ASC及caspase-1的其他作用。Kim等[25]的研究证明NLRP3敲除的小鼠可抵抗IRI引起的AKI,而在NLRP3敲除后顺铂诱导的小鼠AKI中caspase-1并未出现降低,反而出现caspase-1活性增加,并且肾小管坏死、肾小管细胞凋亡、血尿素氮和血清肌酐均未显著降低,表明NLRP3可能对顺铂诱导的AKI影响较小,而NLRP1、ASC在顺铂诱导的AKI中增加,提示NLRP1在顺铂诱导的AKI中起作用。可见NLRP3在不同诱因的AKI中发挥不同的作用。

表2 NLRP3炎症小体在AKI中的作用
小结:NLRP3炎症小体参与了肾脏炎症反应,同时NLRP3的非经典作用可能对肾脏损伤有重要影响,NLRP3炎症小体在肾脏疾病的病理生理中扮演了极其重要的角色。尽管关于NLRP3 炎症小体的研究已经取得了很大进展,但是仍有许多问题亟待解决,如炎症小体与其他信号通路之间的相互关系,及NLRP3炎症小体在炎性反应疾病中具体的作用机制等。目前NLRP3炎症小体在肾脏病领域中的研究仍有很大的空间,可能为今后探索疾病的发病机制提供有利的证据,为治疗相关疾病提供新的治疗思路和靶点。

