肥胖致肾脏病的发病机制及治疗进展
肥胖是由于机体长期摄入能量过多,导致体内脂肪积聚和(或)分布不均,体重增加而造成的一种疾病症状。任何人均可能发生肥胖,以中年人多见,且女性多于男性。2005年,全球范围内肥胖和超重患者已达13亿,预计到2030年这一数据将增加至20亿[1]。肥胖患者脂肪堆积、体重增加导致的代谢异常是糖尿病、心脑血管疾病及慢性肾脏病(CKD)的基础。
2017年第12个世界肾脏病日的主题是“肾脏病与肥胖:健康生活方式、维系肾脏健康”,为此,“Nature Reviews Nephrology ”邀请了五位不同国家本领域的专家,就肥胖与肾脏疾病的流行病学特点、发病机制和治疗策略进行总结,并指出目前仍存在的问题和下一步的研究方向[2]。本文将从上述角度进行综述。
流行病学特点
近年来,全球的生活方式发生了显著变化,食品生产工业化导致、饮食结构改变,高卡路里、肉类食物摄入量增加,静坐的生活方式、能量消耗减少,使得代谢相关性疾病尤其是肥胖的患病率增加[3-4]。通常采用体质量指数(BMI)来衡量肥胖程度,国际标准中BMI≥30 kg/m2为肥胖,而中国人群BMI达到28 kg/m2即为肥胖[5]。
进一步研究显示,中低收入的发展中国家人群肥胖率增长明显;在性别方面,男性超重比例已由1980年的29%增长至2013年的37%,女性则由30%增加至38%[6];近年来儿童和青少年人群中肥胖也越来越普遍。肥胖进一步增加了CKD及终末期肾病(ESRD)的发病风险[7]。
生活方式与CKD
人们对饮食习惯影响肾功能的认识由来已久。20世纪已有动物实验证实能量摄入过高会导致肾脏肥大和蛋白尿;近年来的研究表明,除了高蛋白饮食之外,高脂肪摄入也可影响肾功能。高钠饮食与高血压病的发生相关,同时也增加了氧化应激反应而加速肾损伤[8-9];高钙、高磷饮食亦如此[10];而改变生活方式如戒烟、减轻体重、减少酒精摄入、加强体育锻炼、养成良好的生活习惯可减少蛋白尿的发生风险。挪威的一项研究发现改善血压、血脂水平并结合规律的运动使CKD的患病率在10年间维持稳定[11]。
遗传和环境因素也参与上述过程,共同影响CKD患者的疾病进展和肾脏预后(图1)。

图1 生活方式对CKD进展的影响
致病机制
肥胖患者体内出现一系列代谢紊乱,可导致肥胖相关性肾病(ORG)的出现。其主要临床表现为不同程度的蛋白尿,通常无明显镜下血尿;肾组织病理表现为肾小球肥大,伴或不伴局灶节段性肾小球硬化,免疫荧光提示寡免疫复合物沉积,可伴IgM或C3非特异性沉积或节段沉积。
肾脏血流动力学变化肥胖状态下肾脏入球小动脉扩张,血流灌注增加,进而肾小球滤过率(GFR)将增加,以满足更高的代谢需求,肾脏自动调节能力受损,肾小球毛细血管压力增大,管壁张力增加,毛细血管增粗,使得足细胞分布相对稀疏,导致蛋白尿的产生[2](图2)。且一旦出现肾脏受累,ORG即随蛋白尿的程度而进展。
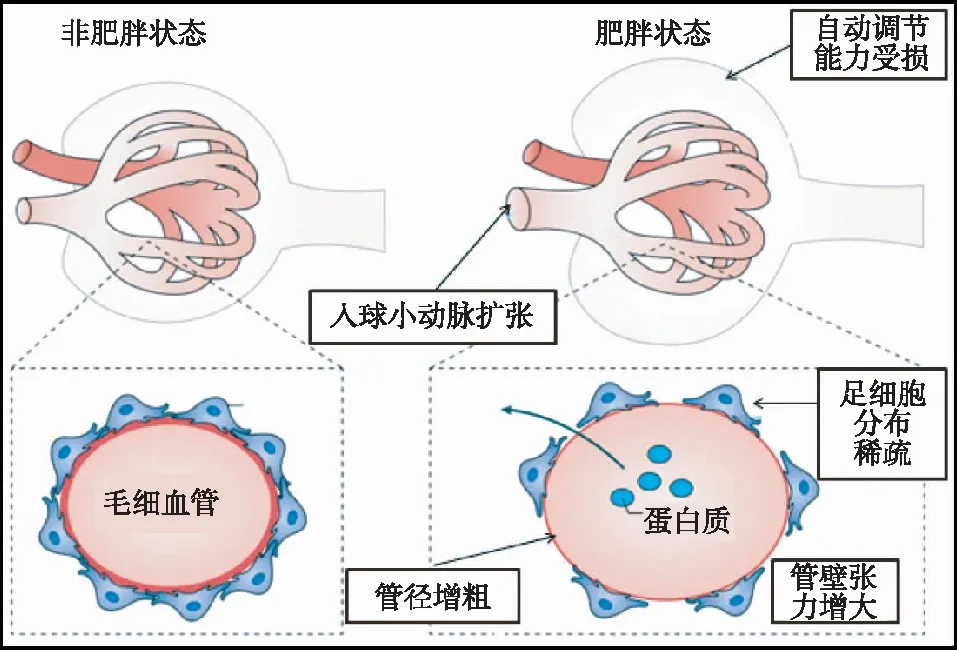
图2 肥胖状态下肾损伤机制
激素变化研究表明肾脏血流动力学和脂肪组织衍生的脂肪因子变化在ORG进展过程中都起着重要作用[7]。肾素-血管紧张素-醛固酮系统(RAAS)的过度激活促进肾小球高滤过和GFR升高,促进肾小管重吸收钠、水,转运至致密斑溶质减少,管球反馈失活,入球小动脉舒张,产生肾小球高灌注、高压力、高滤过[12]。
脂肪组织可分泌大量脂肪因子(血管生成素、血管内皮生长因子、瘦素、脂联素等),脂肪堆积可改变循环中相应激素的水平,这些激素作用于足细胞、系膜细胞和小管细胞,参与肾组织细胞肥大、细胞外基质增生和肾脏纤维化过程[13]。小鼠体内实验表明脂联素缺乏可导致足突消失和蛋白尿的产生[14]。肥胖患者体内高瘦素、低脂联素水平,IFN+/IL-17+CD4+T 细胞数量增加,Foxp3+CD4+调节T细胞数量减少,可进一步促进炎症反应,继而导致肾小球硬化、小管间质萎缩[15]。
此外,胰岛素抵抗(IR)也参与了肥胖患者肾损伤的过程。胰岛素介导的PI3K-Akt-mTOR通路影响足细胞功能[16]。IR使得极低密度脂蛋白产生增多,促进高三酰甘油血症的发生,而高三酰甘油血症是蛋白尿产生的危险因素。IR患者的糖耐量减退,高胰岛素血症,氧化应激增加,CRP、IL-6等炎症因子释放,影响内皮功能,导致肾小球硬化或动脉粥样硬化相关的肾损伤[17]。
肠道菌群变化有研究发现肥胖患者的肠道微生物群发生了变化,将肥胖小鼠的肠道菌群移位至正常小鼠体内可诱发肥胖表型的表达。具体机制尚不清楚,可能由于微生物可致肠道炎症因子释放,破坏肠道动态平衡、扩大炎症反应[18]。另一方面,CKD患者体内的炎症反应可通过激活原位脂肪细胞或诱使免疫细胞向脂肪组织移位并活化,促进脂肪的堆积(图3)。

图3 脂肪组织、肠道菌群和肾脏之间的相互作用
正常人体功能的维持及各种激素的动态平衡需要肝脏、肾脏、脂肪和肠道器官及免疫细胞、实质细胞分泌调节因子的功能保持稳定。而肥胖患者由于脂肪堆积、脏器功能失调,炎症因子累积,这种动态平衡被打破,引起血压升高、RAAS和交感神经系统激活,瘦素升高/脂联素降低,肠道短链脂肪酸产菌减少、菌群失衡,炎症反应扩大。CKD患者也是如此,由于其心、肾、肠道功能紊乱,尿素氮、血清肌酐等毒素水平升高,并因肾功能下降导致活动量减少,需严格控制饮食、药物甚至肾脏替代治疗来改善失衡。
治疗策略
由于肥胖通常与其他慢性非传染性疾病如糖尿病、高血压、高脂血症、睡眠呼吸暂停等合并存在,故有必要在肾脏病、糖尿病、心血管病等多学科专家的共同努力为患者制定个体化、全面综合的疗法。
饮食控制生活方式干预应被作为一线疗法,从青少年时代即开始重视,保持低热量、均衡饮食的习惯,预防肥胖的发生。
饮食控制、限制能量摄入有助于延缓年龄相关疾病的发生。富含膳食纤维的饮食有助于促进肠道短链脂肪酸产菌的增多,有研究证实增加膳食纤维摄入可降低CKD患者炎症反应和全因死亡率,对肥胖、代谢综合征及CKD的治疗作用已得到证实[19-21]。但任何一种食物无法包含所有营养元素,只有通过均衡饮食、合理搭配才能达到营养齐全;市面上有些食物有明确的标签注明成分、含量及相应热量,并有大众媒介向人们普及合适的选择搭配方式[22]。限制能量平衡膳食能达到减重、降低脂肪摄入及改善胰岛素敏感性的作用(脂肪、蛋白质、碳水化合物供能比例分别为20%~30%、15%~20%、40%~55%)。高蛋白膳食模式及轻断食膳食模式也有其独特的优势[23]。
运动尽管节食可使体重短期内下降,长期控制饮食并结合适当运动有助于持续减重。减重5%~15%即可降低肥胖相关性疾病发生的风险[24]。
规律运动可促进血液循环,缓解轻中度高血压,降低体重,提高胰岛素敏感性,减轻胰岛素抵抗,改善血脂和心肺功能,促进全身代谢。加强体育锻炼可降低心血管疾病发生的风险、延缓CKD的进展[25]。
建议超重或肥胖的患者加强有氧运动,逐渐增加运动的频率和强度,每周3~5d内累计进行≥150 min的温和运动。久坐易引起下肢肥胖,可适当增加肢体锻炼及休闲运动。为使个体化运动取得更好的效果,可在运动生理专家或专业认证健身机构人员的指导下进行运动训练[26]。
药物治疗
RAAS抑制剂 鉴于肾脏血流动力学改变在肥胖相关性疾病发病中的作用,RAAS抑制剂可作为一类重要的治疗药物。ACEI/ARBs通过阻断AT1受体、激活AT2受体,降低血管紧张素Ⅱ水平、增加缓激肽等扩血管物质的释放,控制血压;同时它们也有抗细胞增生、抑制纤维化的作用,从而减轻蛋白尿、延缓肾脏病变进展,降低ORG患者ESRD的发生率[27]。
二甲双胍 是一种有减重作用的降糖药,动物实验证实其具有抗肾脏纤维化的作用[28],可能对ORG患者有益,但应警惕乳酸酸中毒、脱水和心力衰竭的发生。
钠-葡萄糖共转运蛋白2 (SGLT2)抑制剂 研究发现依帕列净(empagliflozin)能够降糖减重,延缓糖尿病相关性肾损害的进展[29]。达格列净是FDA批准的第二种SGLT2抑制剂,作为单药治疗T2DM在国内获批上市,除了减重、降糖,它在改善心力衰竭、肾衰竭及死亡等预后方面也有积极意义,但需要警惕其引起急性肾损伤的风险。
胰高糖素样肽1(GLP-1)类似物 GLP-1受体激动剂可刺激胰岛β细胞的增殖和分化,抑制凋亡,促进胰岛素分泌发挥降糖效应;同时GLP-1还可作用于胰岛α细胞,抑制胰高血糖素的释放,并直接作用于δ细胞,促进生长抑素的释放,进一步作为旁分泌激素抑制胰高血糖素的分泌。由于GLP-1具有葡萄糖浓度依赖性的降糖作用,减少了低血糖副作用,保障了临床用药的安全性。长期应用GLP-1受体激动剂,通过刺激位于下丘脑的GLP-1受体,调节食欲,控制热量摄入,具有减重作用。新近研究表明,长期使用还可减少心血管及肾脏并发症[30],但也有关于艾塞那肽引起急性肾损伤的报道[31]。
盐酸芬特明 中枢性减重药物,能够刺激交感神经系统,释放去甲肾上腺素和多巴胺,产生饱腹感抑制食欲,但其托吡酯制剂有致出生缺陷的风险,并有剂量依耐性的嗜睡倾向。
奥利司他 肠道胰酶抑制剂,可减少膳食中脂肪吸收,未吸收的脂类随便排出而起到减重作用。
减重药物需谨慎使用。曾有报道因服用中草药减肥而出现肾脏受损的群体性事件[32],进一步分析发现其所服用的减肥药中均含有马兜铃酸,可导致肾脏纤维化和ESRD。
手术治疗手术可控制代谢综合征,使体重显著降低,有益于生活质量提高、降低ORG发病率、控制血糖的控制、改善肾功能。有研究显示Roux-en-Y旁路手术可使CKD 4~5期的患者肾小球滤过率升高[33]。手术减重花费较大、风险较高,可以作为ORG的替代治疗方式,适用于严重肥胖(BMI≥35 kg/m2)、拒绝药物或改善生活方式的患者。减重手术的目的一般是通过产生吸收障碍使得体重减轻,但许多患者术后出现蛋白质-能量-营养不良(PEW)严重并发症,故手术对象、时机、方式的选择很重要。
由于肠道菌群参与胰岛素抵抗和肥胖的发生发展,粪菌移植可调节肠道菌群,恢复机体正常的肠道微生态,从而提高胰岛素敏感性。但关于粪菌移植的作用机制、技术标准化、 安全性评估等还有待于进一步研究。
未来研究方向
肥胖具有明显的家族聚集性,肥胖患者亲属发生肥胖的风险也明显增高;相关基因及血清生物标志物也有待于进一步探索,以便早期识别高危个体、及早干预肥胖及相关并发症的发生[2]。
尽管人们对肥胖与肾脏病之间的联系已有深入的研究,但仍有一些亟待解决的问题。(1)营养过度与营养不良均与肾脏病相关,BMI过低或升高均可诱发炎症,促进CKD的发展,也研究提示肥胖对CKD患者具有保护作用[34]。因此我们有必要明确营养程度是肾脏病发生的危险因素还是肾病进展的标志;肥胖状态下最影响疾病进程的究竟是特定的肥胖类型还是BMI?(2)近年来分子遗传学、表观遗传学及生物信息学技术发展迅速,为肥胖与肾脏疾病相关发病机制和靶向治疗的研究提供了便利,因此有必要对CKD患者肠道微生物群的代谢改变展开深入研究; (3)尽管肥胖患者有相应的治疗方法,改变生活方式、药物及手术均可达到减重的目的,但目前仍不明确以减重手术和运动为代表的非药物治疗方式能否改善ORG患者的肾脏预后。
小结:生活方式与肥胖患病率升高显著相关。肥胖患者肾脏血流动力学改变、激素水平异常、肠道菌群紊乱和炎症反应,进一步导致肾脏损伤。改善生活方式有助于减轻代谢综合征,延缓肾病进展,治疗措施主要包括控制饮食、规律运动、药物、手术,提倡综合性个体化疗法。对肥胖相关基因及血清学生物标志物的进一步探索,有利于识别高危个体、及早干预ORG的进展。

