系统性红斑狼疮伴抗磷脂综合征
病史摘要
现病史20岁女性患者,因“尿检异常伴贫血、血小板低10 d,血清肌酐(SCr)升高5 d”于2015-05-08入院。
2015-04-29患者无诱因出现面部及双下肢水肿,就诊于外院,查尿蛋白9 175 mg/24h(尿量1 500 ml),隐血++,血清白蛋白(Alb)21.9 g/L,球蛋白(Glo)、肝酶正常、SCr 67.1 μmol/L,血红蛋白(Hb)79 g/L,血小板(PLT)68×109/L,IgG低,抗核抗体(ANA)、抗双链DNA(A-dsDNA)抗体、SSA、抗核小体、抗核糖体P蛋白阳性,补体低,予甲泼尼龙(MP)40 mg/d静滴×3d后血象略改善。5月3日出现咳嗽、咳痰、发热,体温39℃,无畏寒及寒战,抗感染、对症治疗(具体不详)效果不佳。5月7日入我院急诊,肺部CT示两肺散在炎症伴胸腔积液,降钙素原0.92 ng/ml,诊断为肺部感染,静滴头孢他啶抗感染1 d。病程中曾肩部肌肉酸痛、面部红斑、光过敏,偶有胸闷、呼吸困难,无头痛、腰痛、尿频、尿急、尿痛、口干、眼干、口腔溃疡,体重下降约3 kg。
相关病史既往史及个人史无特殊,月经正常,未婚未育,1姑母患肾炎,母亲患“抑郁症”。
体格检查体温37.1℃,血压120/76 mmHg,心率110次/min,双颧部红斑,心率快,律齐,各瓣膜听诊区未闻及杂音或病理性心音,双肺散在干湿啰音,双下肺听诊呼吸音减弱、叩诊呈浊音,腹部查体未见异常,双肾区叩击痛阴性,双下肢无水肿。
实验室检查
尿液 尿常规红细胞++,尿沉渣红细胞计数 50万/ml(多形型),白细胞2~4个/HP,尿蛋白+++,尿糖阴性,胆红素阴性,酮体阴性,C3 4 mg/L,α2-MG 6 mg/L,N-乙酰-β-D-氨基葡萄糖苷酶(NAG) 52.9 U/(g·Cr),视黄醇结合蛋白(RBP) 44.1 mg/L,溶菌酶 11.1 mg/L,尿渗量 344 mOsm/(kg·H2O)。计算钠滤过分数3.58%、肾衰指数4.97。
血常规 Hb 59 g/L,网织红细胞2.35%(正常0.5%~1.5%),白细胞5.8×109/L,PLT 79×109/L。外周血红细胞碎片阴性。
血生化 Alb 31.1 g/L,Glo 19.7 g/L,尿素氮(BUN) 28.91 mmol/L,SCr 383.66 μmol/L,尿酸(UA) 683 μmol/L,胱抑素C 7.47 mg/L,胆红素及转氨酶正常,乳酸脱氢酶(LDH) 454 U/L(正常值60~240 U/L),无明显电解质紊乱及酸碱失衡,血脂、血糖正常,CRP 53.7 mg/L,脑钠肽前体(BNP)1 180 pmol/L,降钙素原(PCT) 0.688 ug/L,肌钙蛋白T 0.101 ng/ml,肌钙蛋白I 0.73 ng/ml。
凝血功能 凝血酶原时间12.4 s,活化的部分凝血活酶时间44.1 s,国际标准化比值(INR)0.8,凝血时间19.6 s,纤维蛋白原334 mg/L,D二聚体0.53 mg /L。
免疫 ANA 1∶ 256,抗ds-DNA抗体、抗中性粒细胞胞质抗体阴性,抗心磷脂抗体谱(ACL)IgG阳性13.94(正常值<12)IU/ml、IgM阳性33.92(正常值<12)IU/ml、IgA阳性15.24(正常值<12)IU/ml,抗β2-糖蛋白1抗体阴性,狼疮抗凝物(LA)正常,抗GBM和抗TBM抗体阴性,补体C3/C4 0.497/0.1 g/L,IgG 5.75 g/L,IgA、IgM、IgE正常,类风湿因子、抗“O”阴性。外周血淋巴细胞亚群CD3+411个/μl,CD4+123个/μl,CD8+271个/μl,免疫球蛋白冷沉淀 83.43 mg/L。Coomb’s试验阳性,间接抗人球蛋白试验、血清酸化溶血试验阴性。
内皮细胞功能 血管内皮细胞黏附分子(VCAM)、血栓调节蛋白(TM)、循环内皮细胞及E选择素均正常。ADAMTS13抗体阴性、活性正常。
病原学 多次血培养阴性,痰培养阴性,呼吸道病毒抗体阴性,结核感染T细胞检测阴性,GM试验无明显异常,真菌G试验阴性。
辅助检查心电图大致正常。眼底检查未见明显异常。
肾脏B超 左肾118 mm×49 mm×59 mm,右肾116 mm×46 mm×58 mm,皮质回声增强,皮髓界限不清,集合系统光带分离左7 mm、右6 mm(2015-05-08)。
胸部CT 左肺上叶舌段及两肺下叶炎症;双侧胸腔积液伴左肺下叶萎陷;纵隔及双侧腋窝多发小淋巴结(2015-05-08)。
头颅MRI 左颞叶可疑条状血管影。
心脏超声 二尖瓣局部回声略增厚,前叶瓣尖似见点状强回声漂浮,瓣膜开放尚可,关闭欠佳,轻度返流;左心室内径49 mm;LVEF:60%(图1A)。
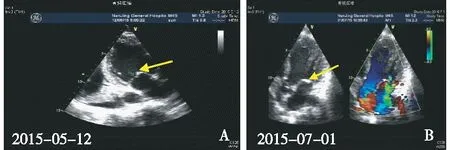
图1 A:二尖瓣局部回声略增厚,前叶瓣尖似见点状强回声漂浮;B:心脏彩超示二尖瓣钙化并重度关闭不全
病情变化及诊疗经过2015-05-08入院即静滴MP 40 mg/d控制原发病、莫西沙星0.4 g/d抗感染。反复发热,体温最高38.8℃,伴咽痛、流涕,尿量1 200 ml/d,尿色正常,5月9日起尿量迅速减少、BNP及SCr升高(图2),5月10日无尿,开始连续性血液净化治疗(CRRT)、换比阿培南0.3 g/q8h抗感染,10d后体温正常,仍间断流涕,CT示肺部病变无改善,因血液系统损害严重予MP 0.5 g/d×3d和人免疫球蛋白75g冲击治疗,后Coomb’s试验转阴,血小板升至118×109/L。6月18日BNP仍4 138 pmol/L,血压正常,持续无尿,激素减量,返当地血液透析3次/周,每次脱水2 kg,体重下降5 kg。
6月27日心慌、胸闷渐加重,夜间不能平卧,频繁咳嗽、咳黄痰、气喘、咯血,复查CT示两肺弥漫炎症,PCT 1.530 μg/L、BNP 4 138 pmol/L,考虑心功能不全伴肺部感染,予静滴比阿培南抗感染、行CRRT脱水3 200 ml后胸闷好转、咯血减轻。NT-Pro BNP>35 000 pg/ml,PRO-BNP 2 686.60 pg/ml,复查ACL-IgG升至25.36 IU/ml。改为血液透析4次/周,血压控制正常、外周无水肿情况下仍反复胸闷,复查心脏彩超(2015-07-01)见二尖瓣见点片状强回声,瓣膜开放尚可,关闭欠佳,关闭时略错合,左心室内径50 mm,左室壁各节段运动幅度减低;左心功能减低;二尖瓣钙化并重度关闭不全(图1B);轻度主动脉瓣返流;LVEF:34%。
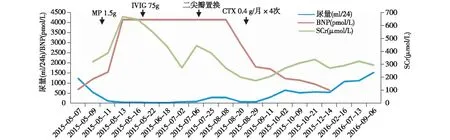
图2 BNP、尿量及SCr变化 BNP:脑钠肽前体;SCr:血清肌酐;MP:甲泼尼龙;IVIG:静脉丙种球蛋白;CTX:环磷酰胺
诊断分析青年女性,起病急,临床表现多系统损害,累及肾脏、心脏、血液系统、皮肤。肾脏最初表现为大量蛋白尿、镜下血尿,SCr高,血压正常,后突发无尿。肾外伴有急性心功能不全,中度贫血、血小板减低,面部红斑、光过敏,ANA、ACL等多种自身抗体阳性,补体减低。患者系统性红斑狼疮(SLE)诊断明确,突出表现为急进性肾功能损害和急性心功能不全,分别对两种疾病的病因进行鉴别诊断。
急进性肾炎综合征 患者肾脏表现为大量蛋白尿、少量镜下血尿,短期内SCr升高且突发无尿,血压正常,抗GBM抗体、ANCA均阴性,无肉眼血尿、高血压,不符合急进性肾炎常见表现。需考虑以下诊断的可能。
脓毒症性AKI 患者病初曾发热、咳嗽,炎症指标升高,CT示两肺散在炎症,提示肺部感染,可加重肾脏损害,但炎症指标及血压水平均不符合脓毒症表现,抗感染后体温恢复正常,感染指标下降、肺部炎症较前吸收,仍突发无尿不支持该诊断。
增殖性狼疮性肾炎青年女性,临床多系统受损伴ANA阳性,补体减低,可明确诊断为SLE,但SLE-DAI不高,无肉眼血尿及明显镜下血尿,外院以甲泼尼龙40 mg/d静脉滴注×3 d后A-dsDNA转阴表明原发病非高度活动,突发无尿亦不支持本病。
血栓性微血管病(TMA) 患者持续贫血、血小板减低,Coomb’s试验阳性,提示自身免疫性溶血性贫血,血压正常,反复查红细胞碎片阴性,内皮指标正常,ADAMTS13抗体阴性、活性正常,均不支持TMA诊断。
抗磷脂抗体综合征肾损害育龄期女性,未婚育,ACL持续阳性,肾脏表现为突发无尿,高度怀疑抗磷脂抗体综合征引起广泛微血栓形成、肾小动脉栓塞、肾皮质缺血坏死。患者查肾脏MRI(2015-06-03)示两侧肾脏体积稍增大,形态在正常范围之内。在T2WI上双肾皮质及肾柱信号减低,皮髓质分解不清,T1反相位示双肾皮质内见多发类圆形低信号区,考虑急性肾皮质坏死(图3),支持抗磷脂抗体综合征肾损害的可能。

图3 肾脏MRI示肾皮质坏死(肾皮质及肾柱信号减低,皮髓分界不清)
急性心功能不全 青年女性,无先天性心脏病史,起病时无胸闷心悸等表现,入院后心脏超声示二尖瓣瓣膜略增厚伴轻度反流,短期迅速进展至二尖瓣重度反流伴心功能不全。对患者心脏损害进行下列鉴别诊断。
病毒性心肌炎患者起病合并呼吸道感染,但入院心脏查体未见明显异常,心电图及心肌损伤标志物正常,超声无心肌损伤证据,心脏病情演变亦不支持本病。
感染性心内膜炎患者起病时有发热、咳嗽,血CRP及PCT均升高,CT提示双肺感染,心脏超声示二尖瓣局部略增厚并轻度返流,需警惕感染性心内膜炎,但患者入院抗感染治疗后体温持续正常,反复血培养均阴性,考虑该诊断可能性较小。
风湿性心瓣膜病患者青年女性,病初曾发热、咳嗽,但病程较短,且无反复链球菌感染扁桃体炎或咽炎病史,监测抗“O”正常,不支持该诊断。
狼疮性心肌病患者SLE诊断明确,由于狼疮性心肌病可无明显临床表现,需心内膜心肌活检或MRI完全排除本病,但本患者瓣膜局部病变重,有别于弥漫心肌损伤、心脏扩大所继发瓣膜关闭不全,考虑本病可能性不大。
Libman-sacks心内膜炎本例患者SLE诊断明确,ACL持续阳性,起病及伴有肺部感染,后合并上呼吸道感染,心脏超声证实二尖瓣局部回声增厚伴钙化、二尖瓣重度返流,心瓣膜病变进展迅速,提示抗心磷脂抗体介导心内膜损害,Libman-sacks心内膜炎、心功能不全诊断成立。本病常见于SLE及抗磷脂抗体综合征,最常见二尖瓣受累,其次为主动脉瓣。疣状赘生物由纤维素、坏死组织、单核细胞等组成,可致瓣膜增厚、狭窄或关闭不全。
最终诊断系统性红斑狼疮伴抗磷脂抗体综合征(累及心脏、肾脏、血液系统、皮肤,SLE-DAI 12分),Libman-sacks心内膜炎,急性心功能不全NYHA Ⅲ级,急性肾皮质坏死,急性肾损伤3期(肾脏替代治疗中),肺部感染。
治疗及随访7月29日行“二尖瓣置换术”,术中见二尖瓣叶边缘增厚,钙化样赘生物附着。术后BNP明显下降(图2),继续普通透析3~4次/周,华法林1.25 mg/d抗凝,尿量渐恢复至1 000 ml/d,监测尿蛋白持续3~3.2 g/24h,少量镜下血尿。8月复查ACL转阴。出院后静滴环磷酰胺共1.6g(0.4 g/月×4次),10月27日尿蛋白降至0.4~1 g/24h。透析间期尿量逐渐增加,BNP持续下降,透前SCr、BUN下降,予下调透析频次。2016年6月尿量增至1 500 ml/d,摆脱透析。2017年8月尿蛋白阴性,Hb 92 g/L,PLT 94×109/L,Alb正常,SCr 320.89 μmol/L,心脏超声LVEF 63%。
讨 论
抗磷脂抗体综合征(APS)是在有抗磷脂抗体(APL)实验室证据的同时,出现静脉或动脉血栓形成或特殊病理妊娠,通常根据病因分为原发性和继发性APS,后者多见于系统性红斑狼疮[1]。APS临床表现包括心瓣膜病、网状青斑、血小板减少、肾动脉狭窄、肾静脉血栓、血栓性微血管病和神经系统损害等,实验室检查结果包括抗心磷脂抗体(ACL)、抗β2GPI抗体、抗磷脂酰丝氨酸抗体等阳性[2]。体内血浆蛋白与磷脂结合后暴露或产生表位,形成针对性抗体APL。APL可直接导致血小板活化、黏附内皮,亦可直接活化血管内皮细胞,致单核细胞与活化血小板结合增加,引起组织因子、趋化因子和生长因子表达,促进血栓形成[3-6]。
目前认为即使存在APL,也需要吸烟、长期制动、妊娠、感染等“二次打击”触发APS[7]。研究表明细菌脂多糖及病毒糖蛋白可模拟内源性β2GPI结构,通过激活TLR-4路径活化免疫系统[8],诱发、加重APS,多个脏器受损后器官间交互作用可致病情恶化。APS治疗主要包括普通肝素、低分子肝素、华法林及阿司匹林,合并SLE者可受益于硫酸羟氯喹。如APL阳性者一周内出现三个及以上器官、系统受累,且至少一个器官经组织学证实存在小血管闭塞,则称为“灾难性”APS,需在抗凝、糖皮质激素基础上行血浆置换和丙种球蛋白治疗[9-10]。
本例患者SLE诊断明确,ACL阳性,起病合并呼吸道细菌感染及病毒感染,内脏损害表现为急性肾皮质坏死及Libman-sacks心内膜炎。推测其在SLE背景下,经感染、炎症等因素“二次打击”后,体内APL激活血管内皮细胞、单核细胞及血小板,形成微血栓,引发血小板减少及心肾损害。SLE心脏瓣膜受累率达60%~74%,ACL阳性者Libman-sacks心内膜炎发生率较ACL阴性患者高3倍,常见直径1~4 mm疣状赘生物形成,呈菜花样或扁平状,多发于瓣膜交界处或边缘[11-12]。 患者多于心脏听诊、超声心动图或尸检中发现,严重瓣膜返流者有呼吸困难、端坐呼吸等心功能不全表现。在血流动力学稳定的前提下,主要采用糖皮质激素和抗凝剂治疗。糖皮质激素能减轻炎症反应,但亦可促进组织纤维化及瘢痕形成[13]。由于血栓风险增加,应长期抗凝预防[14-15],如出现严重瓣膜失功,需及时手术[16]。
心脏和肾脏中一个器官急性或慢性功能障碍可诱发另一器官急性或慢性功能损害的临床综合征称为心肾综合征(cardiorenal syndrome,CRS),Ronco等[17-18]根据可能的心肾交互作用,将CRS分为5种亚型,即Ⅰ型CRS(急性心肾综合征)、Ⅱ型CRS(慢性心肾综合征)、Ⅲ型CRS(急性肾心综合征)、Ⅳ型CRS(慢性肾心综合征)和Ⅴ型CRS(继发性心肾综合征),病程不同阶段可呈不同亚型[19]。
本患者病初ACL致Libman-sacks 心内膜炎及急性肾皮质坏死,急性失代偿性心功能不全加重AKI,AKI亦可引起容量负荷增多,加重心脏负担,造成心功能进一步恶化,但心瓣膜置换术后患者心功能明显改善,提示其发病机制以I型CRS为主,即为血流动力学变化、神经内分泌系统激活及免疫炎症反应介导所致。治疗Ⅰ型CRS首选袢利尿剂,对于失代偿性心力衰竭患者,积极清除体液可改善预后;血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)有助于改善心力衰竭症状;治疗急性失代偿性心力衰竭可考虑血管舒张剂和正性肌力药;血液净化治疗能有效进行液体管理、清除尿毒症毒素、纠正电解质紊乱、改善利尿剂抵抗且避免激活神经内分泌系统[20]。
本例患者确诊为Libman-sacks心内膜炎后,因二尖瓣重度关闭不全导致心功能不全,综合其一般情况及瓣膜病变性质,为避免过度抗凝引起出血,予生物瓣膜进行二尖瓣置换。术后监测BNP水平持续下降,心功能逐渐恢复。随访期间经积极肾脏替代治疗、口服利尿剂及ACEI,伴随心功能改善,肾功能亦有所恢复,尿量逐渐增加正常。随访过程中以环磷酰胺治疗原发病后心肾功能进一步改善。
小结:本例SLE伴抗磷脂抗体综合征患者,在肺部感染等“二次打击”情况下,继发心瓣膜病变、急性肾皮质坏死等危及生命的并发症,导致严重的心脏、肾脏、血液等多个重要脏器功能损害。经过积极的抗感染、肾脏替代、瓣膜置换及免疫抑制治疗,心脏和肾脏功能得以改善。

