食物蛋白诱导性小肠结肠炎综合征:一项基于澳大利亚普通人群的研究,2012-2014
翻译:崔乐,李丽莎 审校:汤蕊 中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科
食物蛋白诱导性小肠结肠炎综合征(FPIES)是一种非IgE介导的过敏性疾病,主要发生在婴幼儿及低龄儿童。既往有关FPIES的研究多数是基于回顾性研究和来自三级医院过敏诊所的、有高度选择性的患者群体。既往研究提示FPIES是一种罕见疾病,但其真正的发病率尚未知晓。
FPIES由摄入新添加的食物蛋白诱发。既往一项澳大利亚的研究指出谷物是最常见的诱因[1],但在美国[2]、以色列[3]和英国[4]的研究中,FPIES的食物诱因主要是牛奶。美国三级医院队列研究数据表明,FPIES常表现为对多种食物过敏[2,5],以及对分类相近的几类食物过敏[6-7],但FPIES的发病率及对多种食物过敏的危险因素尚不明确。
本研究拟探索在澳大利亚人群中急性FPIES的发病率、FPIES患儿的临床和人口学特征、食物诱因是否有分类学相关性并明确对多种食物过敏的FPIES危险因素。
1 方法
1.1 病例来源
从2012年1月至2014年5月,利用澳大利亚儿科监测体系(APSU)[8]收集上报的急性FPIES病例(诊断标准见下文)。将涵盖需要收集的临床资料的月报卡通过电子邮件发送给约1 400名儿科医生(包括普通儿科医生和专科儿科医生),这些医生在卡片上登记他们在上一月中是否接诊了急性FPIES患者。如有患者需要上报,儿科医生需填写一份去个人标识的问卷,包括详细的人口学信息、诊断及临床数据。当月无病例上报的医生需回复“无需上报”。收集上报病例后进行随访观察,根据研究方案确认病例是否符合定义及有无数据缺失。在研究期间,如果FPIES患者对新的食物产生过敏也需记录详情。据估计APSU报告系统中的1 400名儿科医生约占澳大利亚所有注册儿科医生的一半,包括所有的儿科亚专业,以及没有在临床执业的医生。
1.2 病例选择
因为本研究条件下无法逐一通过食物激发试验确诊急性FPIES,一项包含2个步骤的程序被用来筛选可疑的病例,决定是否纳入研究(图1)。
医生使用的APSU病例定义如下:在过去1个月内接诊的(既往没有上报过APSU)所有2岁前首次发病的儿童,符合以下全部由Sicherer等制定的修订版诊断标准[9]:(1)在进食一种新添加的食物蛋白后的4 h以内,出现反复呕吐,同时除外其他可能引起呕吐的原因;(2)发病时不发热(体温38℃以下),无皮肤(荨麻疹和/或血管性水肿)或呼吸道(呼吸困难、喉水肿、声嘶、喘息或持续咳嗽)临床症状;(3)避食过敏的食物后症状缓解。
纳入研究的病例,除了符合上述标准,还需要符合以下次要标准中的至少2项:(1)在进食同样的食物后再次发作反复呕吐;(2)在进食另外一种新添加的食物4 h内出现反复呕吐;(3)低体温(< 36℃);(4)血压下降需要静脉补液;(5)出现嗜睡、倦怠或皮肤苍白;(6)在发病24 h内出现腹泻;(7)曾因该病急诊留观。
采用了这套更严格的次要临床标准,是因为单纯呕吐是儿科常见的临床表现,需要与多种疾病作鉴别诊断,而本研究条件下不可能对上报病例进行口服食物激发试验(OFC)确诊。排除单纯腹泻患者,因为其病因可能是食物不耐受或其他非IgE介导的胃肠道过敏性疾病(如过敏性直结肠炎),除了日本的新生儿队列研究之外,其他研究中单纯表现为腹泻症状的FPIES病例很少见。使用补充的次要诊断标准与近期发布的FPIES国际共识指南符合[10]。
1.3 数据记录和分析
引起患儿发病的食物诱因被记录下来,并按照以下分类进行分析:谷物、牛奶、大豆、鸡蛋、鱼、肉(鸡肉、牛肉、羊肉和猪肉)、蔬菜、水果和其他食物。多种食物过敏性 FPIES 的定义是2 种或 2 种以上的食物类别都可引起 FPIES过敏反应。如果上报病例符合定义但部分数据缺失,则将其中可获得的数据都纳入分析。
1.4 统计
连续变量以均值(标准差)或中位数(四分位数) 描述。Mann-Whitney U 检验用于比较非正态分布的变量。分类变量之间的关联使用χ2检验统计。不同食物诱因之间的配对分析采用McNemar 检验。如果患儿对配对中的一种食物过敏,而对另一种不过敏,则检验是否有证据支持一种食物比另一种更容易引起过敏反应。无论对两种食物都有暴露的患儿以及没有都暴露的患儿均进行前述统计检验。不同诱发食物配对使用phi 相关系数(数值上等同于 Pearson 相关系数)分析其相关性并在网格上绘图。没有进行多重比较检验的调整。所有分析均在 SAS 软件中完成(版本号 9.3;SAS 公司,凯瑞镇,美国北卡罗莱纳州)。根据澳大利亚人口统计局数据获得截至2013 年 6 月(研究中点时间)在上报地点所有年龄在 2 岁以下的婴幼儿总数,再结合上报病例数计算 FPIES每年在 100 000 个新生儿中的发病率。
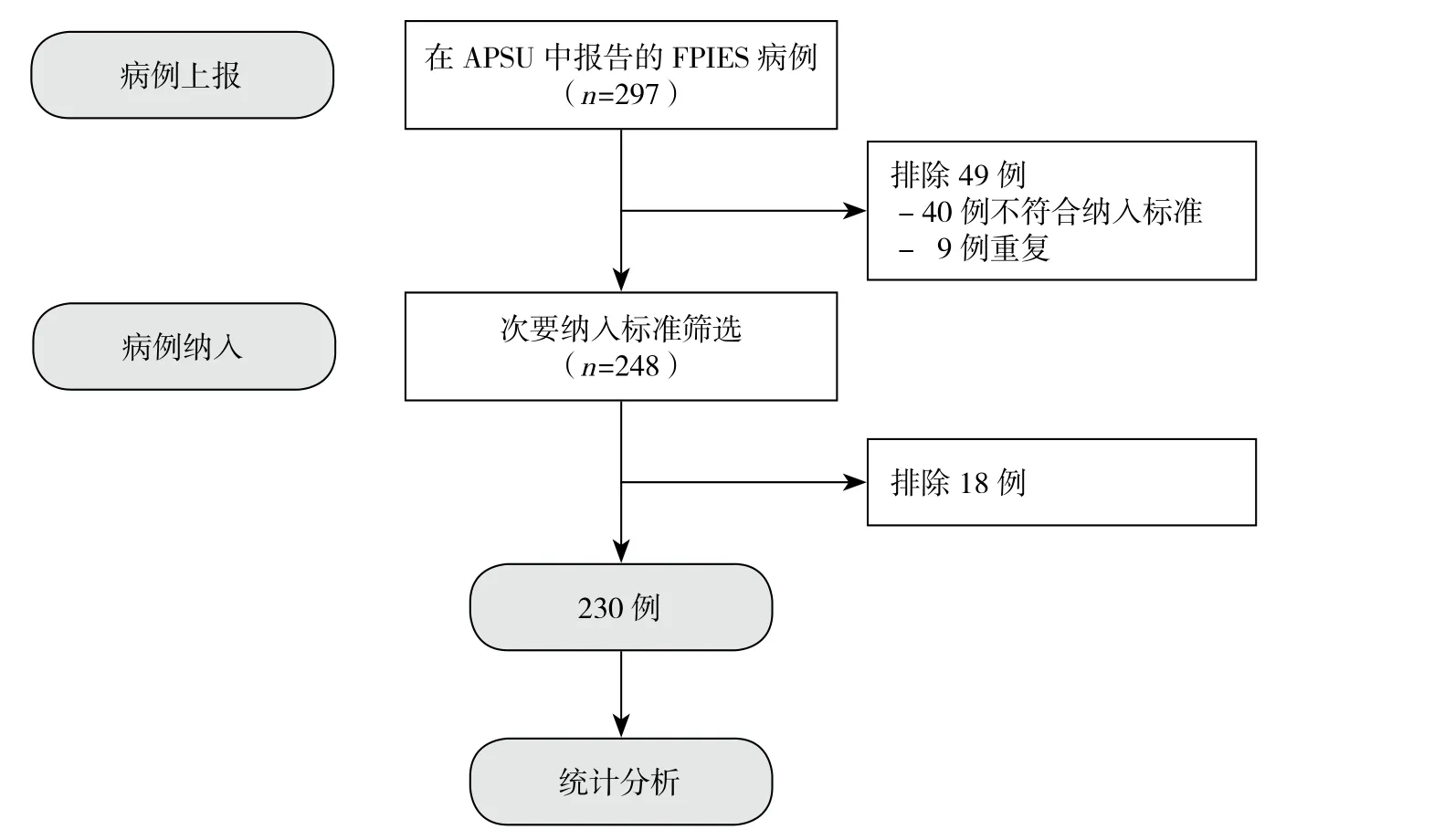
图1 病例纳入和筛选流程图
1.5 伦理批准
该研究已获得悉尼儿童医院人类研究伦理委员会的审核批准。
2 结果
2.1 发病率
在29个月的研究中,共有230例年龄小于2岁的婴幼儿符合急性FPIES的纳入标准,急性FPIES发病率为15.4/(10万·年)。其中169例(73%)由变态反应专业或免疫专业儿科医生通过APSU系统上报,55例(24%)由普通儿科医生上报,6例来自其他医生。根据上报时患者居住的地点进行统计,患儿来自新南威尔士州(n=86),维多利亚州(n=51)、昆士兰州(n=40)、南澳大利亚州(n=24)以及西澳大利亚州(n=28);而澳大利亚首都直辖区、塔斯马尼亚岛、北部地区则没有病例上报。没有病例上报区域的儿科医生数量不及医生总数的5%。各州分别计算的发病率为13~244/(10万·年)。
2.2 人口学特征
队列人群的人口学信息如表1所示。患者上报APSU时的中位年龄是10月龄(四分位数,7~14月龄)。没有明显性别差异。113例患儿同时患有其他过敏性疾病,占49%,其中33例有2种或2种以上过敏性疾病。花生、牛奶、鸡蛋是常见的IgE介导的食物致敏原(n= 23,3例患儿之前有临床表现,12例因为皮肤点刺试验阳性正在忌口相应的食物,8例患者缺少详细信息。有湿疹的FPIES患儿(28/94,占30%;2例数据缺失)比没有湿疹者(9/133,占7%;1例数据缺失)更易并发IgE介导的食物过敏,P< 0.000 1。
2.3 患儿喂养史
230例患儿中210例可获知纯母乳喂养的具体时长(表1)。在纯母乳喂养期间,11例患儿出现FPIES过敏反应,占5%。其中,8例患儿中牛奶是首次发病的食物诱因(2例患儿诱因为谷物,1例为鸡肉);7例患儿随后出现1种以上食物过敏引起的FPIES反应(不一定是通过母乳间接摄取)。但这些可疑的诱发食物无法通过食物激发试验验证。230例婴儿中215例可获知第一次添加固体食物的时间,在这215例婴儿中,有7例(3%)在前4个月添加固体食物(占3%),4~6个月有185例(占86%),7~12个月有9例(占4%),1例超过12个月添加(13例),没有固体食物添加信息占6%。在230例婴儿中有190例记录了首次添加固体食物的种类,大米(152例,占80%)是最常见的固体食物,其次是蔬菜(26例,占14%)和水果(10例,5%)。第一种断奶后添加的食物种类与牛奶或大米诱发FPIES的风险无关(P= 0.71)。配方奶粉引入的中位时间在患有牛奶诱发的FPIES婴儿和不患该病的婴儿分别为3.1和3.8个月(P= 0.97)。部分不患该病婴儿的数据不完整,故未纳入统计。
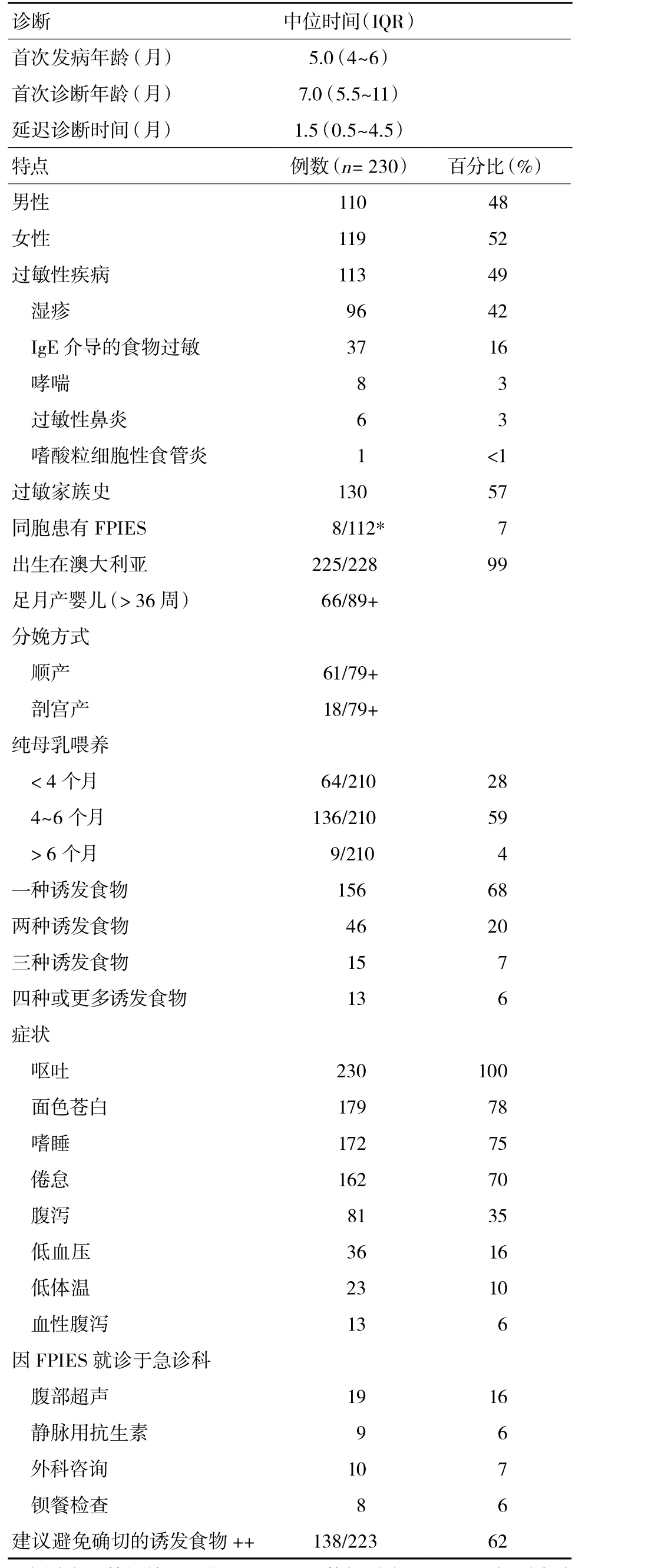
表1 FPIES患儿人口基线特征
2.4 家族史
112例患儿有同胞兄弟姐妹,其中8例(7%)婴儿的同胞有FPIES表现,占7%(但未进一步明确)。相比全部2岁以下FPIES的发病率为15 .4 / (10万·年),FPIES患儿同胞的发病率增至16.4 / (10万·年)。
57%患儿的一级亲属有过敏性疾病(哮喘、湿疹、变态性鼻炎或IgE介导的食物过敏),其中包括97例(42%)儿童的母亲、71例(31%)儿童的父亲和43例儿童的同胞兄弟姐妹(占有同胞儿童38%)。同胞中患有FPIES的婴儿其过敏性疾病家族史者更显著(8/8,100%,P= 0.03)。
2.5 FPIES特点
因为部分患儿对1种以上的食物有反应,230例患儿一共报告了350例次FPIES过敏,涉及40类不同的食物。
2.5.1 首次发病和诊断时间:患儿首次发病中位年龄为5.0个月(IQR,4~6个月),明确诊断年龄为7个月(IQR,5.5~11个月),延迟诊断中位时间为1.5个月(IQR,0.5~4.5个月;)(表1)。在确诊之前患儿会反复发病(表2)。在出现FPIES症状后就诊的患儿中,57例在第一次发病就得到正确诊断,占25%;99例经过2次发病得到正确诊断,占44%;68例在3次或更多次发病以后才得到正确诊断,占30%。
2.5.2 首次 FPIES 发病前的暴露次数:并非所有FPIES患儿在第一次摄入相应食物就出现症状,350例患儿中311例记录了在第几次摄入该食物时出现不适。185例在第一次摄入该食物时即出现不适,占51%;45例在第2次摄入该食物出现不适,占14%;33例在第3次出现不适,占11%;75例在第4次或更多次摄入该食物出现不适,占24%(表2)。与其他食物相比,对鱼有反应的婴儿更易在首次摄入鱼时即出现反应(P= 0.026)。
2.5.3 症状:从进食到出现症状的中位时间为2 h(IQR,1.5~2.5 h),进食不同的食物出现症状的时间基本一致(表2)。表1总结了儿童FPIES临床特点,所有病例都有剧烈呕吐,其次是面色苍白(78%)、嗜睡(75%)、倦怠(70%)、腹泻(35%)、血性腹泻(6%)、低血压(16%)和低体温(10%)。
2.5.4 诱发 FPIES 食物:
2.5.4.1 单种食物。最常见的诱发食物是大米(45%),其次是牛奶(33%)、鸡蛋(12%)、燕麦(9%)和鸡肉(8%);(表2)。230例婴儿中有156例只有1种诱发食物,占68%;46例有2种诱发食物,占20%;15例(7%)有3种诱发食物,占7%;8例有4种诱发食物,占3%;5例有5种或以上的诱发食物,占3%(表2)。
2.5.4.2 食物类别。从食物类别的角度,谷物是最常见的诱发食物(52%),其次是奶制品(33%)、蛋类(12%)、肉类(10%)、水果(10%)、蔬菜(8%)、大豆(7%)、鱼类(5%)和其他(3%)。73%(n= 5 168)的婴儿对1类食物有反应,27%(n= 62)的患儿对2类或更多类食物有反应。
2.5.4.3 加热食物后的影响。5例鸡蛋诱发的FPIES婴儿中有4例对烘烤的鸡蛋仍有反应。12例牛奶诱发的FPIES儿童摄入烤乳后不再出现症状。
2.5.4.4 诱发食物致敏原检测。152例患儿进行了皮肤点刺试验,涉及224种诱发食物。211例(94%)皮肤点刺试验小于3 mm,7例为3~4 mm,6例为5 mm以上。相比较而言,鸡蛋诱发的FPIES婴儿更可能出现3 mm或更大的皮肤点刺试验风团(28%),其他食物诱发的FPIES的SPT阳性率为3%(P< 0.000 1)。25例鸡蛋诱发的FPIES婴儿中7例皮肤点刺试验风团3 mm或以上,49例牛奶诱发的FPIES婴儿中4例皮肤点刺试验阳性(4/49,8%),78例谷物诱发的FPIES婴儿中1例皮肤点刺试验阳性。有2例患儿进行了食物血清特异性IgE检测,结果均为阴性。
2.5.4.5 对多类食物有反应的 FPIES 相关影响因素。对多类食物有反应的FPIES婴儿比仅对一类食物有反应的FPIES婴儿的首次发病年龄小(中位数为5.0和5.5个月;OR 0.84/月,95%CI:0.74~0.95,P= 0.0049)。考虑到受访者可能因为年龄较小尚未对多类食物出现FPIES反应,因此对受访者的年龄进行了调整,结果仍有显著性。
对多种食物有反应的FPIES婴儿中纯母乳喂养不足4个月的比例高于单一食物组(分别为20%和11%,P= 0.06)。对水果或蔬菜有反应的FPIES婴儿出现对多类食物有反应的比例更高(分别为66%和21%,P< 0.000 1)。
性别、分娩方式、个人或家族过敏史、同胞FPIES病史、添加固体食物的年龄以及诱发食物的皮肤点刺试验结果,在多种食物组和单一食物组之间没有显著差异。
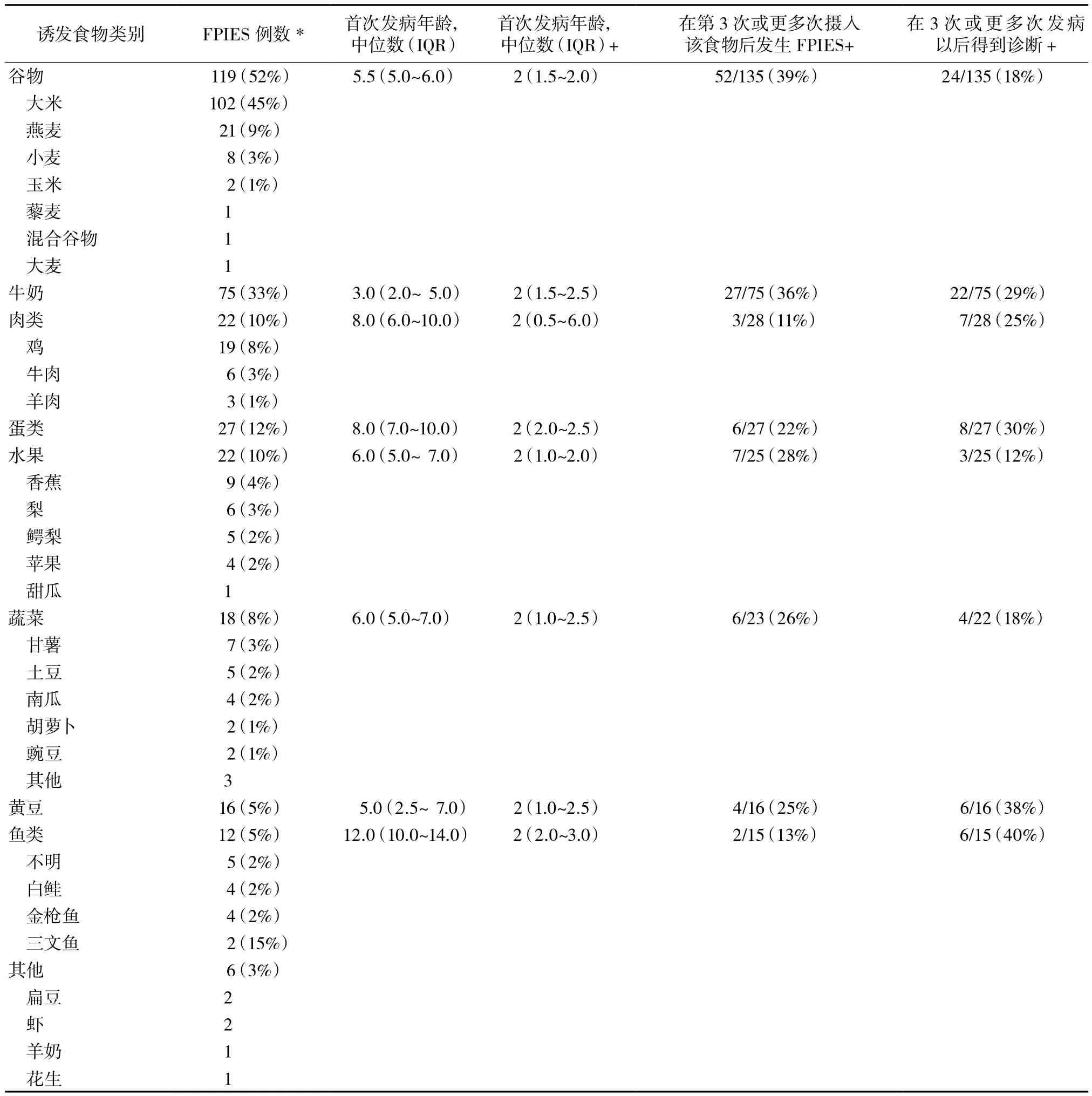
表2 FPIES的诱发食物
2.5.4.6 诱发食物类别之间的关联。通过McNemar检验判断不同食物类别之间的关联。通过phi系数并对整个数据集进行检验发现,牛奶-大豆、鸡蛋-坚果、鱼类-肉类和水果-蔬菜组合(图2)存在弱相关性。
通过使用McNemar检验和成对比较,谷物诱发的FPIES婴儿更可能对水果或蔬菜出现反应(P< 0.001)。在28例明确对两种食物都有反应的婴儿中,牛奶-大豆之间存在弱相关性(P= 0.035),其余,即肉类-鱼类(P= 0.059)、牛奶-谷物(P= 0.066)、大米-燕麦(P= 0.3)、鸡蛋-肉类(P= 0.46)、水果-蔬菜(P= 0.41)、鱼-贝类(P= 1.0)和香蕉-鳄梨(P= 0.65)未见显著相关性。
2.5.4.7 单种诱发食物之间的关联。在大米诱发的FPIES婴儿中,有26例摄入燕麦,其中11例并发燕麦诱发的FPIES,同样3/32并发玉米诱发的FPIES,2/40并发小麦诱发的FPIES。
在牛奶诱发的FPIES婴儿中,有25例摄入氨基酸奶粉,其中1例对氨基酸奶粉有反应,同样6/28对深度水解奶粉有反应,7/10对部分水解奶粉有反应,5/5对无乳糖牛奶有反应,8/17对大豆有反应。
在75例牛奶诱发的FPIES婴儿中,33例并发至少1类其他食物诱发的FPIES,其中包括22例谷物、12例大豆、6例蔬菜、4例水果、3例肉类、2例鸡蛋和1例鱼类。12例鱼类诱发的FPIES婴儿中5例对其他食物类别有反应,其中包括4例谷物、3例肉类和1例牛奶。

图2 62例对多种食物有反应FPIES儿童进行诱发食物的聚类分析
2.6 就诊情况
在230例FPIES婴儿中,91例(40%)从未就诊过急诊,86例(37%)就诊过急诊1次,36例(16%)就诊过2次,10例(4%)就诊过至少3次(7人无数据)。在132例就诊过急诊至少1次的儿童中,只有少部分进行了相应的医疗检查(表1)。
2.7 儿科医生的建议
138例婴儿的家长得到建议避免摄入确切的诱发食物,85例得到建议避免其他食物(7例缺少数据)。患者是否获得正确的饮食指导、对多种食物还是单一食物有反应、是否就诊于急诊、静脉输液以及低体温与就诊科室(变态反应科和儿科)无关。
在128例母乳喂养的FPIES婴儿中,30例患儿的母亲得到建议避免母亲在饮食中摄入确切的诱发食物,3例患儿的母亲得到建议避免诱发食物和其他食物。230例婴儿中130例(57%)获得了书面的FPIES紧急情况处理计划。
3 讨论
FPIES的确切发病率目前尚不清楚。Katz等[3]单中心大样本出生队列研究是目前唯一报道FPIES发病率的研究。该研究只调查了牛奶诱发的FPIES,2年的累计发病率为0.34%。在三级医院过敏诊所中FPIES占过敏性疾病约1%[5-6,11]。迄今尚无大样本量的全国性研究报道。本研究以澳大利亚普通人群为基础,报道了2岁以下婴儿FPIES发病率为15.4/(10万·年)。澳大利亚大多数州的发病率基本一致,每年每10万人中有13~24例不等,除了人口稀少或未上报的地区以外。本研究的优势在于更广泛的人口覆盖率和使用更严格的FPIES定义,鉴于呕吐是一种常见的儿科疾病,并且流行病学调查难以通过激发试验诊断FPIES。因此本研究使用主要和次要两套纳入标准使得对FPIES的诊断更加严格[7,10]。APSU系统可能存在上报不足的情况,因此真实的发病率可能更高。报告偏低的原因包括:就诊于初级保健医生而不是儿科/变态反应专科医生(特别是症状较轻的患者)、非强制性报告、APSU监测系统没有覆盖所有儿科/变态反应专科医生、患儿家长缺乏医疗保健专业人员指导。本研究中症状较轻的FPIES报告偏低,以色列报道的牛奶诱发的FPIES累积患病率较高,并显著高于本次调查中的总体FPIES发病率[3]。可能的原因是症状较轻的FPIES婴儿在APSU队列中没有引起足够的重视,但被纳入在以色列单中心出生队列研究中。
以往的队列研究几乎都来自过敏诊所,已有报道的FPIES临床特点包括:常见的诱发食物类型、起病时间、临床症状以及FPIES的相关危险因素(由Leonard和Nowak-Wegrzyn总结[7])。虽然本研究和其他研究关于FPIES的诊断和纳入标准不同,但依然可以进行一些有意义的比较。
不同地区报道导致FPIES的食物种类有显著差异。本研究发现大米是澳大利亚FPIES婴儿最常见的原因[12-13],45%的婴儿对大米有反应。这与美国[2,5]、英国[4]、意大利[11]和西班牙[14]有显著不同。在这些国家,FPIES以牛奶为主,大米仅占4%到23%。尽管澳大利亚和英国在婴儿的喂养方式上类似,两国普遍选择大米作为第一个断奶后添加的食品[15],但英国对大米的报告率更低(占所有诱发食物的4%)[4]。美国对大米的报告率(19%到23%)大约是澳大利亚的一半[5]。造成这种差异的原因尚不清楚。在本研究中,作为第一个断奶后添加的食品,无论大米还是牛奶都不是FPIES发病的的相关危险因素。
我们发现近些年在澳大利亚报道的大豆诱发的FPIES比例下降为7%,而美国为41%[2],既往在澳大利亚的研究中大豆诱发的FPIES比例为34%(1992-2007年)[12]和13%(2008-2012年)[13],可能与澳大利亚近些年使用大豆配方奶粉逐渐减少,美国大豆配方奶粉仍然比较普遍有关[16-17]。本研究中有5%的婴儿在母乳喂养过程中对某种致敏原出现了FPIES反应。虽然不能通过问卷调查证实这些病例确实是由母乳中的食物蛋白引起的,但还是提示通过母乳途径可以发生FPIES[11,18-19],母乳中的食物蛋白更可易诱发非IgE介导的食物反应,而非IgE介导的食物反应。尽管FPIES在纯母乳喂养中只占5%,约1/4的母乳喂养母亲被建议在他们的饮食中避免致敏原。
本研究中约2/3的患儿由一种食物诱发FPIES,73%对一类食物有反应,这与美国[2]和英国[4]的一些报道一致,但低于既往澳大利亚的66%~84%、意大利的85%、西班牙的94%和美国的一些其他报告[5]。我们试图分析可能与多种食物过敏的FPIES有关的危险因素或预测因素。FPIES的首次发病年龄较小及对水果/蔬菜有反应与FPIES对多种食物不耐受有相关性。此外,纯母乳喂养时间不足4个月与FPIES对多种食物不耐受相关。在其他研究中,FPIES的纯母乳喂养时间与普通人群相似(美国)[5]或更高(意大利)[11],但是到目前为止,有关母乳喂养时间和对多种食物诱发的FPIES是否存在相关性还不确定。鉴于目前尚存在争议,未来还需要在以人群为基础的大样本量研究中进一步验证。
本研究还对诱发FPIES的食物进行了聚类分析,该信息可能对以激发试验为基础的研究以及协助患者避免诱发食物或进行开放食物激发试验有提示作用。既往研究表明,牛奶-大豆[2,5]和大米-燕麦[1]可能存在协同作用。由于横断面调查的局限性以及无法获取FPIES婴儿所有可能的诱发食物,因此不同食物之间的关联可能被低估。尽管有这些限制,我们发现谷物与水果或蔬菜存在很强的相关性。牛奶诱发的FPIES婴儿中摄入豆奶的比例相对较低,因为样本量小的原因可能导致潜在的关联未得到显示。然而,主成分分析表明,水果-蔬菜、大豆-牛奶、鸡蛋-坚果、鱼类-肉类这些组合存在关联。因此,对于水果或蔬菜诱发的FPIES婴儿,尽管此前其并未进食过谷物,亦有可能对谷物有反应,必要时需要接受开放食物激发试验。
既往的研究显示,婴幼儿较少对固体食物和牛奶都有反应[3,20]。然而,本研究发现在33例同时对牛奶和至少其他1种食物有反应的FPIES婴儿中,有22例对谷物有反应,其他还包括水果、蔬菜、肉类、蛋类和鱼类。鱼类诱发的FPIES被认为很少会并发其他有反应的食物或只与一些海产品有关[21-22]。然而,本研究表明42%的鱼类诱发的FPIES婴儿对谷物、肉类或牛奶也有反应。
有病例报道鸡蛋或牛奶诱发的FPIES儿童可以耐受加热后的该类食品[23]。本研究发现牛奶诱发的FPIES婴儿对烤制后的乳制品可以耐受,而鸡蛋诱发的FPIES婴儿对加热后的蛋类耐受较少。然而,我们尚不清楚这些孩子可以耐受哪些烘焙食品,并且这些数据在解释时要特别慎重,因为本研究中可提供对烘烤后的食品耐受的人数较少。
本研究报道了进食后出现症状的中位时间为2 h,症状的类型、频率以及患者的年龄,结论与既往的研究一致[3,5,7,11]。有一半以上的婴儿在第一次口服摄入某种食物后就出现反应,提示此前可能通过其他途径致敏,如经过皮肤或母乳或IgE介导的食物过敏的途径。本研究首次发现在第一次出现鱼类诱发的FPIES前,其之前经历可以耐受的暴露较少。与既往研究类似,FPIES婴儿常常有过敏家庭和个人过敏史[2,11]。FPIES患者如果并发湿疹会增加IgE介导的食物过敏的风险(经由儿科医生诊断)。FPIES患者的同胞患有FPIES风险亦显着增加,这与既往的研究一致。FPIES从发病到得到诊断的时间差(中位时间1.5个月)低于既往在澳大利亚的研究报道[7],这可能与儿科医生对FPIES的认识水平提高有关,尤其是那些参与APSU的儿科医生,他们在研究中获得了很多包括FPIES在内的疾病研究计划[8]。只有一半的FPIES患儿家长获得了用于指导再次发病的应对办法的书面管理计划。
APSU已被用于调查和报告澳大利亚20年来的多种儿科疾病的发病率[24-26],该研究符合疾病预防控制中心的疾病监测标准[8]。APSU方法的缺陷是并非所有的澳大利亚儿科医生都能收到或返回报告卡,也不是所有的FPIES婴儿都经过儿科或变态反应医生的诊疗,因此可能会有病例被遗漏。据估计,约有一半的澳大利亚儿科医生参与APSU。横断面调查的优势在于能够采集具有代表性的样本,而不仅仅是那些就诊于过敏诊所的个体,这能够在一定程度上克服由于疾病严重程度、社会经济水平或医疗服务水平而对研究造成的偏倚。但横断面调查固有的特点也决定了对疾病的持续时间和自然病程不能被充分展现。在研究期间,APSU的答复率约为平均每月90%,共来自约1 400名儿科医师[24]。
参考文献请见原文:
J Allergy Clin Immunol, 2017, 140(5): 1323-1330.

