食物过敏治疗
翻译:王子熹 审校:王良录 中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科
IgE介导的食物过敏是一个全球性的健康问题,影响了数以百万计患者日常生活的方方面面[1-2]。美国食物过敏患者约1 500万,包括590万18岁以下儿童及青少年,流行病学研究结果显示近20年食物过敏的患病率不断升高[2]。
由于基因和环境因素,导致某些人群易患特应性疾病,其口服免疫耐受机制受损和/或形成迟缓,可导致食物过敏[3-4]。虽然有报道很多种食物可引起过敏反应,但在美国,牛奶、鸡蛋及花生是最常见的3种食物变应原[1]。随着食物过敏患病率的不断升高,人们越来越迫切地希望能找到治疗乃至根治方法。
目前推荐的食物过敏治疗方法仍是严格禁食[5]。一旦误食需要使用肾上腺素自动注射器,使患者及家人感到焦虑、成为严重的心理负担[6]。因此患者及家人的生活质量会受到极大影响[7]。
正确理解临床脱敏、持续性无应答(SU;缓解)及口服耐受的定义,对于评估食物过敏新的治疗方法十分重要(表1)[8]。脱敏是指在治疗期间对食物变应原反应阈值的升高,这意味着对可能发生的误食起到了保护作用。经过数月的治疗

表1 临床脱敏、持续性无应答、缓解及口服耐受的定义
通常能达到脱敏,但需要强调的是,脱敏状态仅在治疗期间方能维持。SU则是指在治疗结束后的一段时间内,食物变应原不引起临床应答。目前认为,需要持续接触一定量的变应原才能维持这种无应答状态。而且只有经过数年的治疗,只有部分患者能达到SU。当然,免疫治疗后反应性逐渐消失并非食物过敏所独有,气传环境变应原以及昆虫叮咬免疫治疗亦是如此。因此,将这种治疗后暂时的无应答状态称为“缓解期”更合适一些,就如同自身免疫性疾病经治疗后缓解一样。口服耐受指进食食物变应原后完全不诱发临床症状,典型例子为自然缓解;这种临床耐受状态无需依靠持续食物变应原暴露维持[3-4]。到目前为止,对于食物过敏,尚无临床研究能够证实经免疫治疗后能够出现真正的免疫学和临床耐受。这一点对于理解食物变应原免疫治疗的临床疗效和未来潜在的前景非常重要。现在人们正在研究数种不同类型的免疫治疗,包括口服免疫治疗(OIT)、舌下免疫治疗(SLIT)以及经皮免疫治疗(EPIT)用于治疗食物过敏(图1)。
1 OIT
作为食物过敏的治疗方法之一,OIT已经有10余年的历史。人们已经对多种食物变应原进行了研究,但大多数随机对照临床试验针对花生、牛奶和鸡蛋[9-21]。这类免疫治疗需要每日进食变应原粉剂(如包含花生蛋白、脂质及碳水化合物的粉剂),与其他食物共同进食。OIT是依靠逐渐增加过敏食物的摄入量,以期慢慢诱导患者逐渐达到脱敏或SU状态。目前推测,免疫治疗的机制同免疫应答调节相关,包括变应原特异性IgE向IgG4转变、嗜碱性粒细胞活化的减少以及调节性T细胞数量的增多等[22-25]。在目前的所有治疗方案中,OIT的临床疗效最佳,免疫学指标改变最显著,患者可以达到脱敏状态,甚至部分患者出现SU,免疫调节作用显著。
1.1 花生 OIT

图1 食物免疫治疗标准流程,包括初始剂量、剂量递增阶段以及维持期治疗本图根据Wood文章修改而成[18]
2009年美国的一项研究首次报道了花生OIT(表2)[9-10,15-17,26-28]。在关于花生过敏的一项早期OIT研究中[26],患儿的OIT的流程包括首日快速增量、剂量递增和维持阶段,最后通过口服食物激发试验(OFCs)检测脱敏效果[26]。29例完成上述流程的受试者中,有27例经治疗后可进食3900 mg花生蛋白(相当于约16粒花生)。治疗组患者皮肤点刺试验反应强度、花生特异性IgE水平以及嗜碱性粒细胞活化水平明显下降,而花生特异性IgG4水平明显升高。
一项关于花生OIT的随机对照研究共纳入了28例1~16岁的受试者[15],治疗组16例患儿均可耐受5 000 mg花生蛋白(大约20粒花生),而安慰剂组无人能达到。治疗组受试者皮肤点刺试验反应强度明显下降,IL-5及IL-13水平明显降低,花生特异性IgG4水平明显升高,但进行OFC(评估耐受性)时花生特异性IgE水平并无明显变化。
口服花生诱导耐受研究( Study of induction of Tolerance to Oral Peanut,STOP)II期临床试验是一项针对7~16岁儿童的随机对照交叉临床试验[9],有62%的受试者达到了主要研究终点,即脱敏状态(定义为可耐受1 400 mg花生蛋白)。
虽然已明确,通过OIT可以达到脱敏状态,但还有一个重要的问题,即中断OIT后患者是否能长时间保持对花生蛋白的SU状态。另一项试验研究了能够达到SU患者的特征,该研究24例受试者中12例中断OIT1个月后,经5000 mg OFC验证达到SU[17],与未达到SU患者相比,这些SU患者在基线和最终OFC时皮肤点刺试验反应均较弱,花生、Ara h1及Ara h2特异性IgE水平以及花生特异性IgE/总IgE比值均较低,而两组患者的花生特异性IgG4水平则未见明显差异。对SU患者未限制饮食,允许进食花生。
更近的一项研究观察了花生过敏患者进行早期OIT的安全性、有效性及可行性[16],对照组为相匹配的154例接受标准治疗受试者,总体上中位治疗时间为29个月,意向性治疗分析法结果显示37例受试者中29例(78%)达到SU(持续4个周),符合方案分析法显示32例受试者中29例(91%)达到SU。该研究中儿童受试者经早期OIT后花生特异性IgE水平明显下降,能够正常进食花生的患者比例是对照组的19倍,而对照组花生特异性IgE水平则明显升高。
1.2 花生OIT联合佐剂
一项随机双盲安慰剂对照研究使用细菌佐剂与花生OIT进行联合治疗[29],对1~10岁患儿进行花生OIT的同时给予益生菌乳杆菌。经维持阶段治疗(剂量为2 g花生)后,89%的患者可通过剂量为4 g的OFC而达到脱敏状态。治疗结束后,治疗组28例患者中23例(82.1%)、安慰剂组28例患者中1例达到疑似SU,持续时间仅2至5周。该研究的局限性主要在于缺乏单纯OIT组,难以显示出益生菌的疗效,且仅中断OIT很短的时间就复查了激发试验。但患者父母对这类治疗的接受程度较高[30]。
1.3 鸡蛋 OIT
关于鸡蛋OIT的更详尽信息,见表3[11-12,31-32]。在一项早期的鸡蛋OIT随机研究中40例儿童进行了鸡蛋OIT,维持剂量为2 g,疗程达10个月时有55%的患儿可通过5 g蛋清粉OFC,疗程达22个月时有75%的患儿可通过10 g蛋清粉OFC。在可通过10 g OFC的脱敏患儿中,28%在8周后仍维持SU。这些SU患儿通过10 g OFC1 h后进食了一整个熟鸡蛋。4年后对这部分患者进行随访,发现仍有50%的患儿能够维持SU[12]。
另一项随机对照研究对患儿进行为期4个月的脱敏治疗,维持期剂量为4 g蛋清粉,之后禁食鸡蛋,确定能否达到SU[19]。结果显示达到脱敏的患儿共16例,年龄4~11岁,其中31%在禁食3个月后仍维持SU。此后这些受试者可规律进食熟鸡蛋。
1.4 牛奶 OIT
关于牛奶OIT的更详尽信息见表4[14,20-21,34-38]。近期一项牛奶OIT研究将60例患儿随机分组,入院后完成快速剂量递增,之后最高维持剂量为每日150 ml牛奶。一年后,治疗组有36%的患儿可以耐受150 ml牛奶,而对照组为0%[20]。
另一项牛奶OIT队列研究纳入了60例24~36个月的患儿,其中30例进行牛奶OIT治疗。结果显示治疗组有90%的患儿达到了脱敏状态,而安慰剂组只有23%[34]。
一项随机双盲安慰剂对照研究表明,OIT组可耐受的脱脂干奶粉累积剂量中位数(5 140 mg)明显高于安慰剂组(40 mg)[14],治疗组的牛奶IgG4水平明显升高。这项研究中治疗组出现过敏反应的比例较高,且存在需要使用肾上腺素的情况。
1.5 多种食物混合OIT
一些儿童仅对一种食物过敏,而其他人可能对多种食物过敏。一项小型I期临床试验显示,多种食物混合OIT的安全性同单一食物免疫治疗相近[39]。该研究对25例多种食物过敏受试者进行多种食物混合OIT,对15例单纯花生过敏患者进行花生单一OIT,每种食物的剂量为4 000 mg,结果发现两组不良反应发生率相似,分别为3.3%和3.7%,且绝大多数为轻度不良反应。两组最终达到相同目标剂量的患者人数比例相似,多种食物混合OIT组达到相目标剂量所需时间更长,其原因与试验设计有关,且并非主要终点。
1.6 OIT联合Anti-IgE治疗
一项前驱研究对花生过敏患者给予奥马珠单抗(omalizumab)辅助进行快速OIT[40]。该研究虽未设安慰剂组,但初始结果令人振奋,13例患者中12例只需数周即完成快速OIT。这些治疗成功者最终可耐受4 g花生粉,达标中位时间为8周。对多种食物过敏的患儿使用奥马珠单抗辅助OIT,25例受试者中19例可达到脱敏状态长达16周[41]。还有人研究了联合奥马珠单抗进行牛奶快速OIT疗法,发现11例患者中9例在1 d内即快速脱敏,耐受1 000 mg,1例受试者因腹痛而退出治疗,另1例则需使用肾上腺素[42]。
另一项关于牛奶OIT的双盲、安慰剂对照研究显示,受试者随机给予奥马珠单抗或安慰剂4个月后,开始进行开放标记牛奶OIT,用22~40周递增剂量至维持阶段,之后每日给予维持剂量至28个月[35]。在第28个月停用奥马珠单抗,对受试者进行OFC,通过者再进行8周OIT,之后停止OIT,在第32个月时再次行激发试验以评估是否达到SU。共随机纳入了57例受试者(年龄7~32 岁),在第28个月,24例(89%)奥马珠单抗组受试者及20例(71%)安慰剂组受试者通过了10 gOFC达到脱敏。在第32个月,奥马珠单抗组及安慰剂组达到SU的比例分别为48%和36%,并无统计学显著差异。
另一项近期研究共纳入了37例受试者,随机分为奥马珠单抗组(n= 29)和安慰剂组(n= 8)[43]。经过12周治疗后,受试者进行首日快速增量,花生蛋白剂量达250 mg,之后每周递增剂量至2 000 mg。此后停用奥马珠单抗,继续维持2 000 mg花生蛋白。12周后受试者接受4 000 mg花生蛋白开放激发试验。结果显示,停药6周时奥马珠单抗组29例受试者中23例(79%)可耐受2 000 mg花生蛋白,而安慰剂组8例受试者中仅有1例(12%)可耐受(P< 0.01)。随后的4 000 mg食物激发试验结果相同(奥马珠单抗组29例,安慰剂组1例)。
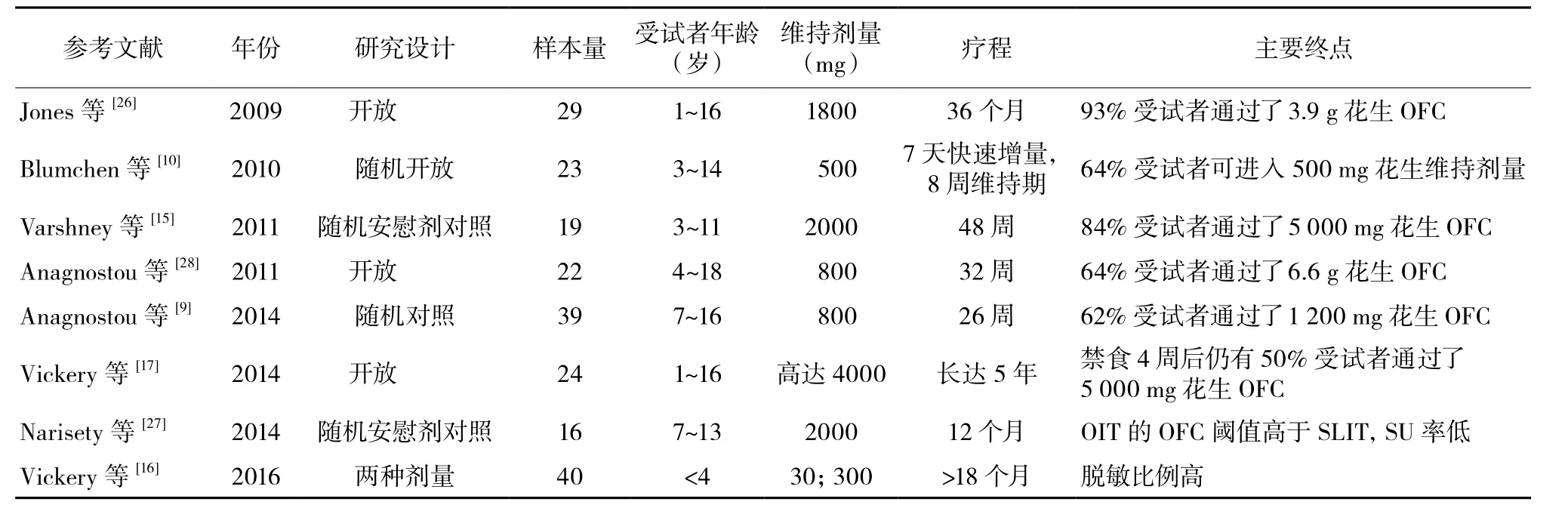
表2 花生OIT研究
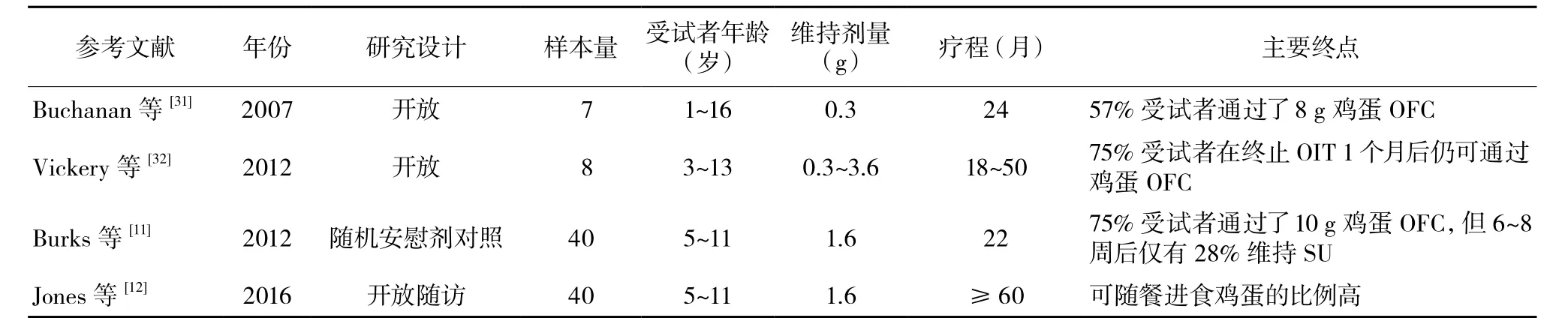
表3 鸡蛋OIT研究

表4 牛奶OIT研究
各研究给药方案并不相同,有些研究在开始OIT前2~4个月给予奥马珠单抗,有些研究在OIT全程持续给药。给予奥马珠单抗的受试者在OIT剂量递增期间出现给药相关不良反应的发生率明显下降,需要药物治疗的剂量相关不良反应的发生率降低,且更早达到维持阶段。
在不同研究中,OIT剂量递增频率以及anti-IgE给药次数各不相同。但总体来说,anti-IgE联合OIT可以使得递增剂量过程明显加快,不良反应更少。但对于OIT的最终目标,即脱敏和SU,联合anti-IgE治疗并未显出明显改善。
1.7 OIT的安全性
相比起其他类型的免疫治疗,OIT更易出现不良反应,包括给药后诱发严重过敏反应,临床试验受试者中出现剂量相关胃肠道不良反应者约20%,出现嗜酸细胞性食管炎的受试者低于5%[44-46]。为了保证给药安全,常因病毒感染、运动及月经等调整给药剂量[10,47]。季节性变态反应会令OIT安全性问题更加复杂,并影响OIT的临床疗效[48]。一项涵盖了395例患者回顾性研究发现,在总共240 351次给药中有95次因严重反应需要使用肾上腺素[49]。该研究中298例(85%)患者可以达到维持剂量。总之,由于重度过敏反应和胃肠道症状的发生频率很高,这已经成为限制OIT应用的因素,在讨论OIT是否做为治疗选项时必须加以考虑。
综上所述,绝大部分研究结果显示OIT可使患者达到脱敏状态,部分患者可短期(数周至数月)达到SU,但如不持续进食过敏原,则无法长期维持(数月至数年)SU。对于患者及其家人来说,如何平衡OIT的过敏性不良反应及临床获益,决策应非常的个体化。
2 SLIT
目前已有一些临床试验评估了SLIT(表5)对于花生和其他几种食物变应原的疗效[36,50-53]。该疗法需要在治疗期间每日舌下给予变应原提取物(舌下含2~3 min后吞咽)。SLIT可以诱导临床脱敏及中度免疫学指标改变[50-51,54-56],耐受性好,不良反应轻,通常仅出现口咽部痒及刺痛。一项早期随机对照研究,对花生过敏患者进行了44周SLIT后进行疗效评估,20例受试者中14例(70%)可以进食5 g花生粉,或OFC阈值较初始升高至少10倍,而安慰剂组仅15%达到了上述目标[52]。
一项回顾性研究,对花生过敏儿童接受SLIT与OIT疗效进行了对比,OIT组患儿的花生特异性IgE及IgG4水平变化更加显著[57]。该组患儿能够通过OFC证实达到脱敏的概率是SLIT组的3倍。
另一项前瞻性随机对照研究对花生SLIT与OIT疗效进行比较,发现两组食物激发试验阈值均有所升高,但OIT组升高幅度更大[27]。具体而言,OIT治疗组最大耐受剂量可提高141倍,而SLIT组为22倍。此外,OIT组的皮试结果、花生特异性IgE及IgG4水平均变化更显著。然而,无论OIT组还是SLIT组受试者,禁食4周后均仅有少数人可达到SU。
一项大规模多中心、随机双盲、安慰剂对照研究显示SLIT安全性良好[51]。98%例次以上的给药耐受良好,除了口咽部不适以外无不良反应,无需使用肾上腺素。此外也出现了预期的免疫学指标改变,表现为花生特异性嗜碱性粒细胞活化试验及皮肤点刺试验结果均较前反应减弱。
关于牛奶SLIT,一项早期研究显示,8例患者接受了6个月的SLIT,脱敏比例达70%,其中4例受试者最后可正常进食牛奶[53]。一项随机对照研究中30例儿童分别接受了SLIT、SLIT序贯低或高剂量OIT[36],受试者在维持治疗12和60周时分别进行了8 g牛奶蛋白激发试验,最终通过食物激发试验的受试者数量为:单纯SLIT组10例受试者中仅1例通过,而SLIT序贯低剂量OIT组10例中6例通过,SLIT序贯高剂量OIT组10例中有8例通过。这种脱敏状态并不持久,15例脱敏患者中有6例再次出现过敏反应。这6例患者中,2例仅在1周后即再次出现反应。总体上看,联合OIT可诱导更多患者达到脱敏状态 ,但同时全身反应发生率也更高。
总的来说,SLIT能诱导一定程度的脱敏,但很少能达到SU,而在有限的几项研究中发现,SLIT序贯以OIT会使OIT的不良反应谱明显改变。此外,SLIT的变应性不良反应主要局限于口咽部,极少出现全身反应。
3 EPIT
目前关于EPIT的研究主要是用于治疗花生和牛奶过敏,将一小块变应原斑贴剂贴在背部或上臂,每24小时更换一贴,持续数年[33,58-59]。花生过敏者治疗后,年幼患者初步达到临床脱敏状态,但仅引起轻度免疫学指标改变[33]。EPIT耐受性良好,大多数受试者仅会在斑贴位置出现轻度局部皮肤刺激症状[33,58]。
一项EPIT前驱研究将牛奶过敏患儿随机分为斑贴组(每周三贴,每次48 h)和安慰剂组[58]。10例患儿接受EPIT治疗3个月,其牛奶累积耐受剂量平均值从1.7 ml升高至23 ml。最常见的不良事件为皮肤反应(50%的受试者),未出现重度不良反应或严重过敏反应。
一项多中心、随机双盲、安慰剂对照研究中纳入了74例花生过敏受试者(年龄4~25岁),分别给予Viaskin Peanut 100 μg、Viaskin Peanut 250 μg(DBV Technologies公司,纽约,纽约州)以及安慰剂(25例)治疗,主要研究终点为52周后治疗成功,具体定义为52周时能够通过5 044 mg花生蛋白OFC,或花生耐受量较基线升高10倍以上。结果显示,第52周时,安慰剂组有 3例(12%)、100 μg组 有 11例(46%)、250 μg组有12例(48%)受试者达到主要研究终点,但无1例能够耐受5 044 mg OFC。安慰剂组、100 μg组及250 μg组进食花生量中位数增加值分别为0 、43及130 mg。小年龄组儿童治疗成功率高(4~11岁组与>11岁组相比)。安慰剂组给药中14%、100 μg组及250 μg组给药中80%例次出现不良反应,主要为斑贴处轻度局部反应。花生EPIT治疗组受试者花生特异性IgG4水平及IgG4/IgE比值升高;同时,嗜碱性粒细胞活化程度及花生特异性TH2细胞因子水平出现下降趋势[33]。
EPIT是近些年尚处于研究阶段的新疗法,已表现出一定的疗效,虽然弱于OIT及SLIT,但安全性极佳,在食物过敏治疗中的地位尚待进一步研究。
4 非变应原特异性治疗及其他探索性研究
人们目前探索了一些其他类型的治疗方法,但临床研究数据尚非常有限,其中包括:大肠杆菌包被的花生蛋白重组疫苗[61]、中草药方剂、食物过敏中草药配方1(food allergy herbal formula 1)[62]、维甲酸分化的成熟树突状细胞诱导活化LAG3调节性T细胞[63]以及花生多肽[60]等,这些方法目前均处于早期研发阶段,尚未进入大规模临床试验阶段。微生物菌群等其他治疗方法目前还有很多未知领域,值得进一步研究[64]。
5 结论
对各种不同类型的食物过敏免疫治疗进行比较,OIT达到临床脱敏的患者比例最高,其次为SLIT,再次为EPIT,而过敏性不良反应的发生率排序也完全相同,以OIT最高[18,36,57]。如前所述,虽然已有大量关于免疫治疗的临床试验,但是其应用仍有许多未知之处[65-68],尤其是目前的相关研究在很多方面尚有局限性,包括研究样本量较小、临床试验设计及研究终点各不相同、缺乏同临床终点有关联的免疫学标志物、缺乏卫生经济学评价数据[69]以及受试人群多样性相对匮乏(包括年龄分布和种族构成)等(表6)。研究的广度也很局限,有关长期治疗的安全性评估研究寥寥无几。此外,由于数据有限,且主要来源于花生、鸡蛋及牛奶过敏的研究,仍不清楚长期治疗的临床结局及其他关键问题的答案,比如经过成功的变应原免疫治疗后SU状态能维持多久?是否会复发呈完全过敏状态[12,17]?即使这些产品获得药监部门批准,仍需明确其临床使用指征。一方面,通过禁食就可以避免出现症状,但却要担心误食诱发严重过敏反应;而为了给误食提供一定的保护,却又要承受免疫治疗带来的持续性不良反应。如何权衡二者的利弊对每位患者的决策都将是非常个体化的(表6)[70-71]。
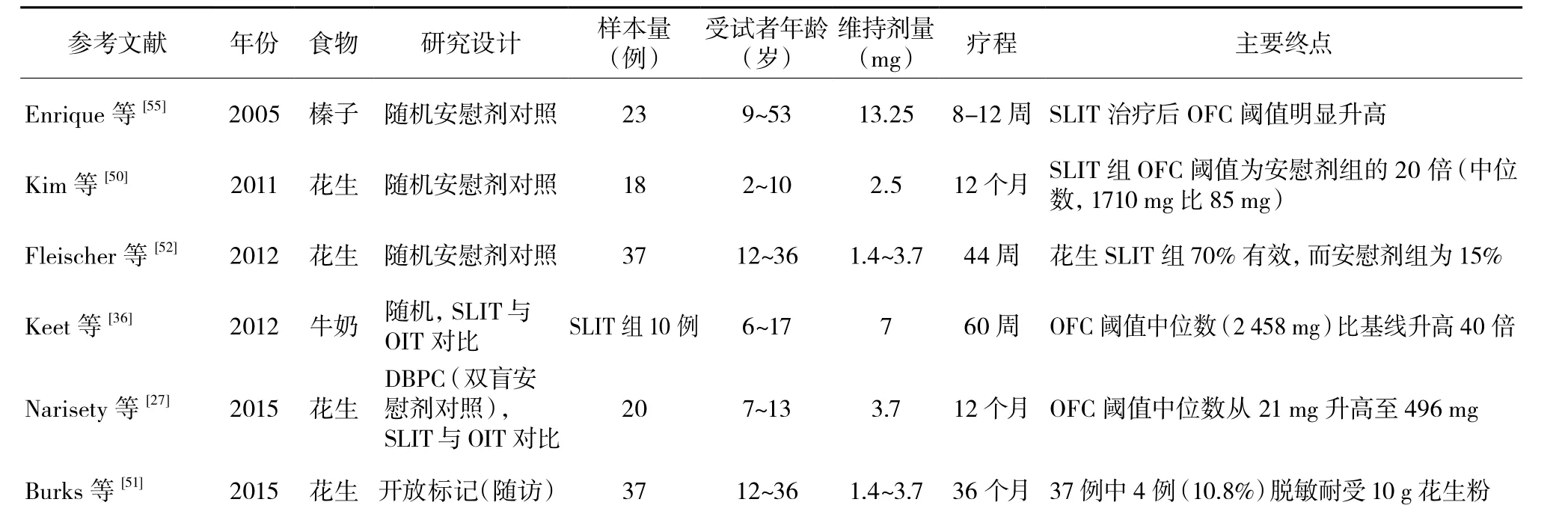
表5 SLIT研究

表6 知识空白与尚未解答的问题
我们已知什么?
·食物免疫治疗可使大多数患者达到脱敏;
·由于可以摄入大量蛋白,因此OIT的疗效最显著,但同时耐受性及安全性也相对较差;
·SLIT及EPIT脱敏疗效较弱,但安全性及耐受性最佳;
·已有研究联合应用佐剂及anti-IgE以提高食物免疫治疗的疗效及安全性
我们尚不清楚什么?
·OIT的最佳剂量、给药频率以及疗程仍不清楚;·维持SU(临床缓解)是否需要维持治疗或持续摄入过敏食物?如果是,所需维持剂量和频率?·各种类型食物免疫治疗同传统治疗方法相比,对于食物过敏患儿生活质量的影响有何改变?
·OIT、SLIT、EPIT联合或序贯治疗是否会优于单一治疗?
参考文献请见原文:
J Allergy Clin Immunol, 2018, 141: 1-9.

