宫颈癌调强放疗中骨盆剂量体积参数与急性骨髓抑制的关系
卢 盼 孙绍星 邱 惠 魏永长
宫颈癌目前是发展中国家女性中仅次于乳腺癌的第二常见癌症,也是仅次于乳腺癌和肺癌的第三大癌症相关死亡原因[1]。放射治疗在宫颈癌的全程治疗中扮演着重要的角色,近年来,调强放射治疗(in-tensity-modulated radiotherapy,IMRT)技术在宫颈癌的放疗中广泛应用。临床医师开始关注到,接受盆腔放疗的宫颈癌患者在治疗期间大量功能性骨髓暴露在照射野内,可能导致骨髓造血功能受损,进而导致白细胞、红细胞、血小板下降[2],严重者可能使患者放疗中断、化疗耐受能力降低、治疗时间延长、增加经济负担及影响治疗效果[3]。因此,精确的放疗计划可能有助于控制肿瘤和降低毒性[4],在保证疗效的前提下,有效降低骨盆骨髓受照剂量对于减少骨髓抑制的发生具有显著的临床意义。关于骨盆受照剂量的体积限制对骨髓抑制的影响的研究,存在不一致结论的报道[5~11]。本研究回顾性分析了210例本院接受同步放化疗或单纯放疗的宫颈癌患者的病例资料,探讨骨盆剂量体积参数对急性骨髓抑制的影响,试图寻找有价值的指标来预防急性骨髓抑制的发生。
1 资料与方法
1.1病例资料 选取2013年1月~2018年6月在武汉大学中南医院肿瘤放化疗科行同步放化疗或单纯放疗,并且有完备医学病历记录的患者210例。入组标准:①KPS评分≥70分;②患者放疗前原始血象正常且放疗中未口服升白药物;③无明显放疗禁忌。排除标准:①既往接受过盆腔放疗,此次为复发后再程放疗;②有其他肿瘤病史;③医学病历记录不全的患者。根据患者的病例记录及相关的检验报告,记录入组患者的年龄、FIGO分期(根据2009年宫颈癌新分期)、病理类型、是否手术治疗、是否行诱导化疗、是否行同步化疗,以及患者放疗期间骨髓抑制情况和放疗计划中骨盆剂量体积参数 V10、V20、V30、V40、V50等信息。本研究经本院伦理委员会讨论并获得批准。
1.2靶区勾画 放射肿瘤医生勾画靶区及危及器官(OAR),宫颈癌术后临床靶体积(CTV)的勾画根据RTOG宫颈癌术后靶区勾画指南[12],包括部分髂总淋巴结、髂内及髂外淋巴结、闭孔淋巴结、骶前区域、宫旁组织、阴道残端上端。未手术的患者需勾画肿瘤原发灶 GTV,GTV外放7 mm生成 PTVg,CTV外放7 mm,生成计划靶区PTV。危及器官勾画包括:小肠、结肠、直肠、膀胱、股骨头及盆腔骨髓。骨盆骨髓勾画包括部分腰骶骨、髂骨、骨盆下部。腰骶骨包含第5腰椎及整个骶骨;髂骨包含股骨头上缘延伸到髂嵴;骨盆下部由坐骨、髋臼及双侧股骨头及股骨上段组成,范围从股骨头上缘至坐骨结节下缘。
1.3放疗计划设计 使用美国Varian公司E-clipse13.5工作站制定。调强放疗采用6MV X射线,7野或9野均分等中心照射,PTV处方剂量46~56Gy/23~28次,每次1.8~2.0 Gy,每周5次。患者PTV覆盖处方剂量均达到95%。
1.4急性骨髓抑制评定 所有患者急性骨髓抑制评定遵循美国肿瘤放射治疗协作组(RTOG)分级标准[13]进行评估。急性骨髓抑制包括白细胞下降、中性粒细胞下降以及血小板下降中的任意一种或多种情况。
1.5统计学处理 采用SPSS21.0软件进行分析,应用χ2和t检验进行单因素分析,logistic回归进行多因素分析。受试者工作特征(ROC)曲线判断骨髓抑制的剂量体积临界值。P<0.05为差异有统计学意义。
2 结果
2.1患者≥2级急性骨髓抑制发生情况 210例患者≥2级急性骨髓抑制的发生率为82.86%(174/210)。其中宫颈癌同步化疗患者≥2级急性骨髓抑制的发生率为91.38%(106/116),明显高于仅行单纯放疗患者的72.34%(68/94)(P=0.00)。患者年龄、临床分期、病理类型、是否手术、是否行诱导化疗对宫颈癌放疗患者发生≥2级急性骨髓抑制的影响未见明显差异(P>0.05)。见表1。
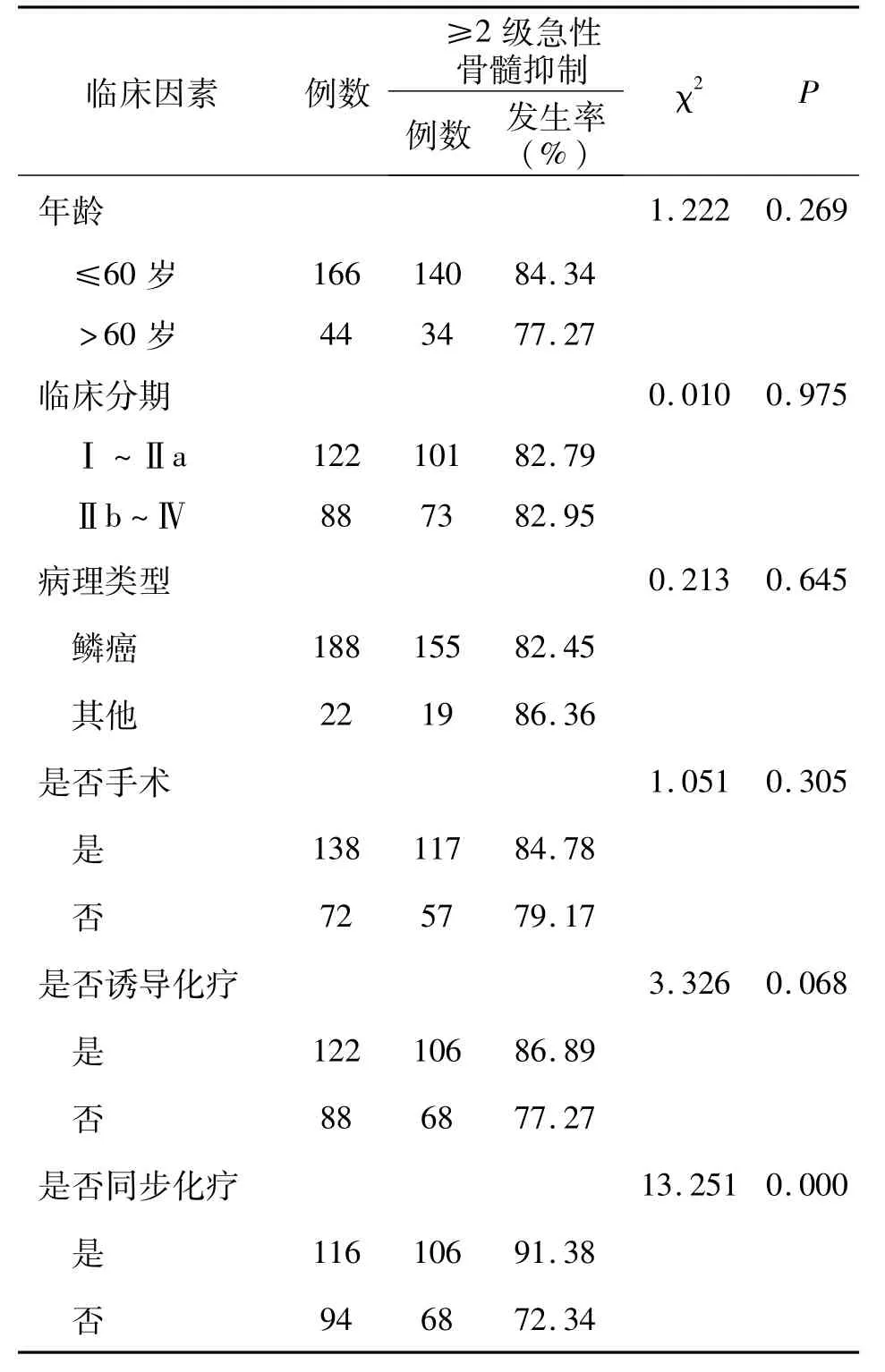
表1 210例患者≥2级骨髓抑制发生情况/n
2.2发生骨髓抑制的单因素分析 将210例患者中行单纯放疗与同步放化疗的患者分别进行统计分析发现:94例行单纯放疗的患者中,≥2级急性骨髓抑制患者的骨盆V10、V20、V30明显高于<2级急性骨髓抑制患者(t=-2.03,-3.237,-2.626,P=0.045,0.002,0.010,见表2-1)。116例行同步放化疗患者的骨盆剂量体积参数对≥2级急性骨髓抑制发生率的影响未见明显差异(P>0.05,见表2-2)。
表2-1 单纯放疗患者骨盆剂量体积参数与发生≥2级骨髓抑制的单因素分析/±s

表2-1 单纯放疗患者骨盆剂量体积参数与发生≥2级骨髓抑制的单因素分析/±s
剂量体积参数单纯放疗<2级 ≥2级 t值P V1093.45±5.95 96.08±5.49-2.03 0.045 V20 78.72±8.38 85.11±8.62-3.237 0.002 V30 44.49±11.65 53.19±15.21-2.626 0.010 V40 26.83±9.37 31.12±13.14-1.523 0.131 V5013.33±5.64 12.91±1.58 0.19 0.849
表2-2 同步放化疗患者骨盆剂量体积参数与发生≥2级骨髓抑制的单因素分析x±s
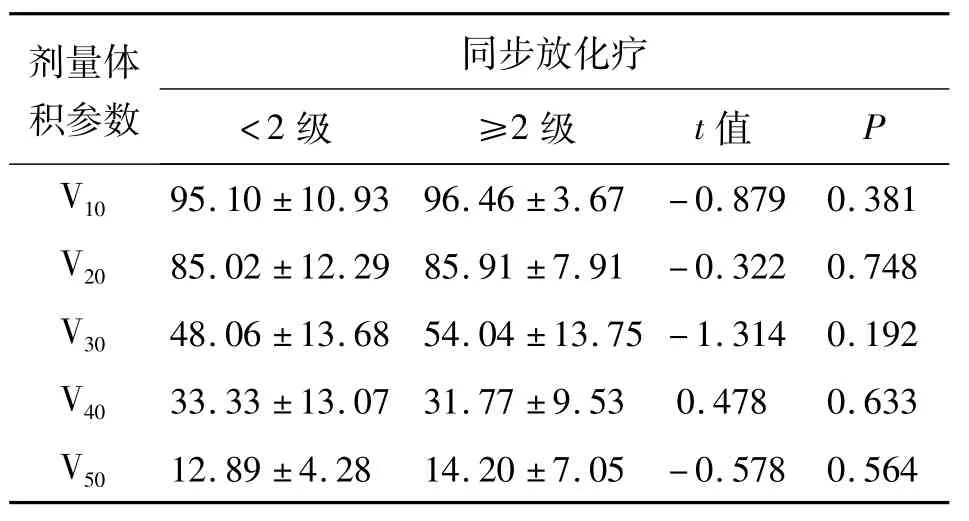
表2-2 同步放化疗患者骨盆剂量体积参数与发生≥2级骨髓抑制的单因素分析x±s
剂量体积参数同步放化疗<2级 ≥2级 t值P V1095.10±10.93 96.46±3.67-0.879 0.381 V20 85.02±12.29 85.91±7.91-0.322 0.748 V30 48.06±13.68 54.04±13.75-1.314 0.192 V40 33.33±13.07 31.77±9.53 0.478 0.633 V5012.89±4.28 14.20±7.05-0.578 0.564
2.3发生骨髓抑制的多因素分析 对单因素分析中获得的与≥2级骨髓抑制发生相关的剂量体积参数采用Logistic回归分析发现,骨盆V20与≥2级骨髓抑制的发生有显著相关性(OR=5.285,P=0.012,见表3)。使用受试者工作(ROC)曲线确定骨盆V20的阈值为84%,即骨盆V20≥84%的患者更容易发生≥2级急性骨髓抑制(敏感性、特异性分别为0.706、0.731)。
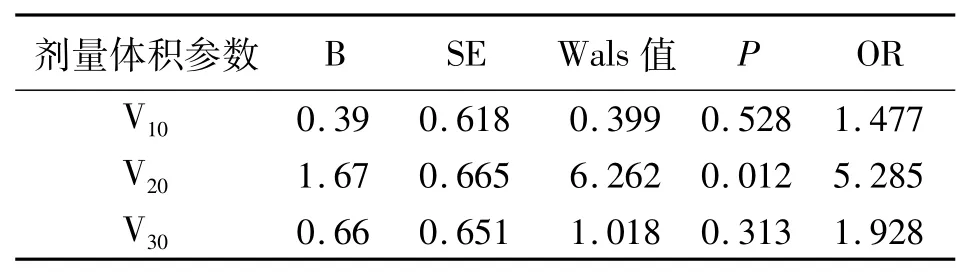
表3 与≥2级骨髓抑制发生相关的多因素分析
3 讨论
临床医师长期关注放疗与骨髓抑制的关系。有研究使用氟胸腺嘧啶脱氧核苷(FLT)半定量计算出了造血活性骨髓的全身分布比例,其分布如下:颅骨占2.9%、肱骨近端占2.0%、胸骨占2.9%、肋骨和锁骨占8.8%、肩胛骨占3.8%、颈椎占4.3%、胸椎占20.0%、腰椎占17.0%、骶骨占9.2%、骨盆占25.0%、股骨近端占4.5%[14,15]。可见人体中超过一半的造血活性骨髓集中在骨盆、胸椎和腰椎。由于骨盆骨髓是主要的造血活性骨髓之一,而在盆腔肿瘤的调强放疗中大部分骨盆骨髓处于照射范围内,盆腔放疗不可避免地会对骨盆骨髓中的造血干细胞(hematopoietic stem cells,HSCs)造成损伤,其发生机制可能为:HSCs可以增殖分化为各种造血祖细胞(hemopoietic progenitor cells,HPCs)来稳定造血功能,当HSCs损伤,而HPCs耗竭时,便会发生急性骨髓抑制。药物或者放射线可以直接造成对HSCs的损伤,还可以通过诱导HSCs衰老使其增殖和更新能力受损,甚至造成过度活化诱导的细胞凋亡[16]。骨髓造血功能会因此受到抑制,从而引起急性血液学毒性,进一步降低患者放化疗的耐受性。为了让患者顺利完成治疗,提高疗效,减少急性血液毒性的发生,盆腔调强放疗时保护好骨盆骨髓在我们临床工作中必须引起高度重视。
近年来放疗患者骨盆剂量体积参数与骨髓抑制的关系引起了越来越多的临床关注。然而目前在宫颈癌放疗中,大样本的相关研究较少,急性血液毒性的放射剂量限量没有较为一致的意见。Mell等[5]对37例宫颈癌患者进行研究,发现骨盆V10≥90%及V20≥75%的宫颈癌患者易发生≥2级白细胞减少。Rose等[6]在Mell的基础上增加病例数至81例,发现V10≥95%及V20≥76%是≥3级骨髓抑制的重要影响因素。Bazan等[7]认为在盆腔调强放射治疗中急性期骨髓抑制不仅与骨盆 V20有关,还与骨盆平均剂量Dmean相关。Hui等[8]对40例患者回顾性分析,发现骨盆高剂量区体积(V30、V40及V50)而非低剂量区体积(V10、V20)与≥2级白细胞减少以及中性粒细胞减少有关。Jianyang等[9]的研究表示限制骨髓剂量在骨盆V5≤96%、骨盆V30≤80%可以分别降低≥2级白细胞减少和血小板减少的发生率,并且进一步证实了活性骨髓低剂量照射体积与血液学毒性具有相关性。Mahantshetty等[10]的研究发现 V40与长期骨髓抑制和不可逆的形态学变化有关,提示了高剂量照射对远期骨髓损伤的严重性。另外,一项妇科肿瘤的2期临床研究RTOG0418[11]显示:宫颈癌术后同步放化疗中,骨盆骨髓V40>37%的患者发生≥2级急性血液毒性者达75%,而V40≤37%的患者≥2级急性血液毒性的发生率只有40%(P=0.025);骨髓中位剂量>34.2 Gy的患者出现≥2级急性血液毒性的发生率比≤34.2 Gy更高(74%vs.43%,P=0.049)。该研究确定了较高剂量的照射体积V40作为宫颈癌术后放化疗急性血液毒性的最佳预测值。毫无疑问,减少盆腔放疗患者骨盆区骨髓照射体积可降低甚至预防急性血液毒性的发生。
原则上宫颈癌患者的治疗方案是按照NCCN指南,根据分期进行分级治疗[17]:早期宫颈癌的主要治疗方法可选择手术或放疗。手术通常用于治疗早期疾病和较小的病变,如Ⅰa期、Ⅰb1期和部分Ⅱa1期。同步放化疗通常是Ⅰb2至Ⅳa期疾病的主要治疗选择,放化疗也可用于不适合做子宫切除术的病人。Ⅱb期及以上的晚期病例通常不采用子宫切除术。在美国,大多数晚期疾病采用放化疗。在一些国家,部分Ⅱb期病例可能采用首选根治性子宫切除术或新辅助化疗后进行根治性子宫切除术。近年来也有研究表明[18,19],新辅助化疗后再行手术治疗是局部晚期宫颈癌的合理选择,它比放疗取得了更好的效果,特别是对于Ⅰb2期到Ⅱb期患者。
对于局部晚期宫颈癌,同步放化疗是其标准治疗方案[20]。然而同步放化疗在增加疗效的同时势必会增加相应的不良反应,如胃肠道反应,血液毒性和白细胞减少等[21,22]。近几年的宫颈癌《NCCN肿瘤学临床实践指南》指出:对于在术后出现淋巴结阴性但有大的原发肿瘤、间质浸润深和/或伴有LVSI的Ⅰa2、Ⅰb1或Ⅱa1期疾病患者推荐使用盆腔放疗(1类)并辅以(或不辅以)基于顺铂的同步化疗(化疗为2B类)。由此可见,临床实际工作中仍需视患者不同情况给予个体化治疗方案。
本研究210例宫颈癌患者中,116例行同步放化疗,94例行单纯放疗。例行单纯放疗的患者中有67例分期为Ⅰ~Ⅱa期,27例为Ⅱb~Ⅳ期。未行同步放化疗的原因有以下几类:①患者本人及家属拒绝行同步化疗;②患者分期较早,无复发高危因素或高危因素少;③患者年龄大,体质差,合并基础疾病多,不能耐受化疗;④患者在手术前或手术后曾行辅助化疗,副反应重。临床资料分析发现,同步化疗是引起患者治疗期间发生急性骨髓抑制的一个重要因素。本研究结果显示,放疗计划中骨盆V20≥84%的患者更容易发生≥2级急性骨髓抑制。因此,在临床工作中制定宫颈癌患者放疗计划时,将骨盆V20限制在84%以下,可在一定程度上控制急性骨髓抑制的发生。
本研究不足之处在于,仅通过对临床资料的回顾性分析来探讨宫颈癌调强放疗期间骨髓抑制的相关因素,尚需进一步提高临床研究等级以证明其可靠性,需通过长期、大样本及前瞻性多中心随机研究进一步证实。

