牛妊娠相关糖蛋白boPAG2双抗体夹心ELISA体系的建立
祁文婧,张 帅,赵 鑫,张红星,谢远红,金君华,刘 慧
(食品质量与安全北京实验室/北京市食品安全免疫快速检测工程技术研究中心/农产品有害微生物及农残安全检测与控制北京市重点实验室/微生态制剂关键技术开发北京市工程实验室/北京农学院 食品科学与工程学院,北京102206)
妊娠相关糖蛋白(pregnancy associated glycoproteins,PAGs)是妊娠后反刍动物外周血中发现的特异性蛋白。它们均属于天冬氨酸蛋白酶高度多态性家族[1]。目前来看,妊娠诊断是健全生殖管理的重要组成部分,特别是在乳制品行业[2]。母牛是否怀孕的标志一般是以妊娠期间PAGs的变化为标准,在牛PAGs中已经鉴定出22种具有广泛时空表达和糖基化模式的不同PAG基因[2,3]。根据起源时间和不同细胞类型的转录,将boPAGs分为两类,古代PAGs和现代PAGs[4]。BoPAGs蛋白可以在怀孕21 d左右的奶牛血液中检测到,分娩时达到最高水平。尽管目前传统的直肠接触或超声妊娠诊断母牛妊娠结果较为准确,但是该方法对技术人员操作要求较高,以及设备昂贵等因素限制了在牛场中的应用。PAGs测定和孕酮检测相比,前者能在牛妊娠第30 d后的任何时间进行,而后者的取样时间限制在牛授精后的19~23 d;此外,通过黄体酮试验的阳性结果可靠度最多为80%,而PAGs测试可达95%~100%。因此,人们一直在寻求可靠、简单的牛妊娠试验,已有文献证明通过免疫学方法检测牛血清(例如PAGs)中的物质是可行的[5,6,7]。
有研究证实可以从牛胎盘组织中提取到 boPAG1,通过基因重组,原核表达的方式进行boPAG1蛋白重组和免疫原制备[8]。只是由于boPAG1的半衰期很长(>8 d),其免疫反应性在产后80~100 d仍可检测到,从而导致假阳性高而影响产后早期繁殖的奶牛中准确的妊娠诊断[9,10]。
BoPAG2只在胎儿胎盘中表达,于妊娠第28 d左右就能被检测到,并且具有相对短的半衰期(4.3 d,产后8周将完全清除)[2],本研究的目的是通过融合蛋白pColdTF-boPAG2制备免疫原免疫小鼠,获取单克隆抗体,筛选可识别pColdTF-boPAG2抗原不同表位的最佳配对单抗,在此基础上初步建立双抗体夹心ELISA方法,为后续研发牛妊娠检测试剂盒奠定基础。
1 材料与方法
1.1 材 料
重组免疫原pColdTF-boPAG2、小鼠 SP2/0 骨髓瘤细胞:北京农学院食品科学与工程学院F301实验室保存。鼠单抗亚型鉴定试剂盒:Sigma公司。动物疫病检测诊断试剂盒:北京爱德士元亨。其他试剂均为分析纯。
DL-CJ-1NDII超净台:北京东联哈尔;LHS-100CH 恒温恒湿箱:上海一恒科技。DYY-6DCP-32B 型恒流电泳仪:北京六一仪器厂。酶标测定仪:Bio Rad公司。BT2202S 电子天平:Starorius集团。BIOFUGE STRATOS台式冷冻离心机、NANODROP 2000微量分光光度计:Theromo公司。
1.2 方 法
1.2.1 动物免疫 将F301实验室保存的含pCold-TF蛋白融合标签(52 kD)的重组蛋白boPAG2(42 kD)于4 ℃进行透析除盐(截留分子量为3 kD),将pColdTF-boPAG2作为免疫原对无特定病原体(Specific pathogen Free,SPF)级小鼠进行免疫。首次免疫取100 μg纯化抗原与等体积的完全弗氏佐剂混合,以皮下注射方式全部注入小鼠体内。之后免疫则与等体积的不完全弗氏佐剂混匀。免疫周期14 d/次。4~5次后,对小鼠进行眼球取血,通过间接ELISA法测定小鼠血清抗体滴度。于融合前3 d向最佳免疫小鼠脾脏注射20 μg免疫原加强免疫。
1.2.2 McAbs的制备及其特性分析 将抗体效价较好的小鼠脾细胞与生长状态好的骨髓瘤细胞进行融合。经筛选获得3株特异性较好的杂交瘤细胞株,置于液氮中保存[11]。将对数期生长的高效价杂交瘤细胞接种于石蜡致敏的小鼠腹腔内,8~10 d后收集腹水,12000 r/min离心5 min,取上清液进行单克隆抗体pColdTF-boPAG2纯化[12,13]。用分光光度计测定单抗浓度,用抗体亚型检测试剂盒检测pColdTF-boPAG2单抗亚型,用高碘酸钠方法对pColdTF-boPAG2单抗进行标酶,作为检测抗体。
1.2.3 双抗夹心ELISA体系的建立 运用棋盘法测定pColdTF-boPAG2的McAbs与包被蛋白pColdTF-boPAG2结合的饱和稀释度以及酶标二抗与pColdTF-boPAG2单抗结合的饱和稀释度。运用间接ELISA相加试验测定各株McAbs对应的OD450 nm。试验中以自制检测原pColdTF-boPAG2作为包被体,浓度为25 μg/mL。分别加入其中1株和另一株饱和稀释度的McAb,37 ℃孵育35 min;加入饱和稀释度的酶标二抗,37 ℃孵育35 min;加入TMB显色后终止。通过ELISA相加试验所得OD450 nm,按方阵交叉法确定McAbs最佳配对的选择,建立了夹心酶联免疫吸附试验系统。以一种 McAb包被酶标板, pColdTF-boPAG2为中心抗原,另一种标酶(HRP)McAb进行灵敏度检测试验[15]。
1.2.4 双抗夹心ELISA体系的应用 从当地牛场中分别提取70头35 d左右孕期的荷斯坦奶牛血清作为阳性血清,50头空怀期荷斯坦奶牛血清作为阴性血清(事先已全部经过动物疫病检测诊断试剂盒检测,确认血清样本阴阳性),于本双抗夹心 ELISA 体系中进行检测。以pCold TF-boPAG2蛋白为阳性对照,PBS作阴性对照,每头牛血清做4次测定,得出平均值。重复试验3次,以检验此体系的特异性。
2 结果分析
2.1 抗原及抗体鉴定
免疫原为F301实验室保存的融合蛋白pCold TF-boPAG2,经微量分光光度计鉴定免疫原浓度为1 mg/mL(图1)。通过有限稀释亚克隆法筛选出3株杂交瘤细胞,命名为2C01,5E02,3B05。将其分别注入小鼠腹腔,1周后可获得腹水4~6 mL/只。腹水中抗体的特性分析见表1。通过正辛酸-硫酸铵分级沉淀法纯化pCold TF-boPAG2单克隆抗体,通过蛋白电泳检测pCold TF-boPAG2单克隆抗体纯度及分子质量[14](图1)。由图1可以看出纯化后的pCold TF-boPAG2单克隆抗体与 IgG 的分子质量相同[16]。用抗体亚型试剂盒鉴定单抗2C01,5E02,3B05亚型分别为 IgG2a,IgG2a,IgG1(表1)。

M.Protein Marker;1.重组蛋白pCold TF-boPAG2。M.Protein Marker;1.单抗2C01;2.单抗5E02;3.单抗3B05A.免疫原pCold TF-boPAG2的鉴定;B.三株单克隆抗体的鉴定A. identification of immunogen pCold TF boPAG2;B. identification of three monoclonal antibodies图1 免疫原及单克隆抗体SDS-PAGE电泳图Fig.1 Immunogenic and Monoclonal antibody SDS-PAGE electropherograms
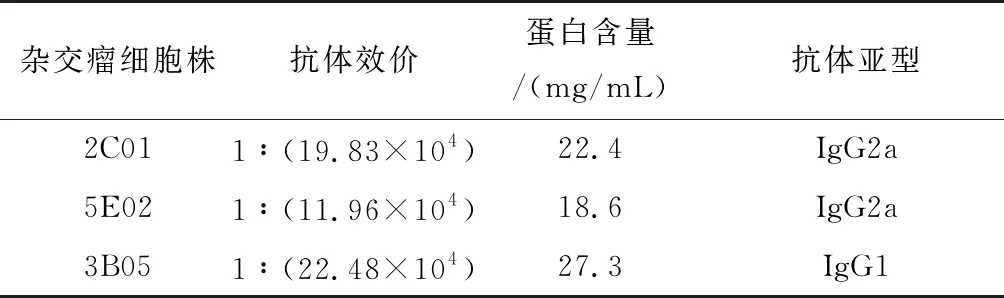
表1 pCold TF-boPAG2三株单抗鉴定结果Tab.1 Results of three McAbs by anti-pCold TF-boPAG2
2.2 单克隆抗体识别pCold TF-boPAG2抗原表位特性分析
为了测定单抗识别pCold TF-boPAG2抗原表位的特性,设定酶标记山羊抗小鼠IgG的饱和稀释度为1∶5000,各株McAbs与pCold TF-boPAG2包被抗原的饱和稀释度为(1∶200)~(1∶1000)。结果以相加指数 AI(addictivity index)数值大小来判定[17]。
表2表明,当2C01与5E02,2C01与3B05这两对McAbs进行相加试验后,AI 值在11.69%~37.66%间波动,说明配对失败,两对抗体所结合的表位相同,无互补特性。5E02和3B05互交相加后,AI值达到90%以上(大于50%),表明它们可识别pCold TF-boPAG2抗原上的不同表位,配对成功。本试验即认为5E02和3B05这对抗体是可识别pCold TF-boPAG2抗原上不同构象表位的。
2.3 双抗夹心ELISA体系的建立结果
由相加试验计算结果选择互补和相加特性最好的McAbs(5E02和3B05)建立双抗体夹心ELISA体系,以3B05抗体作为HRP标酶检测抗体(HRP-3B05),5E02抗体作为捕捉抗体(包被浓度2.5 μg/mL),同时将PBS作为空白阴性对照。该体系中标酶抗体的初始质量浓度为10 μg/mL,抗原初始质量浓度为40 μg/mL,两者均按2n倍比稀释加入进行灵敏度检测,运用双抗体夹心ELISA体系所得结果一般以P/N 值>2.1 且OD值接近1的孔所对应的McAb浓度为该体系中McAb的最佳工作浓度[18,19]。经试验证明当5E02作为包被抗体,3B05作为酶标抗体(即检测抗体)时,其最佳稀释质量浓度为1.25 μg/mL,检测pCold TF-boPAG2的灵敏度可达5 μg/mL,见表3。

表2 ELISA相加试验测定pCold TF-boPAG2单克隆抗体OD值及AI值Tab.2 The titer of the combined test value and AI by indirect ELISA
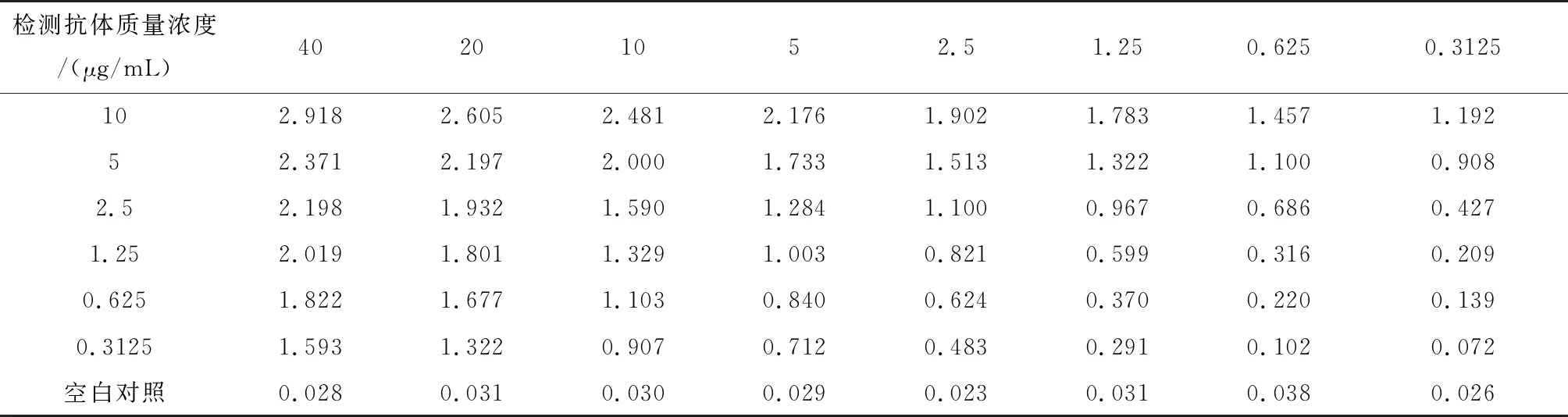
表3 棋盘滴定法检测结果Tab.3 Results of checkerboard titration
2.4 双抗体夹心ELISA体系对少量血清样品检测结果
将120头荷斯坦奶牛各自的血清进行编号,阴性奶牛血清编号为-1~-50,阳性奶牛血清编号为1~70,将它们分别作为中间抗原,5E02作为包被抗体,3B05作为酶标抗体,以抗体最佳工作浓度进行双抗体夹心ELISA检测[20],所得OD450 nm值如图2所示。经检测阴性奶牛OD450 nm值维持在0.4左右,阳性奶牛OD450 nm值在0.6上下浮动。

图2 双抗体夹心ELISA体系进行奶牛血清样品检测结果Fig.2 Detection of serum samples from Holstein cows by double antibody sandwich ELISA system
3 讨 论
已有研究发现怀孕奶牛血清中的PAGs种类繁多,免疫抑制活性无法确定[21]。为提高奶牛boPAG2的蛋白浓度及纯度,增加其在小鼠中的免疫原性,本试验选取实验室自制免疫原pCold TF-boPAG2进行后续抗体制备。尽管已对目标蛋白进行脱盐处理,但免疫过程中仍发现小鼠状态欠佳,食欲萎靡,可能由于免疫原boPAG2(42 kD)偶联大蛋白标签pCold-TF(52 kD)导致注射蛋白分子量过大,致小鼠产生不良反应。
研究表明筛选单克隆抗体时,需注意细胞融合期间的污染问题[22]。本试验在细胞培养的过程中,保持了细胞房的相对净洁,且操作人员手法熟练,降低了细胞被污染的可能性。在利用双抗体夹心ELISA体系进行检测时,由于牛血清样品的特殊性,封闭液采用5%脱脂奶粉而非BSA,以降低该体系的假阳性。本试验只是初步利用制备的pCold TF-boPAG2单克隆抗体建立双抗体夹心ELISA体系,而在实际应用中,奶牛阴阳性血清样品OD450 nm值差异不明显,图2中编号为-18的血清和编号为44的血清样本实际分别呈阴性和阳性,但在检测体系中的结果差别不大,表明该体系灵敏度还不够强。因此仍需对该体系的抗体包被浓度和孵育时间等关键步骤进行进一步的优化,并对pCold TF-boPAG2单克隆抗体的亲和力做进一步的测定。
另外,经研究发现现场PAG-ELISA的测定值与妊娠奶牛血液PAG浓度有关[20],本研究在免疫学检测和现场检测中结果差异较大的原因可能由于采集的妊娠奶牛血清样本较少,血清中包含多种牛妊娠相关糖蛋白,不同PAGs水平的差异有可能对该体系存在交叉性影响。后期应再对该体系进行完善,并采集现场不同种类妊娠动物的大量血清样品进行测定,观察相同妊娠期,不同物种间OD450 nm值是否存在显著性差异,验证该体系在不同反刍动物间的灵敏度及特异性。

