不同受精状态及发育中卵裂球数量对囊胚形成的影响
谢聪聪,郭晓丽,姚冠峰,杜丽荣,张欣,王树松,王雪莹
(河北省计划生育科学技术研究院,河北省生殖医院,国家卫生健康委员会计划生育与优生重点实验室/河北省生殖医学重点实验室,石家庄 050071)
体外受精-胚胎移植(IVF-ET)过程中,大多数生殖中心在受精后16~18 h评估受精情况,呈现2个原核(pronuclei,PN)和两个极体(polar body,PB)视为正常受精。通过形态学评估,包括胚胎的发育速度、卵裂球数目、碎片多少、胞质均一度等情况,挑选形态学评分较高的卵裂期胚胎或囊胚进行冷冻或移植。但除2PN胚胎外,还有单原核(1PN)、三原核(3PN)、多原核(多PN)及未见原核(0PN)受精卵,大多IVF治疗周期中有足够的2PN来源胚胎,故非2PN胚胎不作为首选移植,而3PN胚胎予以废弃处理。事实上,0PN和1PN的异常受精与观察原核的时间有关,其中部分异常受精胚胎可能是由于错过了最佳观察时机。有文献报道,患者在移植0PN或1PN的胚胎后,也生育了健康的后代[1]。
本研究将0PN及1PN来源的形态学优质胚胎继续培养至囊胚阶段,试图通过延长体外培养的时间来对胚胎进行进一步筛选。比较异常受精胚胎及2PN来源优质胚胎的囊胚形成情况,探讨异常受精胚胎的囊胚形成潜能及其可利用价值。
资料与方法
一、研究对象
收集2017年1月至 2019年7月在河北省生殖医学中心实施IVF的患者周期资料,形态学评分等同于优质胚胎的异常受精胚胎及2PN来源的优质胚胎,将其培养至囊胚,囊胚评分依据Gardner评分标准[2]。患者纳入标准:女方年龄≤35岁,夫妇双方染色体核型分析均为正常。排除标准:基础生殖激素水平不正常者,未成熟卵母细胞体外成熟培养(IVM)周期和获卵数≤1的患者。
根据D1受精状态,将胚胎分为3组:0PN组(193个)、1PN组(32个)、2PN组(573个)。再根据胚胎发育情况分为A、B、C三个亚组:D2≤3细胞(A1组)、4~6细胞(B1组)和>6细胞(C1组);D3≤6细胞(A2组)、7~9细胞(B2组)和>9细胞(C2组)。
二、研究方法
1.促排卵方案:根据卵巢储备功能情况及血清FSH、LH、E2、P水平选择方案及Gn启动剂量,当1~2个卵泡直径≥18 mm或者3个及以上卵泡直径≥17 mm时扳机,扳机后35~37 h行阴道超声引导下取卵术。除PPOS方案外,其余方案自取卵日开始进行黄体支持。
2.精液处理及受精:精液常规上游法或密度梯度离心法处理,IVF受精后4~6 h去除卵母细胞周围的颗粒细胞,置于培养液微滴中观察卵母细胞成熟度及第二极体的排出情况。胚胎培养采用微滴法培养,受精后16~18 h倒置显微镜观察卵母细胞受精情况。
3.胚胎评分:受精后第3日(D3)对正常受精(2PN)胚胎进行形态学评分[3],评分标准分为Ⅰ~Ⅳ级,Ⅰ~Ⅱ级为优质胚胎。Ⅰ级:8~10细胞;卵裂球大小均匀、形态规则,透明带完整;胞质均匀清晰;胚胎内碎片<5%。Ⅱ级:≥6细胞;卵裂球大小略不均匀、形态略不规则;胞质可有颗粒现象;胚胎内碎片5%~15%。Ⅲ级:D3≥4细胞;卵裂球大小不均匀、可有形态不规则;胞质可有粗颗粒现象;胚胎内碎片16%~25%。Ⅳ级:卵裂球大小极不均匀;胞质有严重粗颗粒现象;胚胎内碎片>30%;或存在多核现象。将优质胚胎培养至囊胚,囊胚评分依据Gardner评分标准。优质囊胚为Gardner评分标准中3期及3期以上,且内细胞团和滋养层评分均不含C的囊胚;可利用囊胚定义为Gardner评分标准中3期及3期以上,且内细胞团和滋养层评分不同时含C的囊胚。将胚胎培养至第5天(D5)或者第6天(D6),D5移植或冷冻:根据胚胎发育过程,选择4期及以上的优质囊胚和可利用囊胚进行移植或冷冻,剩余可继续培养至D6;D6移植或冷冻:根据Gardner评分标准冷冻或移植优质囊胚和可利用囊胚。
4.观察指标:观察不同来源胚胎的囊胚形成率、优质囊胚率、可利用囊胚率。囊胚形成率=囊胚总数/行囊胚培养的胚胎总数×100%;优质囊胚率=优质囊胚数/行囊胚培养的胚胎总数×100%;可利用囊胚率=可利用囊胚数/行囊胚培养的胚胎总数×100%。
三、统计学方法
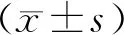
结 果
一、0PN组、1PN组及2PN组囊胚形成情况比较
3组的整体囊胚形成率、优质囊胚率、可利用囊胚率均无显著性差异(P>0.05)(表1)。

表1 囊胚发育参数在3组胚胎间的比较(%)
进一步比较了0PN组、1PN组及2PN组间的D5和D6囊胚发育情况,结果表明,0PN组D5囊胚形成率、优质囊胚率、可利用囊胚率均显著高于D6(P<0.05);1PN组D5优质囊胚率显著高于D6(P<0.05),而D5囊胚形成率、可利用囊胚率与D6无显著性差异(P>0.05);2PN组D5优质囊胚率和可利用囊胚率均显著高于D6(P<0.05),D5囊胚形成率与D6无显著性差异(P>0.05)(表2)。

表2 囊胚发育参数在3组胚胎D5及D6间的比较(%)
二、D2各亚组之间囊胚的培养结果比较
D2各亚组分析结果表明,0PN组A1、B1及C1各组囊胚形成率、优质囊胚率和可利用囊胚率均无显著性差异(P>0.05)。1PN组A1亚组数目为1,C1亚组数目为0,B1亚组囊胚形成率、优质囊胚率、可利用囊胚率分别为74.19%、 25.81%、58.06%。2PN组的囊胚形成率上,B1组显著高于A1组和C1组(P<0.05),A1亚组显著高于C1亚组(P<0.05);可利用囊胚率上B1组显著高于A1组和C1组(P<0.05),而三个亚组之间优质囊胚率均无显著性差异(P>0.05)(表3)。
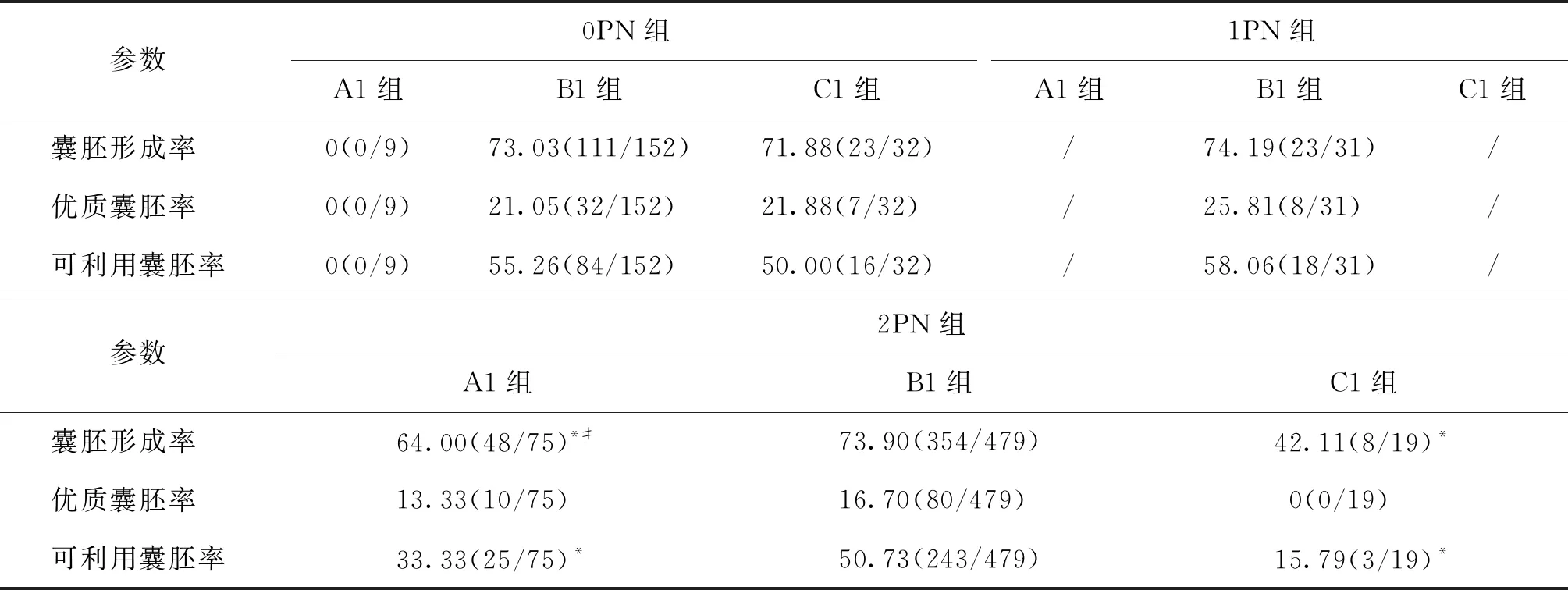
表3 囊胚发育参数在D2各亚组间的比较(%)
三、D3各亚组之间囊胚的培养结果比较
D3各亚组的胚胎发育结果分析表明,0PN组在囊胚形成率及可利用囊胚率上,A2组均显著低于B2和C2组(P<0.05),且B2组可利用囊胚率也显著低于C2组(P<0.05),但3个亚组(A2、B2、C2)之间优质囊胚率均无显著性差异(P>0.05);1PN组的囊胚形成率B2组显著高于A2和C2组(P<0.05),且C2组显著高于A2组(P<0.05),而3个亚组之间的优质囊胚率和可利用囊胚率均无显著性差异(P>0.05);2PN组的可利用囊胚率比较中,A2组显著低于B2、 C2组(P<0.05),且B2组显著低于C2组(P<0.05),而2PN 3个亚组间的囊胚形成率和优质囊胚率均无显著性差异(P>0.05)(表4)。
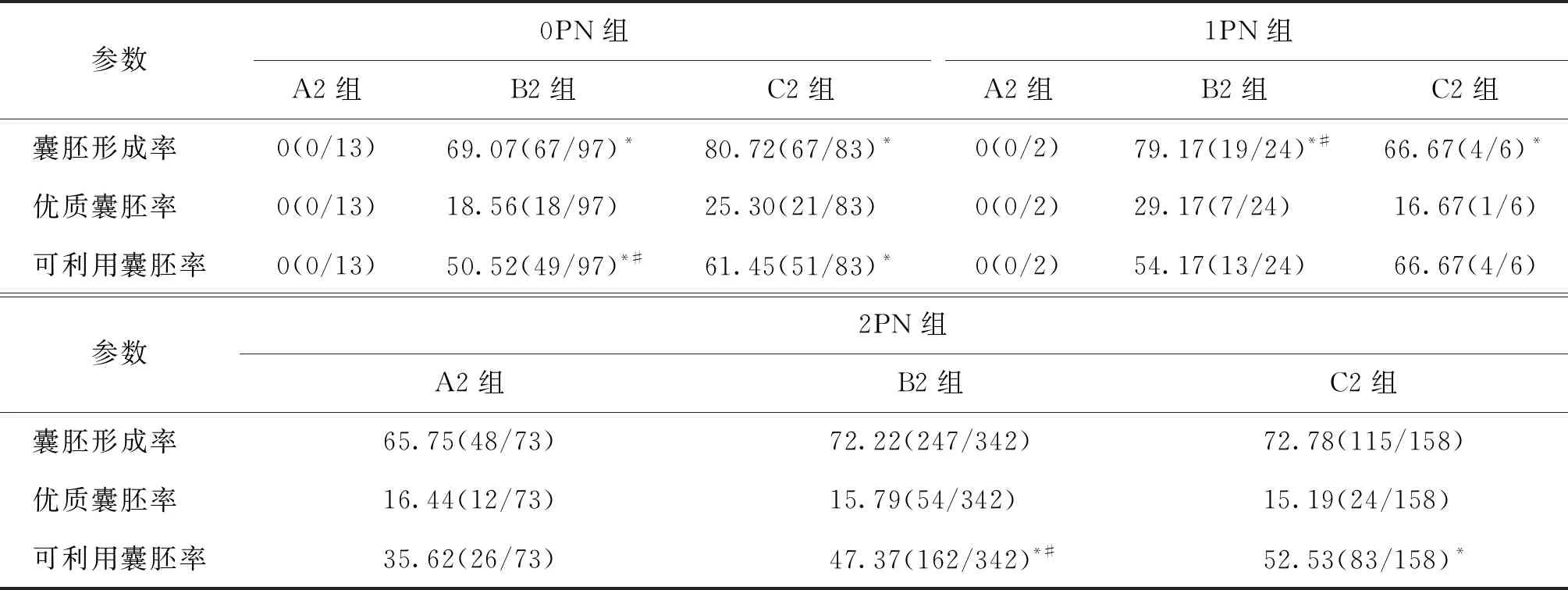
表4 囊胚发育参数在D3各亚组间的比较(%)
四、D2 各亚组中不同受精状态胚胎的囊胚发育情况
A1亚组中1PN组的数目为1,2PN组囊胚形成率、可利用囊胚率显著高于0PN组(P<0.05),但两组间优质囊胚率无显著性差异(P>0.05);B1亚组中3种受精状态胚胎的囊胚形成率、优质囊胚率、可利用囊胚率均无显著性差异(P>0.05);C1亚组中2PN组的囊胚形成率、优质囊胚率和可利用囊胚率均显著低于0PN组(P<0.05)(表5)。
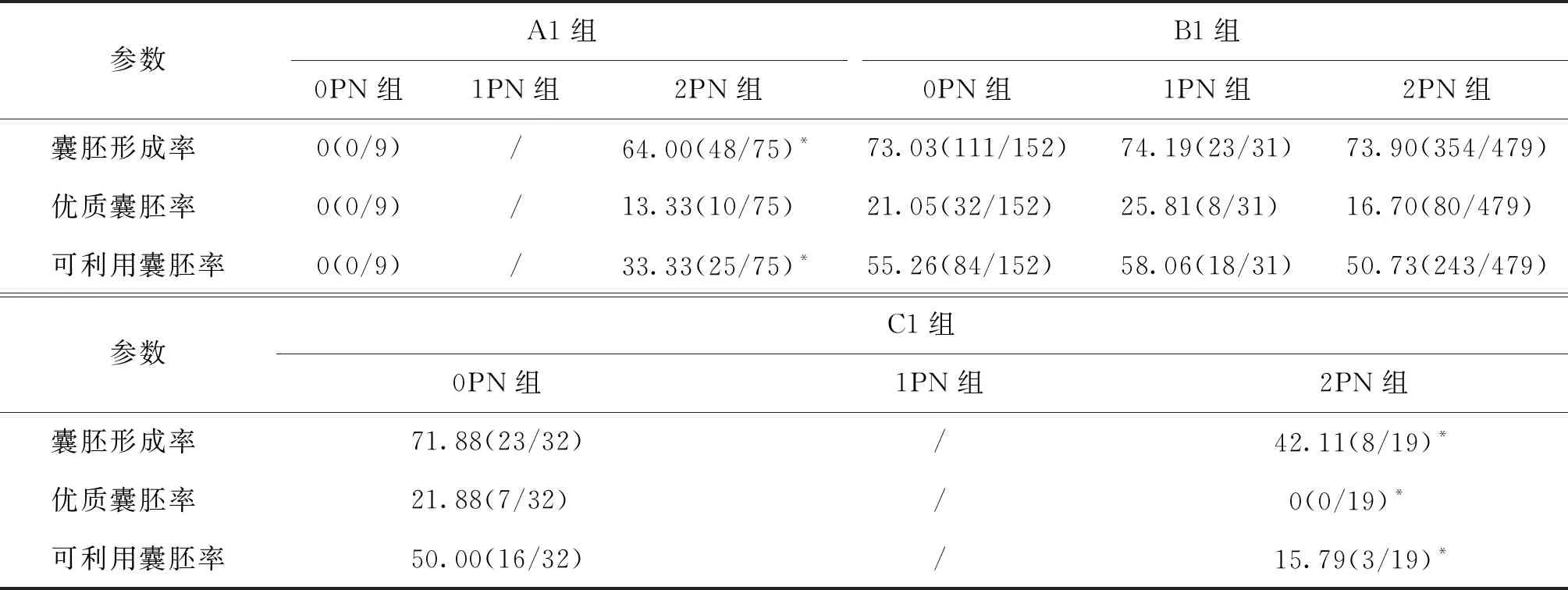
表5 胚胎发育参数在D2各亚组中不同受精状态胚胎间的比较(%)
五、D3各亚组中不同受精状态胚胎的囊胚发育情况
A2亚组中2PN组囊胚形成率、可利用囊胚率显著高于0PN组和1PN组(P<0.05),0PN组和1PN相比无显著性差异,三组间优质囊胚率无统计学差异(P>0.05);B2亚组和C2亚组中3种受精状态胚胎的囊胚形成率、优质囊胚率和可利用囊胚率之间均无显著性差异(P>0.05)(表6)。

表6 胚胎发育参数在D3各亚组中不同受精状态胚胎间的比较(%)
讨 论
本文回顾性分析了D1不同受精状态胚胎(0PN、1PN、2PN)继续培养后囊胚形成情况,发现形态较好的0PN、1PN胚胎具有很好的囊胚发育潜能。常规IVF周期中0PN胚胎的出现非常常见,原因可能是观察受精时原核已消失,或者还未出现,其发生还与女性的年龄、卵母细胞数量、优质胚胎比例等显著相关[4]。赵双丹等[5]研究了10 834个IVF周期,其中4 531个周期出现一个或多个0PN胚胎,占IVF周期的 41.82%,0PN胚胎个数占卵裂期胚胎的18.01%;移植后结果显示0PN来源的卵裂期胚胎的妊娠率低于2PN来源的卵裂期胚胎,而0PN来源的囊胚移植妊娠率与2PN来源的囊胚相当。Liu等[4]研究也表明胚胎来源(无论是来自2PN还是来自0PN)对成功率没有显著影响。
常规IVF受精中1PN胚胎的形成原因主要有:原核形成不同步,错过双原核的观察时机或原核融合,因此部分1PN胚胎可能是正常受精胚胎。囊胚培养可以排除部分染色体异常的胚胎,但1PN胚胎的囊胚形成率较低[6]。研究表明,当1PN的原核面积≥710 μm2或直径≥31 μm时,可获得与2PN胚胎相似的临床结局[7]。Feenan 等[8]认为部分1PN胚胎可培养至囊胚,Li等[9]的研究表明IVF周期中1PN卵裂期胚胎的活产率显著低于2PN组,但1PN囊胚组的妊娠率与2PN囊胚组相当。Yoshiteru等[10]的研究指出,约80%的1PN胚胎含有二倍体基因组。Liao等[11]对1PN胚胎进行了系统的基因学检测后发现,1PN 胚胎囊胚组的二倍体率明显高于卵裂期胚胎,说明囊胚的形成过程可排除部分染色体异常的胚胎,与Sandalinas等[12]的研究结果一致,故囊胚的形成可作为正常受精和染色体正常的一个重要的形态学参考指标。我们的研究表明,形态学评分优质的0PN和1PN胚胎与正常受精胚胎(2PN)的囊胚形成率、优质囊胚率、可利用囊胚率均无显著性差异。Fu等[13]的研究显示,1PN(2Pb)和0PN(2Pb)胚胎的囊胚形成率分别为70.18%和69.17%,形成的囊胚移植后结局分别为:临床妊娠率(47.06%和56.25%)、植入率(40.00%和47.62%)、活产率(29.41%和43.75%)和畸形率(0%和0%),与2PN组结局无显著差异。
本文研究结果显示,0PN、1PN、2PN三组的囊胚形成率、优质囊胚率、可利用囊胚率D5的比率均高于D6。此结果和王雪等[14]的研究结果一致,均表明D5组的优质胚胎比例显著高于D6组。在冻融单囊胚移植时,若移植胚胎为优胚,则囊胚形成时间对于妊娠结局无显著影响;但当移植囊胚为非优胚时,D5囊胚移植妊娠结局优于D6囊胚移植[15]。几项大的荟萃分析显示D5移植后的临床妊娠率显著高于D6[16-17]。
研究发现D2的4细胞是理想的卵裂阶段,其着床率明显优于其他细胞数目[13]。本研究显示,0PN胚胎,D2 4~6细胞(B亚组)时可获得较好的囊胚培养结果。D2 4细胞胚胎的体外发育能力和体内着床潜能优于非4细胞胚胎,D2卵裂球数目>4细胞的优质胚胎率和着床率高于<4细胞胚胎[18]。宋冰冰等[19]的研究表明,D3卵裂球数目≤7细胞的胚胎可利用囊胚率低于≥8细胞的胚胎;比较D3卵裂球数目≤7细胞、8~10细胞、≥11细胞的优质囊胚率,差异有统计学意义。另有研究比较D3卵裂球数目≤6细胞、7~10细胞、≥11细胞的优质囊胚率,差异有统计学[20]。在排除碎片的影响后,囊胚发育与D3卵裂球数目有关,4~6细胞的囊胚形成率最低,而7~9细胞与≥10细胞相比则无差异[21]。本研究结果和上述以往研究大体一致。D2 4~6细胞胚胎具有较好的囊胚发育潜能,表明D2的胚胎发育情况对囊胚的发育起着重要的作用,并且0PN胚胎D2卵裂球数目>6细胞时具有较好的囊胚发育潜能。D3卵裂球数目≤6细胞时囊胚形成率较低,随着细胞数量的增加,可利用囊胚率随之升高,但并没有增加优质囊胚率。因此,胚胎前期发育速度对后期囊胚的形成起着关键性的作用,可预示囊胚质量及后期着床情况。
对于常规IVF周期中2PN较少或无2PN胚胎的患者,可以将0PN及1PN形态学较好的胚胎进行囊胚培养,充分知情同意后进行移植或冷冻。由于本研究样本量小,且没有追溯后期移植情况,需要进一步扩大样本分析及长期随访工作。今后,我中心将充分利用Timelapse时差培养箱观察胚胎的动态发育过程。

