低氧和低氧诱导因子在月经样小鼠模型中对子宫内膜崩解的作用
梁敏,陈西华,王树芳,张欣,鲁聪,武斌,南楠,张博男,贺斌,徐祥波*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730;3.新乡医学院,新乡 453003;4.山东大学附属济南市中心医院,济南 250013)
月经对女性生殖健康具有重要意义。月经是指女性子宫在雌激素和孕激素的作用下,周期性发生内膜增厚、血管和腺体增生、崩解出血以及修复的生理过程。子宫低氧状态可以通过子宫内膜血流减少、血氧分压降低,或检测到低氧标志物——派诺硝唑等判定[1-3]。目前,对于月经期间子宫组织是否存在低氧状态一直存有争议。Markee[4]构建了经典的月经模型,他们将人类子宫内膜移植到恒河猴眼内并发现,在月经开始(即血液释放)之前,可以在4~24 h观察到螺旋小动脉血管收缩,24 h后螺旋小动脉血管发生剧烈收缩导致子宫内膜组织处于低氧状态并造成子宫内膜组织坏死。此外,我们的既往研究发现,与低氧相关的关键因素——低氧诱导因子1A(Hypoxia inducible factor 1 subunit alpha,HIF1A)在月经样小鼠子宫内膜崩解时表达升高并激活下游基因[5]。在人类子宫内膜中,HIF1A在月经期的子宫内膜细胞核中表达量最高[1,6]。Maybin等[7]最近的研究发现,月经期间月经大出血女性的的子宫内膜中HIF1A表达量低于正常女性。在小鼠月经样模型中,高氧(75% O2)、HIF1A抑制剂或基因诱导引起的HIF1A降低均能延缓子宫内膜修复,而正常水平的HIF1A则促进子宫内膜修复过程,这项工作证实低氧和HIF1A在正常子宫内膜修复中的重要性[8]。有研究发现,小鼠生理性月经模型P4撤退后2 d子宫组织派诺硝唑染色呈阳性[3],并在P4撤退后8 h和24 h时发现,蜕膜化细胞与子宫内膜分界处可见强烈低氧状态[9],以上结果揭示了小鼠子宫内膜存在生理性低氧状态。然而,也有研究认为月经期间子宫组织不存在低氧状态。有研究通过监测人子宫内膜温度和氙-133 清除率发现,子宫内膜的血流在月经前或月经期间均未减少[1]。Gannon等[2]利用电子顺磁共振血氧测定技术和组织氧分压检测系统观察发现,移植的人子宫内膜由于停止给予孕酮(P4)激素(又称P4撤退)而崩解,但没有检测到显著的氧分压改变,只在少数移植的子宫内膜中检测到派诺硝唑。
小鼠月经模型建立于1984年[10],2003年小鼠月经样模型又有了进一步的优化[9]。2007年Xu等[11]成功建立了基于P4药理撤退的小鼠月经样模型。Finn等[10]切除小鼠卵巢后,通过周期性皮下注射E2和P4,随后向宫腔内注射花生油来诱导子宫内膜蜕膜化,在P4撤退后小鼠的子宫内膜出现了类似高等灵长类雌性的经期崩解出血现象。小鼠月经样模型可以实时研究子宫内膜崩解,并允许体内干扰的存在。因此,本研究将利用小鼠月经样模型进一步探索低氧和HIF1A在子宫内膜崩解中的作用。
材料和方法
一、实验动物
8~10周龄的SPF Ⅱ级C57BL雌性小鼠49只,购自中国医学科学院实验动物研究所,实验动物许可证:SCXK(京)2019-0014。饲养条件:给予充足的水和食物饲养,保持明暗交替各12 h,温度(21±1)℃,湿度50%~60%。所有动物实验及手术操作均获国家卫生健康委科学技术研究所动物伦理委员会审查批准。
二、实验试剂及仪器
E2(Alfa Aesar,美国),P4(Sigma-Aldrich,美国),二氯化钴(CoCl2)(UN3077,上海国药),低氧探针试剂盒(HP3-100,Burlington,美国),兔抗HIF1A单抗(NB100-134,Novus,美国),苏木素伊红染液、山羊抗兔增强二步法检测试剂盒(PV6100,北京中杉金桥),核蛋白提取试剂盒(Thermo,美国),β-Actin一抗(北京科温生物),Lamin-B 一抗(SC-20682,Santa,美国),增强化学发光(ECL)试剂盒(北京全式金生物);凝胶成像系统(Minichemo 500TM,北京赛智),光学显微镜(XS-23C,上海蒲柘光电)。
三、研究方法
1.小鼠月经样模型的建立:根据以往的研究建立小鼠生理性P4撤退月经样模型[9-11]。对小鼠行双侧卵巢切除术,休养2周后记为第1天,第1~3天9:30在小鼠背部皮下注射100 ng E2;第4~6天,小鼠不做处理,正常饲养;第7天9:30在小鼠背部皮下注射50 ng P4和 5 ng E2后在小鼠背部皮下植入含有P4的硅胶管(P4维持)[12];第8~9天9:30在小鼠背部皮下注射5 ng E2;第9天11:30打开小鼠背部,经双侧子宫角向宫腔内注射15 μl无菌花生油以诱导子宫蜕膜化;在子宫蜕膜化49 h后,移除P4硅胶管(P4撤退,记为取材0 h)。分别在0 h、8 h、12 h、16 h、24 h时处死小鼠并收集子宫,双侧子宫组织用4%多聚甲醛固定或于-80℃冰冻储存待用。
3.低氧探针检测:小鼠处死前30 min经腹腔给予低氧探针 60 mg·kg-1,并根据说明书对低氧探针进行免疫组化分析。随机选择P4撤退后不同时间点各组小鼠各3只的3张不同切片,随机拍摄5个视野(非重叠视野,不含肌层),采用图像处理程序Image J(https://imagej.nih.gov/ij/),计算各显微图像中 3,3-二氨基联苯胺(DAB)的染色面积比例。
4.免疫组化检测HIF1A蛋白:取出固定好的子宫组织切片脱蜡、复水,在95℃、pH 6.0的枸橼酸缓冲液中浸泡20 min以修复抗原,切片在3%的H2O2中浸泡15 min,核蛋白HIF1A单抗以1∶500稀释并在4℃下孵育过夜,洗涤之后用山羊抗兔增强二步法检测试剂盒室温孵育1 h,然后用DAB室温孵育1 min。每张切片随机拍摄5个视野(无重叠视野,无肌层),分别对每个视野的细胞数和HIF1A核染色的细胞进行计数。
5.Western Blot检测:用核蛋白提取试剂盒分别提取小鼠子宫冰冻样本的细胞核蛋白与细胞质蛋白,并加入适量蛋白酶抑制剂。单组蛋白的总量为15 μg,在4%~12% SDS-PAGE内进行凝胶电泳;转膜后,在5%脱脂牛奶中室温封闭1 h;随后用HIF1A单抗以1∶500稀释,β-Actin、Lamin-B 抗体分别以1∶2 000稀释为细胞质、细胞核内参,室温孵育3 h;用HRP标记的小鼠抗兔IgG抗体以 1∶10 000稀释与之杂交;然后用增强化学发光(ECL)试剂盒检测。
6.石蜡组织切片 HE染色:小鼠子宫组织在4%多聚甲醛固定72 h,制作常规石蜡切片。脱蜡后经梯度乙醇溶液水化,分别于苏木精染料室温染色1 min、1%盐酸乙醇溶液分化1 s、1%氨水乙醇溶液返蓝20 s、1%伊红染液复染2 min(每步染色操作后均用清水冲洗3次)。梯度脱水后用中性树胶封片,光学显微镜下观察并拍照。
四、统计学分析
应用SPSS 22.0统计软件进行数据分析。计量资料以平均数±标准差(x±s)表示,组间比较采用t检验,不符合正态分布的数据分析采用秩和检验。P<0.05为差异有统计学意义。
结 果
一、月经样小鼠子宫崩解过程中低氧与HIF1A的相关性
月经样小鼠P4撤退0 h 时,低氧探针定位于小鼠子宫腔上皮细胞、上皮下蜕膜基质细胞着床侧的一小片区域,HIF1A主要位于大部分蜕膜区域的胞质内,但在上皮下蜕膜基质细胞细胞核中也有HIF1A表达;月经样小鼠P4撤退8 h 时,低氧探针出现在整个蜕膜区,并不局限于上皮下区域,HIF1A在蜕膜基质细胞胞浆中表达增多,在细胞核中也有表达,尤其在管腔上皮细胞和蜕膜基质细胞中表达最多;月经样小鼠P4撤退12 h 时,低氧探针集中在完好的蜕膜组织与着床侧、坏死区外缘的交界处,蜕膜组织中HIF1A的表达位置与低氧探针一致;月经样小鼠P4撤退16 h 时,低氧探针集中在坏死区外缘,此时HIF1A的定位与低氧区相似,定位于多个细胞核;月经样小鼠P4撤退24 h时,低氧探针染色减少,仅在破裂区边缘和上皮细胞可见,在低氧区交界处的可见少量核染色细胞。免疫组化半定量结果显示,月经样小鼠P4撤退后12 h和16 h时小鼠子宫组织低氧探针染色面积百分比和HIFA的表达水平均显著高于 P4撤退0 h时(P<0.05)(图1、2)。

A:P4撤退后不同时间点低氧探针染色结果(免疫组化染色 ×100);B:P4撤退后不同时间点低氧探针染色面积百分比。与0 h比较,**P<0.01图1 P4撤退后不同时间点月经样小鼠子宫组织的低氧探针染色情况

A:P4撤退后不同时间点HIF1A染色情况(第一行图片为免疫组化染色 ×100,第二行图片免疫组化染色 ×400),箭头为HIF1A核染色细胞;B:P4撤退后不同时间点HIF1A核染色细胞百分比。与0 h比较,*P<0.05图2 P4撤退后不同时间点月经样小鼠子宫组织HIF1A的表达情况
二、月经小鼠崩解过程与低氧的关系


三、各组小鼠子宫组织细胞质和细胞核中HIF1A的表达情况


A:子宫大体形态结果;B:小鼠子宫形态(HE染色 ×100)C:小鼠子宫形态(HE染色 ×400)图3 P4撤退后24 h各月经样小鼠组的子宫大体和子宫组织形态结果

A:小鼠子宫组织低氧探针免疫组化染色;B:低氧探针染色面积百分比;C:小鼠子宫组织HIF1A免疫组化染色;D:HIF1A核染色细胞百分比。与组比较,*P<0.05图4 月经样小鼠注射CoCl2模拟低氧的效果
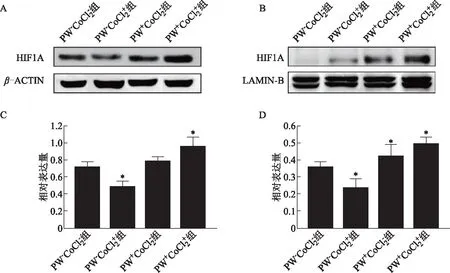
A:Western Blot检测细胞质中HIF1A的表达;B:Western Blot检测细胞核中HIF1A的表达;C:细胞质中HIF1A表达灰度分析;D:细胞核中HIF1A表达灰度分析。与组比较,*P<0.05图5 各组月经样小鼠子宫组织细胞质和细胞核HIF1A的表达情况
讨 论
本研究以小鼠月经样模型为基础,不仅证实了小鼠子宫在子宫内膜崩解中存在低氧状态,并进一步阐明了P4撤退、低氧和HIF1A在小鼠子宫内膜崩解中的作用。结果显示,P4撤退后子宫组织低氧区域从腔上皮细胞逐渐扩展到整个蜕膜区,并在P4撤退后12 h和16 h时低氧强度增加,提示低氧与子宫内膜崩解有关。另外,HIF1A在细胞核内的表达位置与低氧区域一致,特别是在P4撤退后12 h时,HIF1A的免疫组化染色区域与低氧探针染色区域高度重合。P4撤退后不同时间点的低氧变化情况,以及HIF1A核染色细胞百分比和分布情况与低氧的相关性,提示在子宫内膜崩解时低氧激活了HIF1A蛋白。
既往月经样模型相关研究显示,月经样小鼠子宫内膜在P4撤退后8 h内保持完整,24 h内子宫内膜达到完全崩解[12,14-15]。在P4撤退后12 h时回补P4可以抑制子宫内膜崩解,由此推断P4撤退后12 h为P4撤退的关键时期[16-17]。根据之前的研究,我们判定月经样小鼠子宫内膜崩解的时期为0~24 h[14-17]。有研究发现,在P4撤退后0 h、4 h、8 h和24 h可以观察到月经样小鼠子宫存在低氧状态[5,18]。Maybin等[6-7]支持月经期间子宫存在低氧的论断,并认为HIF1A可能是一种有效的、非激素性治疗月经大量出血的方法,提示HIF1A在月经异常出血中的重要性。
本研究以小鼠月经样模型为基础,通过更精细的时间进程(包括P4撤退后12 h和16 h),揭示了蜕膜化的子宫内膜存在低氧状态,低氧区域和P4撤退后激活的HIF1A定位有很强的相关性。在月经样小鼠模型中使用CoCl2模拟低氧状态结果显示,子宫内膜崩解是由P4撤退引起的,而不是由CoCl2模拟低氧引起的,即低氧参与子宫内膜崩解但不是必要因素。

