组织块法与酶消化法培养人脐带间充质干细胞的比较
袁涛,刘文杰,王蕾,王树玉,刘英*
(首都医科大学附属北京妇产医院,1.生殖医学科;2.产科,北京 100026)
间充质干细胞(Mesenchymal stem cells,MSC)存在于多种组织内,是组织工程和再生医学中理想的种子干细胞[1]。近年来,许多研究人员已经将注意力集中在脐带来源的MSC。人脐带间充质干细胞(Human umbilical cord mesenchymal stem cells,hUC-MSCs)应用于生物工程的优越性在于:(1)脐带是医疗废弃物,来源广泛;(2)分离、培养方法简便,易于传代扩增获取大量细胞;(3)脐带受到胎盘屏障功能的保护,被污染的可能性小;(4)脐带免疫原性低;(5)可塑性强;(6)无伦理及法律方面的争论[2-3]。与其他MSC一致,hUC-MSCs在适当的培养条件下可以被诱导分化成各胚层的功能细胞,如神经细胞、软骨和骨细胞、脂肪细胞、横纹肌细胞、胰岛分泌细胞、心肌细胞、生殖细胞等[4-7]。以上特性使hUC-MSCs成为科学家们的研究热点。
目前,hUC-MSCs的分离和培养方法尚无统一标准,对现有的方法进行比较分析,可帮助研究人员找到更合理有效的方法。本课题选择足月顺产中获得的新鲜脐带,用组织块法和酶消化法两种方法分离、培养hUC-MSCs,并对其进行传代扩增及鉴定,观察两种方法获得的细胞形态、生长曲线、免疫标志物等指标特征。
材料和方法
一、研究对象
选取本院产科自然分娩的健康足月新生儿5例,获得其双亲知情同意后取5根脐带组织,每根脐带均用两种方法分离hUC-MSCs。产妇无妊娠并发症,HBV、HIV、梅毒等抗体检测均为阴性。本研究获得首都医科大学附属北京妇产医院医学伦理委员会的审核批准。
二、主要试剂
MEM培养液、PBS 缓冲液(Gibco公司,美国),双抗、胰蛋白酶、Ⅱ型胶原酶、0.25%EDTA-胰蛋白酶(Sigma公司,美国),胎牛血清(Hyclone公司,美国),鼠抗人CD90-FITC、CD105-PerCP-CyTM、CD73-APC、CD44-PE、HLA-DR-PE、CD34-PE、CD19-PE、CD45-PE等抗体(BD Biosciences公司,美国)。其他试剂均为国产分析纯。
三、研究方法
1.hUC-MSCs的分离和原代培养:取新生儿脐带后及时放入含有1%双抗的PBS缓冲液内,4 h内用以下两种方法进行处理。(1)组织块法:将脐带用PBS洗涤数遍至白色后剪为2~3 cm的小段,去除脐带内的血管及被膜,将其剪为2~3 mm3的组织块,置于100 mm的培养皿内,加入hUC-MSCs培养液(MEM+10%胎牛血清),放入5% CO2、37℃的细胞培养箱内培养,每2~3 d换液。(2)酶消化法:按上述方法将脐带剪为2~3 mm3组织块,将其放在培养皿内,加入0.125%胰蛋白酶,37℃培养箱内消化20 min。终止消化后离心弃上清,按1∶8的比例加入0.075%Ⅱ型胶原酶,置于37℃水浴箱内消化1 h,每隔10 min晃动一次。洗涤后加入0.25%胰蛋白酶,37℃的水浴中消化0.5 h,离心弃上清,加入细胞培养液重悬,过滤,收集细胞悬液。将未消化的组织块继续重复之前的消化步骤,直至组织块基本消失。将细胞洗涤后重悬,接种于培养皿,37℃、5%CO2培养,每3 d换液。
2.hUC-MSCs的传代和扩增:当细胞铺满皿底的80%~90%时,弃上清(用组织块法原代培养则弃掉上清及组织块),PBS洗涤2次,加入0.25%EDTA-胰蛋白酶,于37℃培养箱消化3 min。终止消化,离心弃上清,加培养液重悬细胞,按1∶3接种培养,每天换液,3 d可进行下次传代。
3.细胞增殖活性检测:选取两种培养方法中生长状态较好的P0、P3细胞,按5×104/ml的密度接种于12孔板,置于5% CO2、37℃培养箱培养。P0细胞在接种后的d5、d7、d12、d15同一时间消化为单细胞悬液,P3细胞在接种后24 h、48 h、72 h消化为单细胞悬液,取少量细胞悬液,按1∶1的比例加入0.4%台盼蓝染液,显微镜下用细胞计数板计数未被染成蓝色的活细胞数。每次取3孔计数,取平均值。计算细胞倍增情况,绘制每组细胞的生长曲线。
4.流式细胞仪检测hUC-MSCs表面抗原:选取第3代生长活跃的细胞,0.25%EDTA-胰蛋白酶消化制备浓度为1×106个/ml的单细胞悬液,分别加入以下相应流式抗体:鼠抗人CD90-FITC、鼠抗人CD105-PerCP-CyTM、鼠抗人CD73-APC、鼠抗人CD44-PE、鼠抗人HLA-DR-PE、鼠抗人CD34-PE、鼠抗人CD19-PE、鼠抗人CD45-PE。4℃孵育30 min,PBS洗涤2次,重悬细胞,流式细胞仪上机检测。
四、统计学分析
结 果
一、两种方法原代培养hUC-MSCs的形态比较
使用组织块附着方法分离培养hUC-MSCs(图1A-D),在倒置显微镜下观察,组织块培养5 d后,在组织块周围可观察到散在的长梭形和纺锤形的细胞(图1B)。培养10 d后,每个小集落中的细胞数达到几百至几千(图1C),细胞形状逐渐变为均匀的纺锤形。约2周后,细胞在培养皿融合达80%以上。3次传代后,细胞生长旺盛,形态均一,成纤维样平行排列或放射状排列(图1D)。
使用酶消化法分离培养hUC-MSCs(图1E-H),5 d后在显微镜下见到细胞开始贴壁,呈短梭形及不规则形(图1F)。培养10 d后细胞形状逐渐变为长梭形(图1G)。约2周后,细胞在培养皿中达到40%~50%汇合。3次传代后,细胞大部分为长梭形,小部分为多角形(图1H)。

A-D:组织块法原代培养的第1天(A)、第5天(B)、第10天(C)和第3代细胞(D)(×40);E-H:酶消化法原代培养的第1天(E)、第5天(F)、第10天(G)和第3代细胞(H)(×40)图1 原代培养hUC-MSCs的细胞形态观察
二、两种方法原代培养hUC-MSCs的增殖活性比较
组织块法原代培养的hUC-MSCs第5天有细胞从组织块内爬出来,第7天开始呈指数增长,第15天细胞量是第5天的14倍左右;而酶消化法第5天时有少量细胞贴壁,第12天开始倍增。在原代培养的第7、12、15天两组细胞量均有统计学差异(P<0.05)(图2A)。组织块法培养的P3hUC-MSCs解冻后接种的当日即可贴壁达80%,第2天开始倍增,细胞呈指数增长,第3天细胞融合达90%;酶消化法培养的P3 hUC-MSCs解冻后接种的当日可贴壁达70%,细胞增殖速度较慢,第2天未见倍增,第3天细胞融合达50%。两组P3细胞在第48和72 h细胞量均有统计学差异(P<0.05)(图2B)。
三、两种方法原代培养hUC-MSCs的免疫特性分析
通过上述方法分离的hUC-MSCs被培养扩增并通过流式细胞术进行鉴定。组织块法分离培养的第3代(P3)细胞CD34、CD45、HLA-DR标志物呈阴性(<1%),而CD44、CD73、CD90和CD105标志物呈阳性(>95%)(图3A)。酶消化法分离培养的P3细胞CD34、CD45、HLA-DR、CD105标志物呈阴性(<1%),而CD73、CD90标志物呈阳性(>95%)(图3B)。
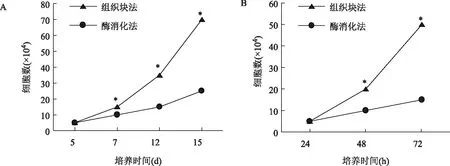
A:两种方法原代培养hUC-MSCs的增殖情况比较;B:两种方法P3代培养hUC-MSCs的增殖情况比较。同一时间点两组比较,*P<0.05图2 hUC-MSCs细胞增殖情况
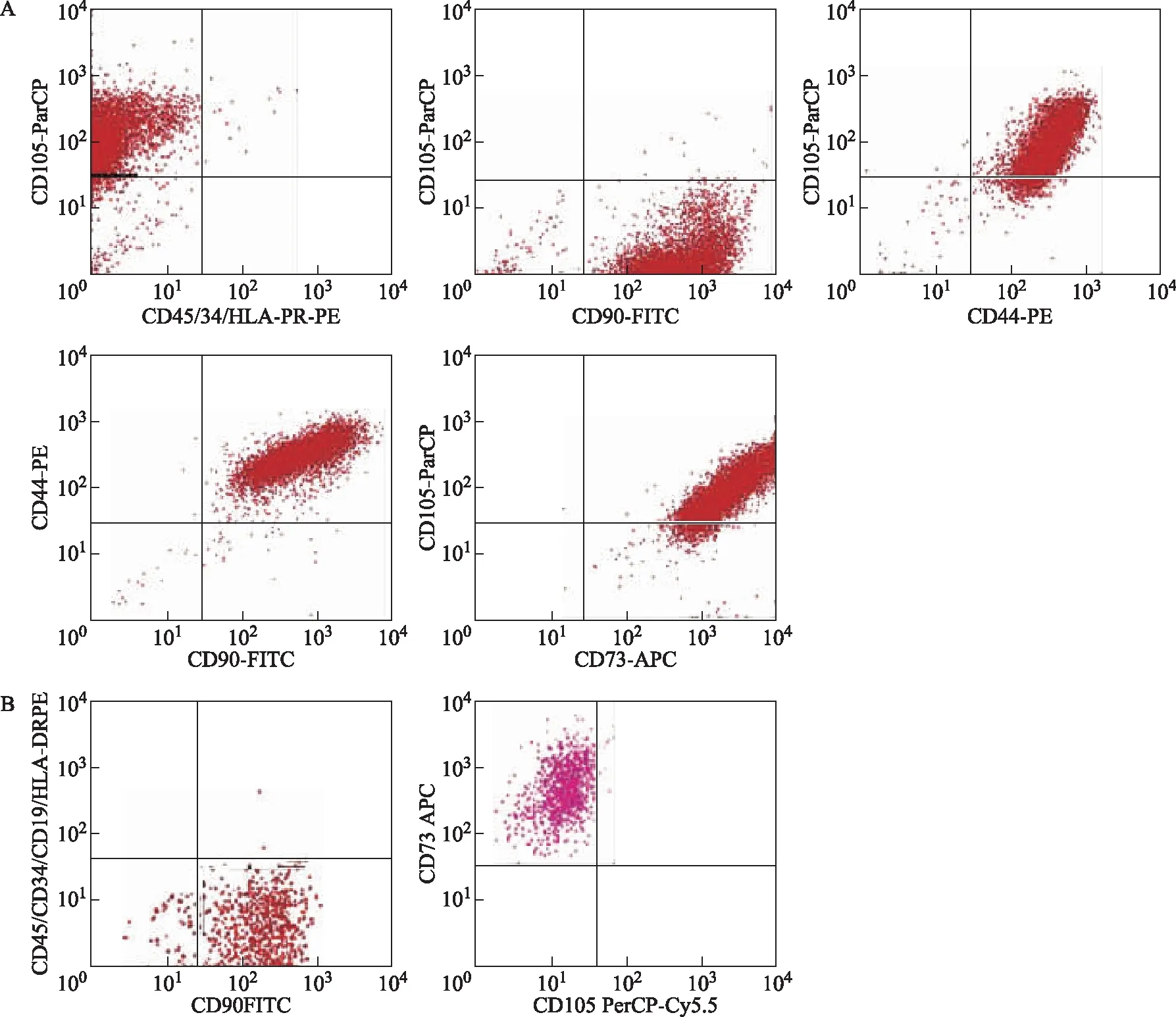
A:组织块法分离培养的P3细胞CD34、CD45、HLA-DR、CD44、CD73、CD90及CD105标志物表达;B:酶消化法分离培养的P3细胞CD34、CD45、HLA-DR、CD105、CD73及CD90标志物表达图3 流式细胞术检测hUC-MSCs免疫标志物表达
讨 论
一、两种培养方法的效果比较
人们越来越需要恢复、维持和增强器官功能的新技术。干细胞,尤其是MSC,已成为再生医学的新希望。MSC有高度的自我再生能力、多向分化潜能和免疫调节特性[8],可通过归巢到靶组织、修复受损细胞、刺激宿主细胞再生、自分泌、旁分泌作用及免疫调节作用治疗疾病[9]。hUC-MSCs来源于早期中胚层,具有多向分化的潜能,而且无伦理的争议,具有广阔的研究前景[10]。获取hUC-MSCs的方法主要有组织块法和酶消化法,选择合适的分离和培养方法是获得质量和产量最佳细胞的关键一步[8]。脐带的生理功能取决于其被膜与动静脉之间的华通胶组织中的丰富的MSC和胶原纤维,故进行原代培养时选取华通胶部分更能有效的培养出纯化的hUC-MSCs[10-11]。
本研究选取脐带华通胶组织,用组织块法和酶消化法两种方法进行了原代培养对比,发现:(1)从细胞最初生长来看,原代培养5 d后,组织块法可见细胞从组织块内呈放射状爬出,而酶消化法只可见少量形态不规则的贴壁细胞;(2)从细胞形态来看,组织块法的细胞形态相对一致,呈长梭形,可见细胞核,而酶消化法的细胞比较稀疏,呈多边形,细胞核不明显;(3)从细胞生长速度来看,组织块法的细胞培养2周左右,细胞融合可达到80%,而酶消化法的细胞培养2周后细胞融合才达到40%~50%。在王菲等[12]的研究中,组织块法与酶消化法分离培养的MSC增殖情况无显著差异,但在本研究中,组织块法分离的细胞增殖情况显著优于酶消化法(P<0.05)。从方法学上比较,组织块培养法要优于酶消化法,因为其更高效、廉价且简便。
二、两种培养方法优劣比较
在酶消化法中,细胞不但受到机械应力和蛋白水解的双重影响,而且酶处理还可能会降解细胞外基质和细胞膜黏附分子,使细胞分离后不易粘附在培养底物上,导致其不易贴壁[6]和粘附时间延长[13]。另外,胰蛋白酶也能影响细胞表面抗原、细胞形状、细胞骨架成分和细胞膜内颗粒分布。酶消化法在细胞存活力、细胞密度以及增殖效率等方面的结果取决于所用酶的类型和浓度[14],因此,选择合适的酶及控制酶的剂量和消化时间尤为重要[8]。而在组织块法中,细胞与相关组织一起从体内转移到体外,从某种意义上讲,细胞没有脱离原来的稳定环境,有助于更好地应对分离方法带来的损害;而且,组织块还可释放细胞因子和生长因子到培养基中,刺激细胞生长[15]。据报道,与酶消化法相比,组织块法可以收获更少的异种细胞群,并具有更高的增殖率和细胞活力[8];其次,组织块法无需使用胰蛋白酶,可降低培养的成本。但是,需要注意的是,组织块的大小将直接影响细胞培养的结果,减小组织块的体积有助于气体和营养物质向块内细胞扩散[7],但过度的切碎则会导致细胞的机械破坏,从而影响培养结果。
三、分离培养的hUC-MSCs连续传代能力的讨论
评估MSC在再生医学及组织工程上的应用前景,取决于其是否能在体外长期传代后仍能保持干细胞特性和多向分化能力。根据目前的报道,hUC-MSCs能否在体外长期传代并保持干细胞特性和多向分化能力,仍无明确结论,尚需进一步研究。有报道,经过组织块分离培养法获得的hUC-MSCs可稳定传代并保持干细胞的特性,且其染色体核型仍能保持正常。但另有研究发现,hUC-MSCs在体外培养长时间后细胞形态会发生改变,早期细胞大多呈长梭形,传至P20后出现呈多角不定形且体积变大的细胞,胞浆也明显增加[10]。体外的传代扩增会增加MSC的衰老和老化,主要表现为MSC表面标志物的表达降低、标志物的改变、细胞表型的改变和多向分化潜能的丧失[16]。本实验结果显示,将组织块法分离的hUC-MSCs连续传代至P10时形态仍保持长梭形,且仍能保持MSC特性,与报道一致[17]。
四、hUC-MSCs表面标志物检测结果的讨论
表面标志物是鉴定hUC-MSCs的关键,体现细胞的一些基本特征,并与细胞功能相关。MSC的CD29、CD44、CD90、CD73、CD105和人类白细胞抗原(HLA)-ABC呈阳性,内皮细胞标志物CD31、造血细胞标志物CD34、CD45、CD117和HLA-DR呈阴性[2]。本研究选取生长状态较好的P2、P3 hUC-MSCs,用流式细胞仪检测其表面标志物。组织块法分离培养的hUC-MSCs其CD44、CD73、CD90和CD105表达呈阳性,CD34、CD45、HLA-DR表达呈阴性,与MSC表面标志物表达一致。而酶消化法分离培养的hUC-MSCs其CD73、CD90表达呈阳性,而CD105呈阴性,CD34、CD45、HLA-DR标记物亦呈阴性。CD105呈阴性的结果与之前的报道有所不同[4],可能是由于本实验中胰酶消化时间过长或浓度过高导致,需进一步研究。据报道,分离和传代培养方法的差异可能导致其表面标志物基因表达不同[18]。在Salehinejad等[7]研究中,组织块法所获得的细胞与酶消化法相比,其CD73的表达更高;用胶原酶/胰蛋白酶法所获得的细胞与用胶原酶/透明质酸酶/胰蛋白酶法相比,CD90的表达更高。CD44、CD73、CD90及CD105是MSC表面的特异抗原,已被认为是鉴定hUC-MSCs的重要标记[4,19]。CD34是造血干细胞的标志分子,CD45是白细胞共同抗原,本实验培养的hUC-MSCs不表达CD34和CD45,不表达HLA-DR,说明分离出的hUC-MSCs免疫原性弱,不容易引起免疫排斥反应,异体移植几乎不受影响,有可能适宜不同个体之间的移植[20-21]。
五、经验总结
合理而规范的培养方法对于获得hUC-MSCs非常重要,本实验室的经验及教训总结如下:(1)脐带的处理:处理脐带时应完全去除被膜和血管,因被膜会影响细胞贴壁,而血管会影响细胞纯度;(2)组织块的接种:组织块有三种平面即靠近血管面、靠近被膜面、及剪刀切面,本实验室分别将3种平面朝下贴于培养皿以培养细胞,发现以靠近血管面贴壁的组织块贴壁较其他两种更牢固、细胞爬出更快、以及细胞量更多;(3)组织块的大小:组织块大小在2~3 mm3时细胞爬出更快、细胞量更多;(4)原代培养:培养时应先在每个组织块上加一滴培养基后放于孵箱中,给予组织块充分的时间来贴壁,4 h后可补充培养基,加液量以可铺满皿底但不没过组织块为宜,换液时应稍稍倾斜培养皿,防止组织块脱离;(5)培养基的选用:本实验室曾比较DMEM+10%FBS和MEM+10%FBS两种培养基培养细胞,发现MEM+10%FBS培养的组织块细胞爬出时间早、细胞量多;(6)细胞的传代:细胞生长密度达100%时会接触抑制,继续生长会成簇聚集,最终脱离皿底,因此在细胞生长密度达80~90%时应及时传代;另一方面,hUC-MSCs会分泌功能因子相互作用促进增长,因此接种细胞时密度不宜过低,否则会影响细胞分裂增殖;(7)细胞的冻存:细胞冻存密度应在1~5×106为宜,过多或过少均会导致细胞复苏率低。
综上,我们的结果表明,与酶消化法相比,组织块培养法能获得较纯的hUC-MSCs,且方法简单,成本低,是大量获得hUC-MSCs的理想培养方法。

