ANGPTL8在大鼠着床后雌激素短暂缺乏胎盘中的表达及其对人脐静脉内皮细胞功能的影响
祝立权,孙明明,梁敏,刁天,杨丽君,张欣,刘婷婷,汪坤,鲁聪,陈西华,徐祥波,贺斌*
(1.国家卫生健康委科学技术研究所 国家卫生健康委生殖健康工程技术研究中心,北京 100081;2.北京协和医学院研究生院,北京 100730)
雌激素和孕激素是重要的甾体类激素,对于妊娠起始、妊娠中胎盘功能的维持、胎儿生长发育以及分娩发动都起着重要作用[1]。雌激素的缺乏会导致各种并发症和不良的妊娠结局。
雌二醇(E2)刺激体内外内皮细胞增殖[2-4],增强人脐静脉内皮细胞(HUVEC)对各种基质蛋白的粘附,促进细胞迁移,从而促进血管生成[2,5]。胎盘是母亲和胎儿进行营养物质和代谢废物交换的重要结构,完善的胎盘血管网络能够使这种交换活动正常进行。前期研究结果显示,在着床后短暂抑制雌激素造成了实验组大鼠胎盘连接区呈现异常增生,迷路区血流交换不足,影响了妊娠晚期胎盘的正常发育[6],但具体机制尚不清楚。
血管生成素样蛋白8(ANGPTL8)是血管生成素样蛋白(ANGPTLs)家族新发现的一种蛋白,与ANGPTL1~7不同的是它只有N端结构域,并且与ANGPTL3和ANGPTL4表现出同源性[7],可以与脂蛋白脂肪酶(LPL)结合调节甘油三酯(TG)的代谢[8]。妊娠并发症常常伴有糖脂代谢的异常,本研究旨在探索大鼠着床后雌激素短暂缺乏胎盘中ANGPTL8的表达及对HUVEC功能的影响。
材料与方法
一、实验动物
SPFⅡ级Wistar雄性大鼠15只(8~10周龄),SPFⅡ级Wistar雌性大鼠(8~10周龄)40只,购于北京维通利华实验动物技术有限公司。Wistar大鼠均自由进食和饮水,饲养条件恒温恒湿,光照和黑暗时间均为12 h。所有实验相关操作均符合国家卫生健康委科学技术研究所动物伦理委员会的相关规定。
二、实验方法
1.大鼠胚胎着床后短暂雌激素缺乏模型的建立:雌雄大鼠按照1∶1的比例于当日21:00合笼,次日上午9:00见阴栓记为妊娠0.5 d(GD 0.5)。实验组雌性大鼠(n=20)在GD 6.5~GD 8.5的上午9:00按照每只0.16 mg·kg-1·d-1的剂量灌胃雌二醇(E2)抑制剂来曲唑(Femara,诺华制药,瑞士);对照组雌性大鼠(n=20)在相同的时间点灌胃等量溶剂(羧甲基纤维素钠,北京化学试剂)。在GD 8.5和GD 19.5的上午9:00处死大鼠,分别取着床点(GD 8.5)和胎盘(GD 19.5)组织冻存于-80℃,用于提取组织蛋白质和RNA。
2.检测Angptl8 mRNA的表达:向样本组织中加入Trizol以提取组织中的总RNA,使用逆转录试剂盒(RR037A,Takara,日本)进行反转录,获取cDNA。使用实时荧光定量PCR(RT-qPCR)试剂盒(RR820A,Takara,日本)进行Real-time PCR反应,Angptl8正向引物为5′-CCACCTCTTGTGGGCTCTCAC-3′,反向引物为5′-TCTCTGCTGGATCTGCCGCA-3′,内参为β-actin,40个循环扩增后采用2-ΔΔCt法计算结果。
3.Western blot检测ANGPTL8蛋白的表达:提取样本组织中总蛋白;使用BCA蛋白定量试剂盒(Thermo Scientific,美国)测定组织中总蛋白的浓度;使用SDS-PAGE凝胶配制试剂盒(上海碧云天)配制10%凝胶,上样(加样体积为20 μl),电泳,转膜,10%脱脂奶粉室温封闭后,将ANGPTL8蛋白抗体(1∶1 000;Novus,美国)和β-actin抗体(1∶3 000;Proteintech,美国)分别与山羊抗兔二抗(1∶4 000;Cell Signaling,美国)孵育1.5 h;使用超敏ECL化学发光液试剂盒(苏州新赛美)进行发光显影。用Image J分析蛋白条带。
4.细胞培养与分组:人脐静脉内皮细胞(HUVEC,北京协和细胞资源中心)用ECM培养基(Sciencell,美国)进行常规培养,培养条件37℃、5%CO2。添加不同浓度的重组人ANGPTL8(Novus,美国)处理HUVEC,使其终浓度分别为0、1、2、4、8 nmol/L,每组设5个复孔,其中0 nmol/L组为对照组。
5.细胞划痕实验:将生长状态良好的细胞接种于6孔板中,接种密度为5×105/ml,并置于37℃、5%CO2培养箱中培养12 h。次日用无菌枪头在培养皿底部划出水平划痕,用PBS清洗划下的细胞,清洗3次;然后加入无血清培养基放在37℃、5%CO2培养箱中培养,在0、12、24、48 h拍照记录;采用Image J软件对结果数据进行分析。
6.细胞侵袭实验:将Matrigel基质胶(BD,美国)用无血清培养基稀释15倍,100 μl/孔平铺于Transwell小室内,并置于37℃、5%CO2细胞培养箱中孵育2 h待其充分凝固;按照1×105/ml的比例将细胞悬液加入到Transwell上室内,每孔100 μl,在下室中加入600 μl完全培养基,放入37℃、5%CO2细胞培养箱中孵育12、24 h;用1×PBS清洗后加入甲醇固定细胞15 min;2.5%的结晶紫染液染色15 min,洗净小室,用棉签轻轻拭去小室内侧细胞,倒置风干后用倒置显微镜观察记录Transwell小室内5个视野内的细胞数量。
7.血管生成实验:将预冷的Matrigel基质胶按照每孔50 μl的体积快速铺于96孔板中,然后置于37℃、5%CO2培养箱中静置2 h,待其充分凝固,按照2×105/ml的比例将细胞悬液加入到96孔板中,每孔100 μl,继续培养4~6 h,观察各组细胞的成管情况,并随机选择6个视野进行拍照,采用Image J软件对成管情况进行分析。
三、统计学分析
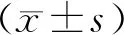
结 果
一、着床点和胎盘组织中Angptl8 mRNA以及蛋白的表达
在GD 8.5时,实验组着床点Angptl8 mRNA的表达水平显著高于对照组(P<0.05);而在GD 19.5时,实验组与对照组胎盘组织中Angptl8 mRNA的表达无显著差异(P>0.05)(图1)。
与对照组比较,*P<0.05图1 大鼠着床点(GD8.5)和胎盘组织(GD19.5)中的Angtpl8 mRNA表达
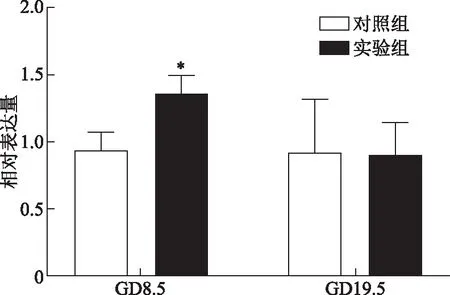
在GD 8.5时,实验组着床点ANGPTL8蛋白的表达水平显著高于对照组(P<0.05);在GD 19.5时,实验组胚胎组织中ANGPTL8蛋白的表达水平显著高于对照组(P<0.01)(图2)。
A:GD8.5着床点组织;B:GD19.5胎盘组织;C:ANGPTL8蛋白的相对表达量。与对照组比较,*P<0.05,**P<0.01图2 大鼠着床点(GD8.5)和胎盘组织(GD19.5)中的ANGPTL8蛋白表达
二、ANGPTL8对HUVECs功能的影响
1.ANGPTL8对HUVECs迁移的影响:在ANGPTL8对HUVECs处理24 h后,与对照组(0 nmol/L组)比较,ANGPTL8的浓度越高,划痕的间隔越大,提示HUVECs的迁移率显著降低(P<0.01)(表1、图3)。

图3 不同浓度ANGPTL8对HUVECs细胞迁移的影响

表1 不同浓度ANGPTL8对HUVECs迁移的影响(-±s)
2.ANGPTL8对HUVECs侵袭的影响:与对照组(0 nmol/L组)比较,不同浓度ANGPTL8分别处理HUVECs 12 h和24 h后,HUVECs细胞侵袭数目均随着ANGPTL8浓度的升高而显著降低(P<0.05)(表2、图4)。
图4 不同浓度ANGPTL8对HUVECs细胞侵袭的影响(结晶紫染色 ×100)

表2 不同浓度ANGPTL8对HUVECs侵袭的影响(-±s)
3.ANGPTL8对HUVECs成管的影响:与对照组(0 nmol/L组)比较,不同浓度ANGPTL8处理HUVECs后,HUVECs细胞成管数目随着ANGPTL8浓度的升高而显著降低(P<0.01)(表3、图5)。

图5 不同浓度ANGPTL8对HUVECs细胞成管的影响(×100)

表3 不同浓度ANGPTL8对HUVECs成管的影响(-±s)
讨 论
胎儿的健康发育有赖于营养物质和氧气通过胎盘的传递,胎盘适当的血管化和灌注(胎盘血管生成)对于胎盘的发育和成熟至关重要。胎盘血管发育和适应性的破坏与不良妊娠结局有关,包括先兆子痫、胎儿宫内发育迟缓、死胎等。前期研究中发现,在大鼠着床后短暂雌激素缺乏模型中,胎盘迷路区血管网发育呈现异常,然而雌激素仅在妊娠早期偏低,在妊娠中后期雌激素水平并无显著差异,提示雌激素并不是导致胎盘发育异常的直接原因[1,9]。因此在雌激素短暂缺乏下,胎盘发育异常的机制需进一步研究。
ANGPTL8是ANGPTLs家族成员之一,是一种具有198个氨基酸的22 kDa蛋白[7]。ANGPTL1~7由常见的结构域包括氨基端(N-末端)信号肽、N-端卷曲螺旋结构域(CCD)、羧基末端(C-末端)纤维蛋白原样结构域组成(FLD)和连接区域,但是ANGPTL8缺少C端FLD[10],它和ANGPTL3与ANGPTL4具有相同的N端结构域。ANGPTL8和ANGPTL3与ANGPTL4形成复合物的形式共同参与调节脂蛋白脂酶(LPL)的活性,进而调节甘油三酯(TG)代谢,ANGPTL8被认为是ANGPTL家族里一种新颖但非典型的成员并且能够在脂质代谢中发挥作用的蛋白质[7,10-11]。有研究显示,ANGPTL3/8复合物蛋白比为3∶1,ANGPTL4/8复合物蛋白比为1∶1,通过形成复合物,ANGPTL3/8的LPL抑制活性比ANGPTL3强100倍以上,而ANGPTL4/8的LPL抑制活性比ANGPTL4弱100倍以上[12]。
本研究发现,在胚胎着床后短暂抑制雌激素后的胎盘发育过程中,GD 8.5和GD 19.5时实验组着床点及胎盘组织中蛋白的表达水平均高于对照组,但实验组Angptl8 mRNA仅在GD 8.5的着床点组织中表达升高,而在GD 19.5时,Angptl8 mRNA在实验组与对照组胎盘组织中的表达无显著差异,提示ANGPTL8蛋白的升高可能不是由胎盘组织表达增强的原因,更可能是来自子宫组织合成或来自母体循环。我们利用重组人ANGPTL8分子研究了其对HUVEC细胞功能的影响,结果显示,随着ANGPTL8浓度的升高,其对HUVECs的迁移、侵袭和成管产生了抑制作用且有剂量依赖性,这表明ANGPTL8的上调抑制了大鼠胚胎着床后短暂雌激素缺乏模型中胎盘血管网的正常发育。原因可能是高浓度的ANGPTL8通过影响ANGPTL3/4复合体对LPL的抑制作用进而抑制甘油三酯水解,从而影响到血管内皮的功能,具体机制包括ANGPTL8升高的原因有待于进一步深入研究。另一方面,有流行病学研究表明,外周循环的ANGPTL8水平在代谢性疾病,包括糖尿病、肥胖和代谢综合征中发生变化,呈现高水平[13]。不仅如此,有研究显示在患有妊娠期糖尿病的孕妇中,胎儿脐带血中的ANGPTL8水平高于母体血清中的ANGPTL8水平,提示母体和脐带血ANGPTL8的增加可能是增强妊娠期糖尿病患者胰岛素需求的补偿机制[14]。有关ANGPTL8在病理性妊娠中的作用机制仍有待进一步研究。
胎盘发生过程中新生血管生成的过程称为血管生成,起始于胚外中胚层尿囊中内皮祖细胞(成血管细胞)的形成[15],完善的胎盘血管网络是母体和胎儿之间进行物质交换的保证。胎盘血管生成异常会产生不良的妊娠结局以及母亲和胎儿患有各种并发症。因此,通过研究在雌激素缺乏下ANGPTL8对胎盘发育的影响机制,有助于为妊娠并发症以及各种不良妊娠结局提供预防和治疗的手段。

