CRNDE调节miR-126-5p减弱患儿脓毒症脑损伤的机制研究
张晶 代思华 王晓岩 谷丽彩 黄蕊 任常军
脓毒症是指由感染因素引起的全身炎性反应综合征,严重时可导致器官功能障碍[1]。脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)是脓毒症患者严重的中枢神经系统并发症。主要表现为为记忆力下降,注意力不集中,定向障碍,易激惹,精神恍惚甚至昏迷等不同程度的认知功能障碍。其发病机制可能与脑血管功能障碍、氨基酸及神经递质异常、炎性损伤、氧化刺激和谷氨酸兴奋毒性等有关[2]。在脓毒症介导的脑损伤发生发展过程中伴随多种基因、RNA、蛋白的表达改变和功能异常,而有效调节这些异常的分子表达可能减轻脓毒症介导的脑损伤。长链非编码RNA(lncRNAs)和微小RNA(microRNAs)同属于非编码RNA,其异常表达及相互作用在肿瘤的发生发展过程中发挥重要作用,可能是脓毒症新的治疗靶点[3,4]。结直肠肿瘤差异表达(colorectal neoplasia differentially expressed,CRNDE)是结直肠肿瘤差异表达长链非编码RNA,在许多癌组织和癌细胞中表达出现异常[5,6]。miRcroRNA-126-5p (miR-126-5p)由人类染色体转录的前体RNA剪切而来,miR-126-5p作为微小RNA在宫颈癌、非小细胞中表达下调[7,8],然而,CRNDE和miR-126-5p在脓毒症患儿脑损伤中作用的研究较少。本研究研究CRNDE在脓毒症患儿脑损伤中的功能和作用机制,为临床上治疗脓毒症患儿相关性脑损伤提供新的理论依据。
1 资料与方法
1.1 一般资料 选取2017年1月至2019年1月本院收治的30例脓毒症诱导脑损伤患儿作为研究对象,其中男11例,女19例;年龄2个月~10岁,平均(4.51±1.63)岁。同时,健康对照组30例,均为同期本院儿童保健科体检的健康儿童,其中男12例,女18例;年龄2个月~10岁,平均(5.19±2.14)岁。在研究开始之前,所有参与者家长签署了知情同意书,并经过医院伦理委员会讨论通过。
1.2 试剂与仪器 TRIzol购自美国Invitogen公司,DMEM和胎牛血清购自美国Biological Industries公司,CCK-8试剂盒购自武汉华美生物工程有限公司,双荧光素酶检测试剂盒购自Promega公司,RNA提取试剂盒和定量PCR试剂盒SYBR premix Ex TaqTM购自日本TaKaRa公司。
1.3 细胞培养 根据资料[9]培养原代星形胶质细胞。取1~2 d新生的C57小鼠,小心分离出大脑皮质脑组织,采用适量0.125%的胰蛋白酶消化脑组织,后用10%FBS的完全培养基终止消化,离心后加入适量20%FBS的完全培养基重悬脑组织,按照每个T75培养瓶接种10 ml悬液的量接种,在37℃恒温培养箱中培养;24~36 h后弃培养基,用无菌DMEM培养基轻柔洗涤2次,连续培养10~12 d后,在光学显微镜下可见大量折光性强的细胞,以200 r/min的速度在37℃恒温摇床上连续摇晃30 min,使强折光细胞脱落;倒掉培养瓶中细胞悬液,1 000 r/min离心5 min,加入适量10%完全培养基重悬并接种到细胞板中并待用;留在培养瓶的细胞绝大多数为星形胶质细胞,采用上述方法摇晃细胞3次,以去除残留的小胶质细胞和少突胶质细胞,加0.25%胰蛋白酶消化并接种后留用。采用10 μg/ml LPS(Sigma,St.Louis,MO,USA)处理HSAECs细胞24 h,刺激体外LPS诱导脓毒症模型。
1.4 细胞转染 将经LPS处理的HSAECs细胞以 5×106/cm2接种于6孔板,保证转让时细胞汇合度>80%。miR-195-5p mimics,miR-195-5p inhibitors,CASC9过表达质粒,sh-CASC9购于广州RiboBio Co,Ltd.(Guangzhou,China)。转染操作严格按照Lipofectamine 2000(Invitrogen,California,USA)试剂盒说明书进行操作。用qRT-PCR检测转染效率。
1.5 实时荧光定量聚合酶链反应 从组织和细胞中提取RNA,采用Promega公司逆转录试剂盒,按操作说明进行将RNA逆转录成 cDNA。根据制造商的说明,RT-RCR是在ABI 7500实时PCR系统上与SYBR premix EX TAQ II一起进行的。以GAPDH和U6为内参分别检测CRNDE和miR-126-5p的表达水平,并用2-ΔΔCt法进行统。其中:CRNDE的引物序列正向:5’-GAGGACGTGCTGGGGCT-3’,反向 5’-CTGAGTCCATGTCCCGAATC-3’;miR-126-5p的引物序列是正向5′-ACACTCCAGCTGGGTCGTACCGT-GAGTAAT-3’,反向5’-TGGTGTCGTG-GAGTCG-3’;内参U6的引物序列是正向5’-CTCGCTTCGGCAGCACATATACT-3’,反向5’-ACGCTTCACGAATTTGCGTGTC-3’。内参GAPDH的引物序列是正向5’-AGCCACATCGCTCAGACAC-3’,反向5’-GCCCAATACGACCAAATCC-3’。
1.6 双荧光素酶报告基因法 野生型CRNDE及突变型CRNDE的目的片段被构建并整合入pGL3 vector (Promega,Madison,WI,USA)以构建 pGL3-CRNDE-wild type (CRNDE-wt)和pGL3-CRNDE-mutant (CRNDE-mut) reporter vector。将CRNDE-wt或CRNDE-mut与miR-126-5p mimics或阴性对照物共转染细胞。转染48 h后,检测荧光素酶活性。每组各设3个重复孔,重复3次。
1.7 MTT法 第1天将星形胶质细胞种在96孔培养板中(5×103细胞/孔),第2天细胞密度达到约70%时,按LipofactamineTM2000说明书进行转染。分别在转染24 h进行MTT检测。每孔加入MTT(5 g/L)10 μl,继续孵育4 h,弃培养液后再加入甲基亚砜(DMSO),避光振荡10 min至结晶充分溶解,空白对照调零,并用酶标仪测定570 nm波长处吸光度值。
1.8 免疫印迹(Western Blot) 免疫印迹检测凋亡相关的B淋巴细胞瘤-2基因(Bcl-2)和BCL2-Associated X蛋白(Bax),以及NF-κB、Keap1、Nrf2的表达情况。将转染的星形胶质细胞培养48 h。收集细胞,加入RIPA裂解重悬细胞,超声破碎、1 200 r/min,4℃条件下离心10 min,按照BCA试剂盒(Thermo, Shanghai, China)说明书测定总蛋白浓度。每个样本取30 μg经SDS-PAGE凝胶电泳分离后转至PVDF上。5%脱脂牛奶封闭PVDF膜60 min,加入相应比例的一抗Anti-Bcl-2 antibody (ab196495, Abcam,1∶1 000)、Anti-Bax antibody (WL01637,Wanleibio, 1∶1 000),Anti-NFkB p105/p50 antibody (ab32360, Abcam, 1∶1 000)、Anti-Keap1 antibody(ab196346,Abcam,1∶1 000)、Anti-Nrf2 antibody(ab137550, Abcam ,1∶1 000) 4℃下过夜,洗膜后加入相应的二抗,室温孵育120 min,滴加显影液显影,观察条带。实验重复3次。GAPDH为内参。
1.9 酶联免疫吸附试验(ELISA) 肺组织称重后,加入含有蛋白酶抑制剂的裂解液进行匀浆,4℃下14 000 g离心25 min,留取上清液。ELISA试剂盒(Invitrogen,Waltham,MA,USA)分别检测细胞上清液肿瘤坏死因子TNF-α(tumornecro sisfactor,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、氧化应激因子(SOD、MDA)的含量,严格按试剂盒要求操作,具体步骤:(1)包被过程(设置空白对照,阴性对照):将所用抗原用包被稀释液稀释到适当浓度,每孔抗原加入100 μl,置37℃,4 h,弃去孔中液体。(2)封闭酶标反应孔:5%小牛血清置37℃封闭40 min。封闭时将封闭液加满各反应孔;封闭结束后用洗涤液满孔洗涤3遍,每遍3 min。(3)加入待检细胞上清液:将稀释好的细胞上清液加入酶标反应孔中,每样品至少加3孔,每孔100 μl,置于37℃,60 min。然后,用洗涤液满孔洗涤3遍,每遍3 min。(4)加入酶标抗体:根据说明书稀释,每孔加100 μl ,37℃,40 min。然后,用洗涤液满孔洗涤3遍,每遍3 min。(5)加入底物液(现用现配):每孔100 μl,置37℃避光放置5 min。(6)终止反应:加入终止液显色,每孔加入终止液50 μl终止反应,于20 min内测定实验结果。(7)结果判断:酶标仪于490 nm读取吸光度值。
2 结果
2.1 在脓毒症脑损伤患儿血清中CRNDE下调,而miR-126-5p上调 RT-PCR结果显示,在脓毒症患儿血清中CRNDE的水平显著下调(P<0.01),而miR-126-5p的水平上调(P<0.01)。见表1。

表1 2组CRNDE和miR-126-5p表达水平比较
2.2 上调CRNDE对LPS诱导的星形胶质细胞增殖的影响 LPS显著降低了星形胶质细胞细胞中CRNDE的表达水平(P<0.05)。我们采用MTT法检测了10 μg/ml LPS诱导的星形胶质细胞培养24 h的吸光度值,结果显示,在LPS诱导的星形胶质细胞中过表达CRNDE后,星形胶质细胞的增殖水平上调(P<0.05)。见表2、3。

表2 RT-PCR检测星型胶质细胞CRNDE的表达水平

表3 RT-PCR和MTT法检测LPS诱导的星型胶质细胞CRNDE的表达水平
2.3 上调CRNDE对LPS诱导的星形胶质细胞凋亡的影响 在探究了上调CRNDE对LPS诱导的星形胶质细胞增殖的影响后,我们探究了上调CRNDE对LPS诱导的星形胶质细胞凋亡的影响,Western blot结果显示,上调LPS诱导的星形胶质细胞中CRNDE的水平后,细胞中Bax的水平显著下调,而Bcl2的水平上调。见图1。
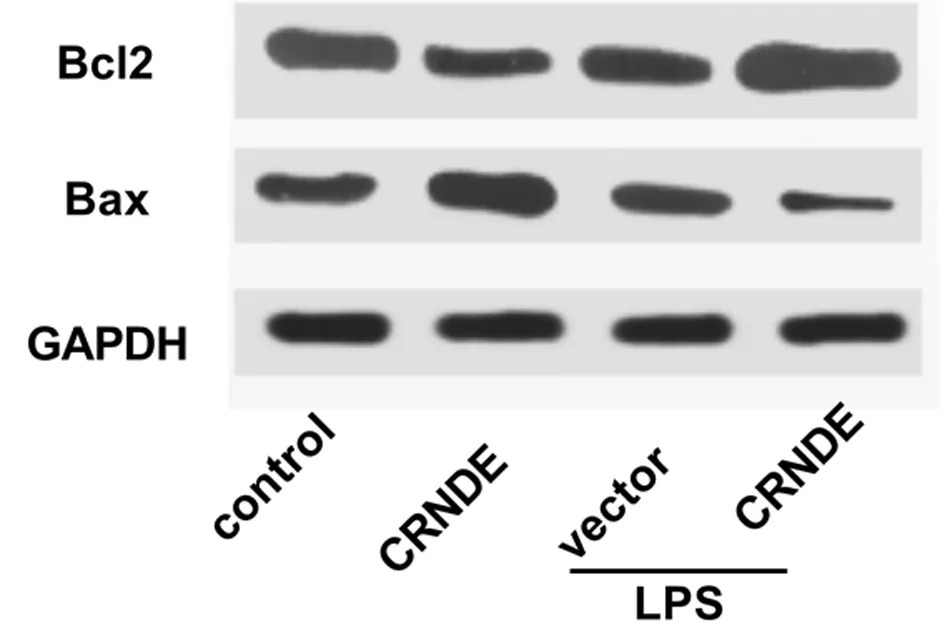
图1 LPS诱导的星形胶质细胞凋亡相关蛋白表达情况
2.4 上调CRNDE对炎性因子和氧化应激因子的影响 为了进一步探究CRNDE在脓毒症脑损伤中的作用,我们检测了LPS介导的星形胶质细胞中炎症因子(TNF-α、IL-1β)、炎症相关蛋白(NF-κB)、氧化应激因子(SOD、MDA)、氧化应激相关蛋白(Keap1、Nrf2)的水平。ELISA和western blot结果显示,上调CRNDE后,LPS介导的星形胶质细胞中TNF-α、IL-1β、NF-κB、MDA、Keap1的水平下调,而SOD和Nrf2的水平上调(P<0.05)。见表4,图2。
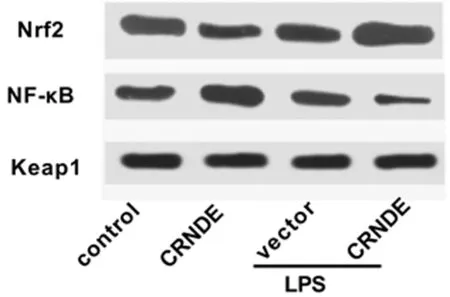
图2 LPS介导的星形胶质细胞中炎症、氧化应激相关蛋白的表达情况

表4 ELISA法检测LPS介导的星形胶质细胞分泌炎症、氧化应激相关因子的水平
2.5 CRNDE靶向miR-126-5p 为了进一步探究CRNDE调控AHI的下游分子机制,我们通过StarBase数据库(http://www.starbase.com)进行了生物信息学分析,数据显示CRNDE含有miR-126-5p的保守结合位点。为了进一步验证CRNDE与miR-126-5p的结合关系,我们采用双荧光素酶报告法进行检测。双荧光素酶报告试验表明,miR-126-5p模拟物可降低含CRNDE-wt的荧光素酶报告体的荧光素酶活性,而对CRNDE-mut载体的荧光素酶活性没有显著影响(P<0.05)。见图3,表5。

图3 生物信息学数据显示CRNDE含有miR-126-5p的保守结合位点

表5 双荧光素酶报告试验验证CRNDE与miR-126-5p的结合关系
3 讨论
脓毒症介导的脑损伤由多种炎性介质和效应细胞共同调控,其潜在机制是肺巨噬细胞产生过度表达的促炎性细胞因子和炎性介质导致机体的免疫紊乱[10]。核因子-κB(NF-κB)能调节多种参与缺血再灌注损伤的细胞因子、炎性介质、黏附分子的基因转录过程,从而控制它们的生物合成,在炎性反应中起着非常关键的作用[11]。有研究表明,脓毒症多器官功能障碍及损伤时常伴有NF-κB信号转导通路的上调活化[12]。在本研究中,我们发现脓毒症ALI大鼠血清中TNF-α、IL-1β表达水平显著上调,NF-κB活性明显升高,这与以往报道一致。此外,脓毒症不仅与炎性反应有关,而且与活性氧(ROS)的产生和抗氧化因子表达失衡有关[13,14]。
Keap1(Kelch-like ECH-as-sociated protein 1)是一种细胞质肌动蛋白结合蛋白,Nrf2-Keap1是机体氧化应激系统重要的信号通路[15]。生理状态下,细胞质中的Nrf2和Keap1相结合并处于相对抑制状态而不会从胞浆进入胞核内激活下游信号,当受到ROS和亲电子刺激,发生氧化应激时,Nrf2和Keap1解离,Nrf2转移到细胞核内与下游ARE结合,启动ARE下游的抗氧化蛋白或促氧化蛋白合成酶等基因转录和表达以抵抗内外界的有害刺激[16]。
在本研究中观察到,在脓毒症患儿血清中中氧化应激指标MDA显著上调,SOD下调,氧化应激相关蛋白Keap1上调,而Nrf2下调,进一步证实了脓毒症可以介导显著的炎性反应和氧化应激反应。
研究报道,高表达lncRNA NEAT1与脓毒症患者的风险增加、预后不良、促炎细胞因子的高表达显著相关[17]。有趣的是,lncRNA Lethe在脓毒症脑损伤中表达下调,能够通过调节皮层神经元的自噬减弱脓毒症介导的脑损伤[18]。近年来,CRNDE在炎症的进展中发挥了重要的作用,例如,CRNDE通过上调WI-38细胞中的FOXM1加速了LPS诱导的细胞凋亡和炎症[19]。在本研究中,我们首先发现CRNDE抑制脓毒症相关性脑损伤的进展。
在脾巨噬细胞中miR-146a可减弱炎症和脓毒症引起的多器官损伤[20]。厚朴醇通过靶向调节miR-218-5p/血红素加氧酶-1信号通路减轻脓毒症诱导的急性肾损伤[21]。miR-126-5p通过抑制慢性HIV-1感染中的圆柱状瘤,增强单核细胞对脂多糖刺激的炎性反应[22]。在本研究中,我们首先发现miR-126-5p在脓毒症患儿血清和LPS作用的星形胶质细胞中表达显著上调,而过表达miR-126-5p可以显著抑制肝上皮细胞的增殖并促进肝上皮细胞的凋亡,提示miR-126-5p可以加快盲肠结扎穿孔致脓毒症介导的肝损伤的进程。
最近,lncRNAs通过与miRNAs相互作用并抑制其作用而起到ceRNA或miRNA sponge的作用。例如,在脓毒症中,lncRNA NEAT1可以通过靶向抑制miR-125增加MCEMP1(mast cell-expressed membrane protein 1,MCEMP1)的表达对脓毒症小鼠的免疫抑制发挥促进作用,这可能是脓毒症治疗的潜在靶标[23]。此外,LncRNA HOTAIR可通过下调miR-34a/Bcl-2信号通路抑制肾组织细胞凋亡,从而减轻脓毒症大鼠的AKI[24]。此外,有研究表明,CRNDE靶向调节miR-181a-5p促进结直肠癌细胞的增殖和转移[25];lncRNA HOTAIR作为一种竞争性内源性RNA,通过靶向抑制miR-126-5p促进胶质瘤进展[26]。我们探究了CRNDE与miR-126-5p的潜在相互作用。相关数据证明了CRNDE可能是LPS诱导的星形胶质细胞中的miR-126-5p sponge。
综上所述,我们的研究首次证明CRNDE在脓毒症脑损伤患儿血清和LPS诱导的星形胶质细胞中表达下调。功能性实验证实CRNDE通过调节miR-126-5p减弱脓毒症脑病,是一个有价值和有前景的脓毒症患儿脑损伤治疗靶点。

