宫颈腺癌病例2例及文献复习
宁 莉,朱亚飞,彭 琴
(1.赣南医学院第一附属医院妇产科;2.赣南医学院第一附属医院病理科,江西 赣州 341000)
子宫颈癌大多为鳞状细胞癌,20%~25%为宫颈腺癌[1]。近年来宫颈腺癌发生率呈上升趋势,并呈年轻化表现。宫颈腺癌因临床表现无特异性、细胞学检查假阴性率高、阳性率低、病理取材差异等,容易出现误诊、漏诊,导致临床检查难以早发现、早诊断和早治疗。现报告我院2例疑难宫颈腺癌病例,通过复习相关文献,对宫颈腺癌的流行病学、阴道镜下检查特点及治疗进行探讨。
1 病例报告
1.1 病例1患者,肖某,女,30岁。2019年3月21日顺产1女婴,接生过程助产士发现宫颈赘生物,建议产后复查。产前、妊娠期未行宫颈癌筛查。2019年6月当地县医院宫颈TCT:不能明确意义的非典型鳞状上皮内病变;HPV18型阳性。行阴道镜检查+宫颈活检,病理提示:⑴(宫颈12点、宫颈赘生物)考虑为腺癌,建议免疫组化检查以协助诊断;⑵(宫颈9点)慢性宫颈炎,少许腺上皮细胞呈重度异型增生改变;⑶(宫颈3、6点)慢性宫颈炎。2019年7月6日赣州市人民医院病理会诊报告:(宫颈12点、宫颈赘生物)腺癌合并表面鳞状上皮低级别鳞状上皮内病变。我院病理会诊报告:⑴(宫颈赘生物、宫颈12点)腺癌;⑵(宫颈9点)黏膜慢性炎伴少许腺上皮核大异形;⑶(宫颈3、6点)慢性宫颈炎。患者末次月经2018年6月15日。现处于哺乳期。自诉平时月经规则,经期3~4天/30~37天。患者平时无不规则阴道流血或同房后阴道流血,无阴道流液,未行宫颈癌筛查。患者入院后完善相关检查,盆腔MRI:⑴宫颈未见明确占位征象,请结合宫腔镜;⑵左侧附件区囊肿或卵泡。血细胞分析、凝血分析、生化组合、乙肝五项、感染四项、鳞状细胞癌相关抗原未见明显异常。患者及家属要求再次行阴道镜检查+宫颈活检,遂于2019年7月19日行阴道镜检查+宫颈活检。病理报告:⑴(宫颈管组织)黏膜慢性炎;⑵(宫颈组织6、11、12点)慢性宫颈炎。患者年轻女性,两次病理活检结果相差大,全科讨论该患者病情及治疗方案,结合患者和家属意见,于2019年7月23日行宫颈环形电切术(LEEP术),手术Ⅲ型切除,外口周径3.2 cm,高度2.6 cm,厚度1.0 cm,补切无,手术顺利,少许出血。切除组织送病理检查。2019年7月25日病理报告:⑴(宫颈2点)高分化腺癌,病灶大小为2 mm×1.8 mm,病变紧邻基底切缘(距离基底切缘最近约0.5 mm),内、外切缘未见癌累及;⑵(宫颈1点)原位腺癌,病灶大小为1 mm×0.8 mm,内、外切缘及基底均未见癌组织累及;(宫颈3~12点)慢性宫颈炎。2019年9月20日于我院行宫颈癌根治术。术后病理报告:⑴(子宫+双侧附件)LEEP术后宫颈组织全部取材,镜下仅见个别腺癌组织,阴道壁、左右宫旁未见癌,未见脉管内癌栓;⑵增生期子宫内膜,双侧输卵管未见明显异常,双侧卵巢滤泡囊肿;⑶(左、右盆腔、腹主动脉旁)淋巴结未见癌(0/30,0/34,0/7)。见图1、图2。

图1 病例1患者阴道镜下醋酸染色后宫颈图片
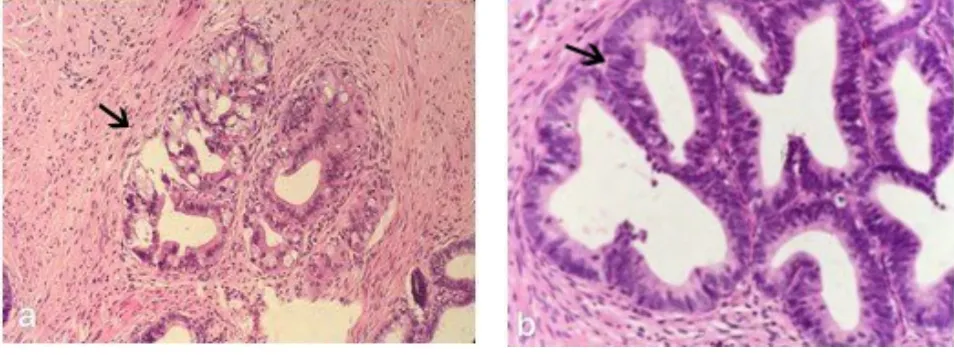
图2 病例1患者宫颈环形电切术后病理图
1.2 病例2患者,廖某,女,39岁。患者诉于去年9月起无明显诱因出现同房后出血,无腹痛,无其他不适,未予重视。于2018年4月24日就诊于我院门诊查HPV18型阳性。完善阴道镜病理诊断:⑴(宫颈6点)慢性宫颈炎;⑵(宫颈12点、阴道左下穹窿部)低度鳞状上皮内病变。建议宫颈环切术(LEEP)治疗,患者选择干扰素治疗。于2018年11月27日返院复查HPV18型阳性,阴道镜下取活检,病理诊断:⑴(宫颈6点)黏膜慢性炎伴腺体鳞状上皮化生;⑵(宫颈12点)高度鳞状上皮内病变伴(宫颈)原位腺癌,建议免疫组化检查协助诊断。免疫组化P16(+),Ki67约80%(+),CEA(+),病理诊断:(宫颈12点)高度鳞状上皮内病变伴(宫颈)原位腺癌。2018年12月19日我院行宫颈环形电切术。切除组织病理报告:⑴(宫颈)原位腺癌伴浸润(大小1.2 cm×0.2 cm);局灶基底切缘可见腺癌组织,另见局灶区域高度鳞状上皮内病变,内外切缘未见病变上皮组织;⑵(补切后唇)黏膜慢性炎症,未见病变上皮组织。于2019年1月30日行宫颈癌根治术。术后病理:⑴子宫根治标本,已做宫颈LEEP术,宫颈分点取材1~12点,均未见癌,呈慢性宫颈炎改变,阴道壁、左右宫旁未见癌,未见脉管内癌栓;⑵增生期子宫内膜,子宫基壁未见明显异常,双侧输卵管未见明显异常,双侧卵巢滤泡囊肿;⑶(左、右盆腔、腹主动脉旁)淋巴结未见癌(0/11,0/14,0/5)。见图3、图4。
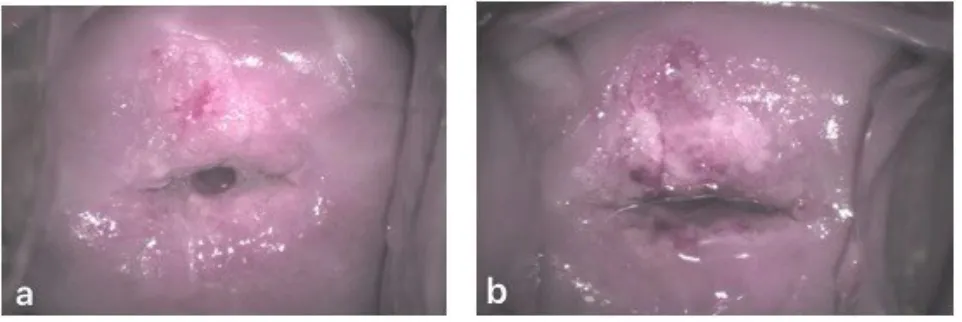
图3 病例2患者阴道镜下醋酸染色后宫颈图片
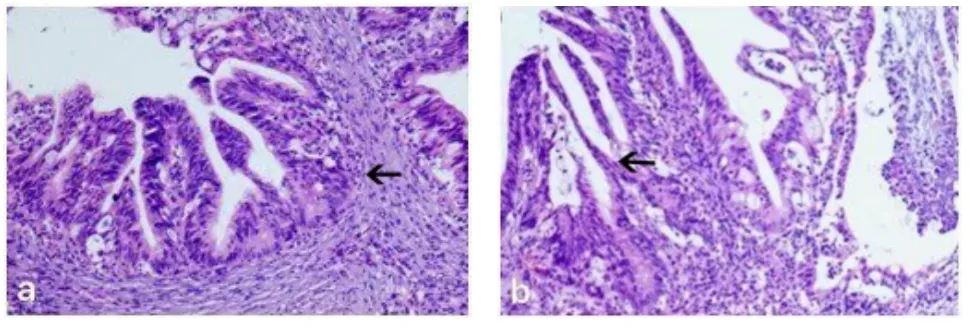
图4 病例2患者2018年11月27日阴道镜下宫颈活检标本病理图片
2 讨 论
2.1 子宫颈腺癌的流行病学2018年中国癌症数据报告,中国每天有1万多人诊断为新发癌症,其中女性宫颈癌排名第6[1],严重威胁女性健康。子宫颈癌大部分为鳞状细胞浸润癌,有20%~25%为腺癌[2]。近年来“两癌”筛查项目的普遍开展,宫颈鳞癌获益更为显著。宫颈鳞癌发病率逐渐降低,而宫颈腺癌发病率逐渐上升,并有年轻化的趋势,如本文2例患者均为年轻女性。宫颈腺癌临床症状隐匿且缺乏特异性,多数患者出现性交出血,或阴道分泌物增多,偶有下腹痛,少数发现宫颈赘生物,临床检查难以早期发现。据2014年女性生殖器官肿瘤分类,宫颈原位腺癌(AIS)为宫颈腺癌的癌前病变。多数研究认为,人乳头瘤病毒(HPV)的感染,特别是HPV16型、HPV18型与宫颈腺癌密切相关。40%~50%的宫颈原位腺癌和宫颈腺癌伴HPV18型感染,10%~20%伴HPV16型感染,由于HPV16型、HPV18型为高危型人乳头瘤病毒,其DNA整合入宿主的染色体的速度快,整合率高,因此宫颈原位腺癌的发病年龄较轻,多在30~39岁之间。由于HPV感染也可导致宫颈鳞状上皮内病变,有约55%的AIS同时合并有宫颈高级别鳞状上皮内病变[3-4]。
2.2 宫颈腺癌的早期筛查宫颈癌筛查“三阶段”早期筛查可选择宫颈脱落细胞学检查和高危型HPV检测。因我国病理学医生缺口大,细胞病理阅片质量参差不齐,宫颈腺癌及癌前病变中细胞学异常比例仅占30%,细胞学检查假阴性率高,阳性率低,容易出现误诊、漏诊。当细胞学检查报告为腺细胞异常提示癌前病变和癌变的预测值介于17%~96%之间[5],应及时转诊阴道镜并行宫颈管取材,对于年龄在35岁以上患者需行宫腔镜检查以排除子宫内膜病变。有研究者认为,对于腺细胞异常的患者反馈性行高危型HPV检测有助于评估宫颈腺癌的风险,HPV阴性者罹患宫颈原位腺癌和宫颈腺癌的风险极低,但此观点并未获得循证医学的证据支持。因筛查具有不典型性,目前无专门针对宫颈腺癌的筛查策略和手段。
2.3 阴道镜下早期宫颈腺癌的特点由于腺上皮病变起源于宫颈管,有时阴道镜检查难以观察到病灶,有一定的局限性,容易漏诊。早期宫颈腺癌就诊的患者临床症状不具有典型性,少数有不规则阴道流血、排液、宫颈赘生物等。行妇科检查时其宫颈形态多无异常,或仅有少许存在浅表糜烂。此2例病理阴道镜下表现醋白上皮无明显增厚,1例合并宫颈高度上皮内病变前唇见湿疣状隆起,无明显腺管开口异常。现有的典型的阴道镜下的醋白上皮、血管的改变、RCI评分均适用于鳞状上皮,腺上皮病变阴道镜下缺乏特异性表现。杨淑丽等[6]报道,32例宫颈腺上皮病变患者中,阴道镜下可见致密浓厚醋白上皮20例,表现为柱状上皮包绕,病灶呈乳头状隆起或红白相间;宽大或密集的腺开口5例,腺开口可缺少致密浓厚的腺体白环;不典型血管8例,多呈树枝状改变,表面可覆有丰富的黏液,表面出血坏死。依据这些相对特有的改变可提高阴道镜下诊断宫颈腺癌的准确率。
2.4 阴道镜下不典型宫颈腺癌活检取材的技巧阴道镜下对患者下生殖道进行全面评估,在可疑部位常规进行定点活检,多点取材,提高准确性。对阴道镜下未提示有可疑病变,亦进行常规活检,特别是绝经期妇女转化区Ⅲ型患者。鳞柱交界位于宫颈管内,阴道镜下不易观察到病灶,易漏诊。必要时进行宫颈管内膜搔刮术(ECC)。以英国阴道镜和宫颈病理学会(BSCCP)为代表的多数中心认为盲目的ECC阳性率低,所获组织标本量少,其标本往往不理想,不能评估病变深度,对诊断帮助有限,而且其过程相对痛苦,故临床上较少推荐。而以美国阴道镜和宫颈病理学会(ASCCP)为首的美国体系认为ECC可提高发生于宫颈管内的高度鳞状上皮内病变腺上皮内病变以及宫颈腺癌的检出率,并在其筛查策略中明确指出ECC对部分细胞学异常人群或阴道镜检查转化区暴露不充分人群的价值。对40岁或以上妇女,ECC更有价值。中国优生科学协会阴道镜与宫颈病理学分会(CSCCP)专家共识[7-8]也认同此观点,ECC在腺细胞异常情况下是必要的。实际操作中,应选取锐利的专用宫颈管搔刮器,从宫颈外口深入到宫颈管内2~3 cm直达宫颈内口水平,以适当力度均匀搔刮2周,并将组织标本全数收集送检,规范的操作可提高宫颈管搔刮的阳性率。
2.5 宫颈腺癌的治疗早期宫颈腺癌及癌前病变往往缺乏特征性的临床症状,病灶微小且多隐匿于宫颈管,而宫颈管搔刮往往存在较高的假阴性率,因此对于早期处理缺乏有浸润的证据,诊断性锥切不失为一个理想的选择。诊断性锥切包括宫颈环形电切术、大环切除术、冷刀锥切术、激光锥切术等,此2例患者均行宫颈环形电切术。所有治疗必须有完整规范的记录,切除标本应能满足12点连续病理切片的要求。若组织病理学结果证实为浸润癌者,应进行下一步的治疗[9]。
2.6 宫颈腺癌争论的焦点:微浸润?临床分期?对于阴道镜下不典型的宫颈腺癌的锥切结果,应特别关注切缘情况。腺上皮病变多呈多灶性、跳跃性分布,不同病灶间可相距数毫米。有10%~15%的患者病灶存在跳跃性,且被至少2 mm的正常黏膜隔开[10]。因此建议病理科医生应详尽注明每个切缘与病变的具体距离,甚至有学者提出,只有病变距切缘10 mm以上,才可诊断为“切缘呈阴性”[11]。综上所述,与早期鳞状细胞癌不同的是,早期宫颈腺癌不存在微浸润,只有存在描述切缘距离病灶的具体距离。且只能测量“肿瘤的厚度”,无法测量“浸润的深度”[11]。子宫颈癌临床分期(FIGO,2009年)的ⅠA1期和ⅠA2期,间质浸润深度的描述,仍可同鳞状细胞癌。当异形腺体的厚度为≥5 mm时,应诊断为浸润期宫颈腺癌。
综上,早期宫颈腺癌由于筛查无特异性,难以早期发现,发病较鳞状上皮更趋于年轻化,阴道镜下有部分特征性表现,应警惕腺上皮病变的情况。若组织病理学考虑腺上皮病变,诊断性锥切不失为一个理想的选择。应准确判断切缘情况,为下一步临床治疗提供依据。因部分腺上皮病变多呈多灶性、跳跃性分布,应特别关注切缘情况。若组织学结果证实为浸润癌者,应按子宫颈癌临床分期(FIGO,2018年)实施下一步处理方案。

