血清巨噬细胞移动抑制因子、Tau蛋白在重症高血压性脑出血患者中的表达水平及与其临床结局的关系研究
邓 亮, 郭碧君, 邹燕群
高血压性脑出血(hypertensive intracerebral hemorrhage,HICH)是高血压疾病常见且最严重的并发症,占所有脑卒中的40%左右[1],发病人群主要为中老年高血压患者,其典型临床表现有剧烈头痛、呕吐以及不同程度的意识障碍。该病起病急且病情变化迅速,多数患者易错过最佳抢救时机,造成脑部动脉血管和神经系统的严重损伤,具有较高致残率和死亡率,严重影响患者的生活质量,甚至威胁生命安全。因此早预防、早发现、早治疗对HICH患者具有重要意义,通过相关血清学指标情况指导HICH患者临床治疗以及预测其预后质量成为临床研究重点[2]。巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)是机体重要的内分泌免疫物质,可控制巨噬细胞的过度活动[3]。且有研究指出MIF水平会在急性脑损伤中发生显著变化,应激性升高是神经损伤的重要标志[4]。Tau蛋白由神经元分泌,主要发挥促微管形成和稳定微管结构作用,相关研究指出其水平升高可反映神经元损伤[5]。而HICH患者最显著和最重要的表现则为神经系统的紊乱和损伤,推测 MIF和Tau蛋白水平与该类患者的病情进展有着密切联系。基于此,本研究通过对比健康人群和重症HICH患者的MIF和Tau蛋白水平,并综合分析其与重症HICH患者的临床结局关系,现报道如下。
1 材料与方法
1.1 一般资料 选取四川大学华西医院资阳医院在2019年1月-2022年11月收治的HICH患者作为研究组,同时选取与研究组年龄、性别相匹配的健康体检者作为对照组。其中纳入标准为:(1)研究组患者符合HICH诊断标准,具有典型局灶性神经功能缺损症状[6];(2)研究组患者发病至入院时间<6 h,为初次发病,生存期>7 d;(3)研究组方便随访,且随访时间>6个月;(4)临床资料完整,均知情同意。排除标准:(1)继发性脑出血或非血管性脑疾病;(2)存在凝血功能不全,或重要器官障碍,或精神病史;(3)近3个月内有激素或免疫治疗史。研究获得医院伦理委员会审核批准。
1.2 方 法 研究组和对照组受试者均在入院或入院第2天采用乙二胺四乙酸试管抽取外周静脉血5 ml左右,静置30 min后离心(1 500 r/min,半径15 cm),去上层清液并分为两份,1份检测 MIF水平,另1份检测Tau蛋白水平,检测方法均为双抗体夹心酶联免疫吸附法,但试剂分别来自美国BioSource、上海艾博生物,严格按照试剂盒要求步骤进行。观察对比研究组和对照组MIF、Tau蛋白水平差异。对研究组患者进行6个月以上的随访,将生活自理能力严重下降(重度病残)或死亡患者记为预后不良患者,纳入预后不良组,其余预后良好患者纳入预后良好组。统计可知本研究中预后不良组45例(37.50%),预后良好组75例(62.50%)。最后采用ROC曲线和Kaplan-Meier法探究HICH患者预后不良的MIF、Tau蛋白水平临界值及与HICH患者临床结局的关系。
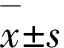
2 结 果
2.1 两组一般资料比较 最终研究组纳入120例,其中男性68例、女性52例;年龄在54~72岁,平均(64.14±5.03)岁。对照组纳入50例,男性28例、女性22例;年龄在55~75岁,平均年龄(65.25±4.86)。两组性别、年龄无统计学意义(P>0.05),具有可比性。
2.2 研究组和对照组血清MIF、Tau蛋白水平比较 研究组患者的血清MIF水平和Tau蛋白水平均显著高于对照组受试者(P<0.05)(见表1)。

表1 研究组和对照组血清MIF、Tau蛋白水平比较
2.3 研究组不同预后患者的血清MIF、Tau蛋白水平比较 预后不良组患者血清MIF水平和Tau蛋白水平显著高于预后良好组(P<0.05)(见表2)。
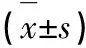
表2 研究组不同亚组间血清MIF、Tau蛋白水平比较
2.4 HICH患者预后不良的血清MIF水平和Tau蛋白水平临界值 血清MIF水平和Tau蛋白水平预测患者预后不良的最佳截断点分别为64.43 ng/L,216.25 pg/ml,血清MIF和Tau蛋白水平对预测HICH患者预后不良的敏感度和特异度均处较高水平(见表3、图1)。

表3 MIF、Tau蛋白对 HICH患者预后不良预测效能
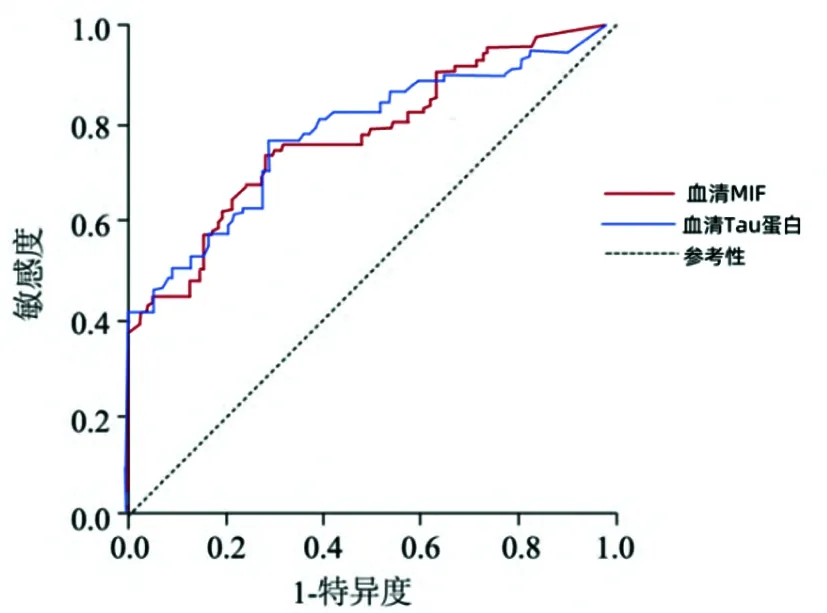
图1 HICH预后不良的血清MIF、Tau蛋白水平临界值 ROC曲线
2.5 Kaplan-Meier生存曲线分析HICH患者血清MIF水平和Tau蛋白水平与临床结局的相关性 血清MIF水平≥64.43 ng/L时的患者生存曲线明显优于血清MIF水平<64.43 ng/L的生存曲线,Log/rank检验显示两者差异具有统计学意义(P<0.05)(见图2);血清Tau蛋白水平<216.25 pg/ml时的患者生存曲线明显优于血清Tau蛋白水平≥216.25 pg/ml时的生存曲线,Log/rank检验显示两者差异具有统计学意义(P<0.05)(见图3)。

图2 血清MIF蛋白水平与HICH患者临床结局的关系

图3 血清Tau蛋白水平与HICH患者临床结局的关系
3 讨 论
HICH患者由于长期处于高血压状态,脑内动脉逐渐发生脂质透明样改变,使血管内膜沉积过量的脂质及蛋白质物质,从而改变血管壁的厚度及弹性,促使形成微小动脉瘤[7,8]。当患者血压突然升高时,容易导致血管破裂出血形成血肿,然后由血肿进一步加重脑部损伤,长期压迫可导致占位性改变,引起局部脑循环系统障碍和脑代谢紊乱,加重脑部损伤,甚至形成不可逆神经损伤[9]。此时,脑部一系列改变也会一定程度影响下丘脑功能,以及受损脑组织和神经细胞释放的细胞因子也会显著改变。因此能通过相关血清学指标及时发现脑出血高危患者,并有效反映HICH患者严重程度和预测其预后情况,对指导临床治疗和提高患者临床结局具有重要意义[10]。
本研究结果显示,重症HICH患者的血清MIF水平和Tau蛋白水平均显著高于对照组,说明血清MIF和Tau蛋白与HICH的发生发展具有一定联系,相关病理改变使患者机体血清MIF水平和Tau蛋白表达上升。MIF为一种集细胞因子、神经内分泌激素以及酶特性为一身的多能细胞调节蛋白,占脑垂体分泌总量的0.05%左右[11],虽然含量少,但其对机体系统性应激反应的调节十分重要,能活性多种细胞因子,与免疫反应以及炎症反应密切相关。有研究显示给予MIF能有效减少机体炎症反应,有利于改善动脉粥样硬化、溃疡性结肠炎、系统性红斑狼疮等多种疾病症状[12]。另外MIF对细胞黏液分子分泌的诱导作用是促使血管硬化和粥样斑块形成的重要原因之一,与心脑血管疾病的发生发展具有一定关联[13]。众多研究证实其与神经损伤具有密切联系[14,15],本研究结果还显示预后不良组患者的血清MIF表达水平明显高于预后良好组患者,提示HICH患者神经系统和脑组织损伤越重,MIF表达水平越高,患者预后也就越差。血清MIF表达水平可做为重症HICH患者的病情监测和预后预测的重要指标。Tau蛋白为神经元分泌的一种微管相关蛋白,参与构成细胞骨架,可反映神经元和轴突变性情况[16]。当人体发生脑损伤时,微管分解,从而促使神经轴突或胞体释放Tau蛋白,再经过磷酸酶修饰等一系列过程后释放入脑脊液和血液,导致血清Tau蛋白浓度升高,且也会加重神经系统损伤[17]。在健康人体的血液和脑脊液中,Tau蛋白含量极低,因此当血清Tau蛋白异常升高时,提示脑组织和神经系统已经受到了损伤。有研究显示,血清Tau蛋白表达水平与心脑血管疾病患者的严重程度密切相关,持续高水平的血清Tau蛋白,提示患者可能预后不良[18]。本研究结果显示,预后不良组患者的血清Tau蛋白水平明显高于预后良好组患者,说明血清Tau蛋白可有效反映患者预后情况。Gudasheva等[19]研究发现脑卒中预后良好患者的血清Tau蛋白水平明显低于预后不良患者,血清Tau蛋白水平不仅与脑损伤患者的严重程度相关联,还与患者的预后质量有关,与本研究结果一致。本研究ROC曲线分析结果还显示,血清MIF水平和Tau蛋白水平对重症HICH患者预后情况的预测效能良好,且预后不良界限值分别为64.43 ng/L,216.25 pg/ml,与相关研究结果相似。Kaplan-Meier生存曲线分析结果也进一步证实了ROC曲线分析结果:血清MIF水平≥64.43 ng/L与血清Tau蛋白水平<216.25 pg/ml时的患者生存曲线均分别优于血清MIF水平<64.43 ng/L和血清Tau蛋白水平≥216.25 pg/ml时的生存曲线。且已有研究指出血清MIF、Tau蛋白等血清分子指标水平是影响颅脑损伤患者预后不良的危险因素[20]。以上数据表明,血清MIF、Tau蛋白水平与HICH疾病的发生发展密切相关,两者水平与重症HICH患者的临床结局紧密相关,可作为重症HICH病情监测和预测预后情况的重要指标。
综上所述,重症HICH患者的血清MIF、Tau蛋白水平较健康人显著升高,且预后不良患者的血清MIF、Tau蛋白水平较预后良好患者更高,血清MIF、Tau蛋白水平与患者临床结局密切相关,可作为预测HICH患者预后情况的有效指标。

