茵栀黄口服液联合蓝光照射在新生儿黄疸中的效果分析
庞新丰,乔静,吴静,李贝,李文斌,田军
焦作市妇幼保健院,1 输血科,2 儿科一区,3 药剂科,焦作 454000
新生儿黄疸是儿科常见疾病之一,其发病与新生儿体内未结合的总胆红素积聚过多相关[1]。新生儿黄疸纠正不及时可影响中枢神经系统、心血管系统等,引起新生儿听觉、认知障碍及心肌损伤、肝损伤等后遗症,严重影响患儿的生命健康[2]。临床上常采用蓝光照射来治疗新生儿黄疸,蓝光照射可将机体内未结合的胆红素转化为水溶性异构体,经胆汁及尿液排出体外[3]。但单纯蓝光照射的治疗效果欠佳,仍需进一步寻找治疗新生儿黄疸的最佳方案。中医学认为新生儿黄疸是由于新生儿脏腑娇嫩、脾运欠佳,体内湿热邪气无法正常运化,从而导致肝失疏泄、胆汁外溢[4]。因此,治疗新生儿黄疸可从清热祛湿、疏肝祛黄入手。茵栀黄口服液由茵陈、栀子、黄芩、金银花等制成,具有清热解毒、化湿退黄的功效[5]。近年来,茵栀黄口服液治疗新生儿黄疸的临床疗效受到广泛关注,但其对新生儿黄疸患儿心肌酶谱、免疫功能的影响研究较少。基于此,本研究通过对120例新生儿黄疸患儿进行对比治疗,旨在探究茵栀黄口服液联合蓝光照射对新生儿黄疸患儿心肌酶谱、免疫功能及黄疸指数的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月~2020 年12 月期间本院收治的120 例新生儿黄疸患儿作为研究对象,采用随机数字表法随机分为对照组和观察组,每组60 例。对照组:男性患儿32 例,女性患儿28 例;平均体质量(2843.53±204.38)g;平均血清总胆红素水平(242.27±28.52)μmol/L。观察组:男性患儿34 例,女性患儿26 例;平均体质量(2841.48±204.11)g;平均血清总胆红素水平(242.46±28.77)μmol/L。两组一般资料比较无统计学差异(P>0.05),具有可比性(表1)。本研究经本院伦理委员会批准(伦理批号2019-LW-1368),所有患儿家属均签署知情同意书。
表1 两组一般资料比较 n=60,±s,n(%)
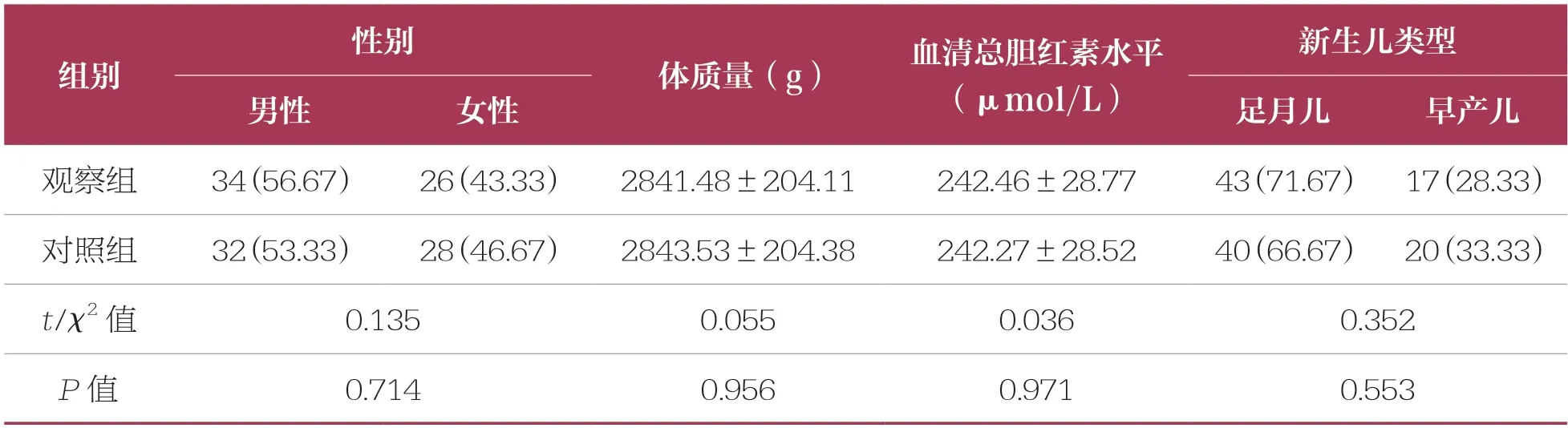
表1 两组一般资料比较 n=60,±s,n(%)
新生儿类型男性女性足月儿早产儿观察组34(56.67)26(43.33)2841.48±204.11242.46±28.7743(71.67) 17(28.33)对照组32(53.33)28(46.67)2843.53±204.38242.27±28.5240(66.67) 20(33.33)t/χ2 值0.1350.0550.0360.352 P 值0.7140.9560.9710.553性别组别体质量(g)血清总胆红素水平(μmol/L)
纳入标准:①符合西医新生儿黄疸诊断标准[6]者:足月儿血清胆红素水平>221μmol/L、持续时间>2 周,早产儿血清胆红素水平>257μmol/L、持续时间>4 周,或每天上升>85μmol/L;血清结合胆红素水平>34μmol/L。②符合中医湿热内蕴证型诊断标准[7]:面部、躯干、四肢皮肤发黄且颜色鲜明,新生儿烦躁啼哭、小便黄赤、大便灰白或秘结、舌质红、苔黄厚腻。
排除标准:①合并心血管疾病者。②肝肾功能障碍者。③对本研究所使用药物过敏者。
1.2 研究方法
对照组给予蓝光照射治疗,将新生儿的眼睛、肛周及会阴部位用黑布遮盖,并置于BL70 蓝光治疗箱(深圳科曼医疗设备有限公司)中进行照射治疗,8h/d,bid,连续照射5 天。注意在蓝光照射过程中为患儿补足水分。观察组在对照组基础上内服茵栀黄口服液[北京华润高科天然药物有限公司,国药准字Z11020607,规格:每支装10ml(含黄芩苷0.4g)],5ml/次,bid,连续服用5 天。
1.3 观察指标
1.3.1 一般情况
记录两组蓝光照射时间、黄疸消退时间、住院时间及治疗前后黄疸指数。黄疸指数采用NJ33A经皮黄疸仪(上海涵飞医疗器械有限公司)测量,分别于治疗前后测量两组患儿眉心、面部及前胸3处胆红素值,取平均值为最终测定结果。
1.3.2 疗效评价
参照《实用新生儿学》[8]评价两组患儿的临床疗效。皮肤黄染等临床症状消退,血清胆红素水平恢复正常为痊愈;皮肤黄染等临床症状部分消退,血清胆红素及白蛋白水平下降为好转;皮肤黄染等临床症状均未消退,血清胆红素及白蛋白水平未下降为无效。总有效率(%)=(痊愈+好转)例数/每组总例数×100%。
1.3.3 心肌酶谱指标
分别于治疗前后采集患儿早晨空腹静脉血2ml,采用BY160A 低速离心机(北京白洋医疗器械公司,r=14cm),于室温条件下以3500 r/min 离心10min,取血清,并置于-80℃冰箱保存待测。检验科专业技术人员采用酶联免疫吸附法,严格按照试剂盒说明书检测血清样本中的血清肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶MB(creatinekinase-MB,CK-MB)、α-羟丁酸脱氢酶(α-hydroxybutyrate dehydrogenase,α-HBDH)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平。试剂盒均购自上海江莱生物科技有限公司(批号分别为JL34657、JL10961、JL11397、JL14328)。
1.3.4 免疫功能指标
分别于治疗前后采集患儿早晨空腹静脉血2ml,使用Attune NxT 流式细胞仪[赛默飞世尔科技(中国)有限公司]检测患儿外周血T 淋巴细胞亚群(CD3+、CD4+、CD8+)水平,并计算CD4+/CD8+比值。
1.3.5 不良反应发生情况
观察并记录两组治疗过程中不良反应的发生情况。
1.4 统计学方法
采用SPSS 18.0 软件对数据进行统计分析。计量资料以±s 表示,行t检验;计数资料以n(%)表示,行χ2检验或秩和检验。P<0.05 为具有统计学差异。
2 结果
2.1 临床疗效
治疗后,观察组治疗总有效率(95.00%)高于对照组(81.67%,P<0.05)(表2)。
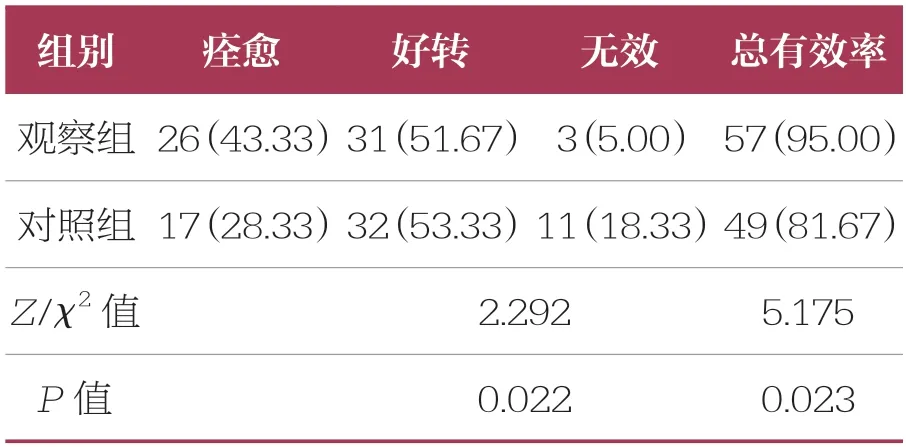
表2 两组临床疗效比较 n=60,n (%)
2.2 一般情况
观察组黄疸消退时间、住院时间均短于对照组(P<0.05);治疗前,两组黄疸指数比较无统计学差异(P>0.05);治疗后,两组黄疸指数均下降(P<0.05),且观察组低于对照组(P<0.05)(表3)。
表3 两组一般情况比较 n=60,±s

表3 两组一般情况比较 n=60,±s
与同组治疗前比较,a:P<0.05,下同
组别黄疸消退时间(天)住院时间(天)黄疸指数(μmol/L)治疗前治疗后观察组6.78±1.868.21±2.43175.42±23.8162.46±9.44a对照组8.97±2.2311.56±3.15175.94±23.6878.57±12.38a t 值5.8426.5230.1208.015 P 值0.0000.0000.9050.000
2.3 心肌酶谱指标
治疗前,两组CK、CK-MB、α-HBDH、LDH水平比较均无统计学差异(P>0.05);治疗后,两组CK、CK-MB、α-HBDH、LDH 水平均降低(P<0.05),且观察组各指标水平均低于对照组(P<0.05)(表4)。
表4 两组心肌酶谱指标水平比较 n=60,±s

表4 两组心肌酶谱指标水平比较 n=60,±s
CK:肌酸激酶;CK-MB:肌酸激酶同工酶MB;α-HBDH:α-羟丁酸脱氢酶;LDH:乳酸脱氢酶
CK(U/L)CK-MB(U/L)α-HBDH(U/L)LDH(U/L)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组308.41±56.74组别156.74±30.23a 6.78±1.16 2.34±0.52a 572.15±89.05 320.84±58.39a 686.11±132.51 381.46±99.42a对照组307.85±57.06 4.18±0.68a 177.48±35.38a 6.72±1.21 572.69±88.73 356.71±70.61a 685.47±132.43 402.57±108.16a t 值0.0543.4520.27716.6490.0333.0320.0262.168 P 值0.9570.0010.7820.0000.9740.0030.9790.032
2.4 免疫功能指标
治疗前,两组T 淋巴细胞亚群CD3+、CD4+、CD8+水平及CD4+/CD8+比值比较均无统计学差异(P>0.05);治疗后,两组CD3+、CD4+水平及CD4+/CD8+比值均升高(P<0.05),且观察组各指标水平均高于对照组(P<0.05)(表5)。
表5 两组T 淋巴细胞亚群比较 n=60,±s,%

表5 两组T 淋巴细胞亚群比较 n=60,±s,%
CD3+CD4+CD8+CD4+/CD8+治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组55.17±7.26组别63.35±8.92a 35.11±4.82 45.85±6.08a 22.15±4.56 21.63±5.46 1.59±0.19 2.26±0.31a对照组55.23±7.63 58.71±8.20a 35.43±4.78 38.26±5.91a 22.62±4.75 21.60±5.13 1.57±0.20 1.77±0.25a t 值0.0442.9660.3656.9340.5530.0310.5629.531 P 值0.9650.0040.7160.0000.5810.9750.5750.000
2.5 不良反应发生情况
观察组不良反应总发生率(25.00%)高于对照组(23.33%),但两组比较无统计学差异(P>0.05)(表6)。

表6 两组不良反应发生情况比较 n=60,n (%)
3 讨论
由于红细胞生成速度快、存活时间短,导致新生儿胆红素释放快。而新生儿的肝功能发育不全导致肝脏处理胆红素的能力欠佳,最终致使体内未结合的血胆红素积聚过多而出现黄疸症状[9]。中医学认为,新生儿由于其脏腑娇嫩、脾运欠佳,体内湿热邪气无法正常运化,从而导致肝失疏泄、胆汁外溢,进而引发黄疸。在湿热内蕴型黄疸的治疗中,应以清热利湿退黄为主。目前,临床上治疗黄疸的主要方法为蓝光照射,该方法可使体内未结合胆红素转化成水溶性异构体排出体外,从而达到治疗黄疸的目的[3]。但蓝光照射可直接损害新生儿皮肤、降低免疫功能,进而引起皮疹、发热、腹泻等不良反应。此外,蓝光照射治疗方法仅能缓解新生儿黄疸症状,不能有效祛除病因。因此,寻找一种安全有效的治疗方案对提高新生儿黄疸疗效具有重要意义。茵栀黄口服液由茵陈、栀子、黄芩、金银花等提取而成,共同发挥利湿退黄、清热解毒的功效。其中,茵陈可清热利湿、退黄,且现代药理学研究表明,茵陈具有保肝护肝、降低炎症反应的功效[10];栀子可泻火凉血、清热利湿;金银花、黄芩可清热解毒、疏散风热。基于此,本研究通过观察茵栀黄口服液联合蓝光照射对新生儿黄疸的临床疗效,以期为临床合理用药提供参考。
本研究结果显示,观察组治疗总有效率、黄疸恢复指标均优于对照组,提示在蓝光照射的基础上加用茵栀黄口服液,能够减轻新生儿黄疸患儿的黄疸症状,提高治疗效果。茵栀黄口服液中茵陈具有保肝利胆、清热解毒的功效,可扩张胆管,加速胆汁分泌,增加对胆红素的摄取、结合及排泄[11]。此外,茵栀黄口服液为多种中药配伍应用,可减少红细胞溶血,降低患儿总胆红素水平,进而减轻黄疸症状[12]。新生儿黄疸患儿由于体内未结合胆红素较多,可于质膜结合形成磷脂复合物,损伤心肌细胞[13]。此外,血中胆红素含量过高可使胆盐增加,抑制心肌细胞腺苷三磷酸(adenosine triphosphate,ATP)活性及摄取氧的能力,干扰心肌正常能量代谢过程[14]。CK、CK-MB、LDH 为机体中重要的心肌酶,当机体心肌细胞受损时,其细胞膜通透性增加,导致心肌酶逸出量显著升高[15]。α-HBDH 为酮体氧化利用过程中的关键酶,当心肌细胞受损时,其水平升高[16]。本研究结果显示,经治疗后,观察组CK、CK-MB、α-HBDH、LDH 水平低于对照组,提示茵栀黄口服液联合蓝光照射可降低新生儿黄疸患儿的心肌酶水平,保护心功能。推测是由于茵栀黄口服液具有利湿退黄、保肝利胆的功效,有助于消退黄疸,并减少患儿体内未结合的胆红素,从而降低对心肌细胞的损害。
新生儿的免疫功能尚处于未完全发育成熟阶段,蓝光照射在一定程度上降低了新生儿的免疫功能。T 淋巴细胞亚群(CD3+、CD4+、CD8+)水平的检测是评估机体细胞免疫功能的重要指标[17]。其中,CD3+主要参与T 细胞信号转导,其水平降低影响了抗原决定簇的识别作用,进而导致免疫抑制;CD4+主要辅助T 细胞完成体液免疫及细胞免疫;CD8+为具有抑制作用的跨膜糖蛋白,可通过抑制抗体合成对T 细胞产生抑制作用;CD4+/CD8+比值则代表机体免疫功能整体水平[18]。基于此,本研究通过检测CD3+、CD4+、CD8+水平及CD4+/CD8+比值来评价两组治疗方法对新生儿黄疸患儿免疫功能的影响。本研究结果显示,观察组CD3+、CD4+水平及CD4+/CD8+比值均高于对照组,提示茵栀黄口服液联合蓝光照射可提高新生儿黄疸患儿的免疫功能。推测是由于茵栀黄口服液可加快胆红素代谢,抑制由血胆红素水平过高而引起的单核细胞凋亡,从而减轻免疫抑制,提高新生儿黄疸患儿的免疫功能。此外,本研究还发现茵栀黄口服液并未增加不良反应的发生率,安全性较高。
综上所述,茵栀黄口服液联合蓝光照射可提高新生儿黄疸的治疗效果,保护患儿的心肌功能,提高免疫功能。但本研究所纳入的患儿数量有限,且缺少对心肌酶谱、免疫功能指标的动态监测,仍需进一步深入研究,以期为茵栀黄口服液的临床应用提供科学依据。

