粉煤灰制氧化铝工艺电解除铁方法探索研究
张正罡,郑晏辰,兰树伟,杨酉坚,王兆文
(东北大学 冶金学院,辽宁 沈阳 110819)
粉煤灰主要指电力、热力行业所使用的煤炭燃烧产生的固体废弃物[1],2021年我国粉煤灰产生量约为7.9亿吨,预计2024年产生量将达到9.25亿吨[2]。粉煤灰堆存不仅会造成环境污染,还可能对动植物、人体产生严重的健康危害[3]。因此,开展粉煤灰的高附加值利用有利于减少其固废危害,提高粉煤灰的资源化。粉煤灰制氧化铝是实现粉煤灰高价值利用的主要途径之一[4],目前以粉煤灰提取氧化铝的方法主要有碱法、酸法和盐法[5]。其中,以盐酸为浸出液的盐酸法具有工艺流程短、操作简单、节能低耗的优点[6],极具应用前景。但该工艺过程中盐酸会同样浸出铁杂质,伴随铝离子进入溶液,影响后续铝盐的形成及提纯[7]。因此,在盐酸法处理粉煤灰制氧化铝的工艺中,对浸出液进行除铁是关键环节之一。
目前常用的对粉煤灰浸出液进行铝铁分离方法有沉淀法、萃取法和树脂吸附法。沉淀法是通过添加无机盐沉淀剂或控制溶液pH值使铝离子或铁离子生成沉淀物,固液分离从而达到铝、铁分离的效果[8];其缺点是沉淀物过滤困难,铝和铁共沉淀难以避免。萃取法是利用铁离子在萃取剂和水溶液中的溶解度不同,使铁离子从水溶液中转移到萃取剂中,实现铝、铁分离[9];其缺点是工艺操作复杂,经济成本高。树脂吸附法是利用树脂上的官能团与铁离子发生配位反应,形成络合物[10];其缺点是离子吸附容量有限,对铝铁离子吸附选择性不高。因此,发展新的浸出液除铁方法对于降低生产成本、提高分离效果非常重要。
电解法(电化学还原)是使杂质离子在电解槽阴极上得到电子或者间接还原形成固相产物进而去除杂质的一种方法。电解还原铁已经被应用于很多领域,包括处理废水[11]、制备高纯铁[12]等。刘琼等[13]以钛作阴极板、钛涂钌材料作阳极,电解高纯硫酸亚铁溶液制备了高纯铁。曹为民等[14]以工业废铁屑为原料配置氯化亚铁电解液,同时配合使用预电解以及在阴极区放置纯铁等方法在钛片阴极上电解沉积铁,制备的铁产品纯度达99.98%。秦岩等[15]采用离子交换膜电解法从氯化亚铁浸出液中提取铁并再生氯化铁溶液,使用离子交换膜的目的是在阴极发生Fe2+还原得到电解铁,在阳极Fe2+氧化生成Fe3+,避免了阳极产生的Fe3+传递至阴极被还原成Fe2+或电解铁,从而降低阳极电流效率。这些例证表明虽然铁离子的氧化性(Eθ(Fe3+/Fe)=-0.037 V, Eθ(Fe2+/Fe)=-0.440 V)低于氢离子(Eθ(H+/H2)=0 V),但通过控制析氢的过电位,可以实现电化学还原方法将溶液中的铁离子沉积到阴极表面。对于铁和铝共存体系,铝离子的氧化性(Eθ(Al3+/Al)=-1.663 V)远低于氢离子,即使存在过电位情况,铝离子在水溶液中也无法被电解还原,所以电解法有望实现粉煤灰浸出液中的铝铁分离。
因此,对低浓度铁离子体系电解除铁工艺探索研究,分析不同电解条件对电解除铁效率的影响是开发粉煤灰浸出液电解法除铁工艺的重要前提。本文采用离子交换膜电解FeCl2溶液,使用Fe2+还原为Fe的原因是随着电解的进行,电解液pH随着升高,Fe3+易生成Fe(OH)3影响电解除铁效果。使用离子交换膜可以将Fe2+隔离在阴极室中使其只在阴极发生还原反应(Fe2++2e →Fe),防止其在阳极上发生氧化反应(Fe2+-e →Fe3+),影响电解除铁的效果。详细讨论了Fe2+初始浓度、电解液的pH、电流密度、电解温度等条件对电解法除铁效果的影响。
1 实 验
1.1 实验原料
四水合氯化亚铁(FeCl2·4H2O,99%),氯化钠(NaCl,99%),盐酸(HCl)购自国药集团化学试剂有限公司。重铬酸钾标准液,购自深圳希景生物技术有限公司。
1.2 实验设备与仪器
离子交换膜电解槽,自制;AMI-7001S型离子交换膜,杭州华膜科技有限公司;DK-98-IV型透明水浴锅,菲斯福仪器(河北)有限公司;CSY系列通用型直流电源,东莞市不凡电子科技有限公司;85-2A磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;YZ1515恒流泵,保定融柏恒流泵制造有限公司;电子天平,上海光正医疗仪器有限公司。
1.3 分析方法
溶液pH值由雷磁PHS-25型电位pH计(上海仪电科学仪器股份有限公司)测定,溶液中总铁和亚铁离子质量浓度用高锰酸钾滴定法和重铬酸钾滴定法测定,ZDJ-4B自动电位滴定仪(上海仪电科学仪器股份有限公司)。
2 实验原理及过程
阴离子膜将电解槽分为阴极室和阳极室。在电解过程中,阴极室中发生的电极反应为:
Fe2++e → Fe
(1)
Fe3++e → Fe2+
(2)
2H++2e→H2↑
(3)
阳极室中发生的电极反应为:
2Cl--2e → Cl2↑
(4)
在阴极发生铁和氢的还原,而标准氢电位为0 V,但由于析氢过电位的存在,在实际电解过程中,析氢过电位(η)与电极材料、电流密度(j)有关,其关系式为:
η=a+blgj
(5)
式中:a、b为实验常数,在20±2℃,H+在钛电极析出a=0.82,b=0.14;η为析氢过电位;j为电流密度。
根据式(5)可以算出,在电流密度为1 A/dm2的条件下,钛板上的析氢电位为-0.56 V,高于Fe2+的标准还原电位-0.44 V,在一定的pH值条件下,可以实现电解还原Fe2+。在粉煤灰盐酸法制氧化铝工艺氯化铝结晶环节中,铁的最高浓度要求为0.02 g/L,在此浓度下通过热力学计算得出此时Fe2+的还原电位为-0.47 V,在理论上电解法除铁可以满足工艺要求。
电解槽阴极为钛板,阳极为石墨板,使用蠕动泵将阴极室与储槽相连,进行阴极室电解液循环,储槽保证电解过程中取样不影响阴极室液面高度,实验装置安装如图1。进行恒电流电解,电流密度范围为1 ~ 4 A/dm2,使用电位pH计时刻监测储槽pH值的变化,并每隔15 min从阴极室取样5 mL,进行重铬酸钾滴定测试Fe2+浓度。待溶液中Fe2+浓度达到稳定值后,停止电解,取阴极溶液进行全铁浓度检测。
3 结果与分析
3.1 电解反应过程
阴极室电解液为Fe2+初始浓度5 g/L的FeCl2溶液,对其进行恒电流电解,初始pH值为0.7、电流密度为1 A/dm2,电解温度为20℃。时刻检测电解液pH值,每隔15 min对阴极室进行取样5 mL,并使用重铬酸钾滴定法检测Fe2+浓度,得到阴极室电解液Fe2+浓度和pH随时间的变化曲线,绘制于图2中。
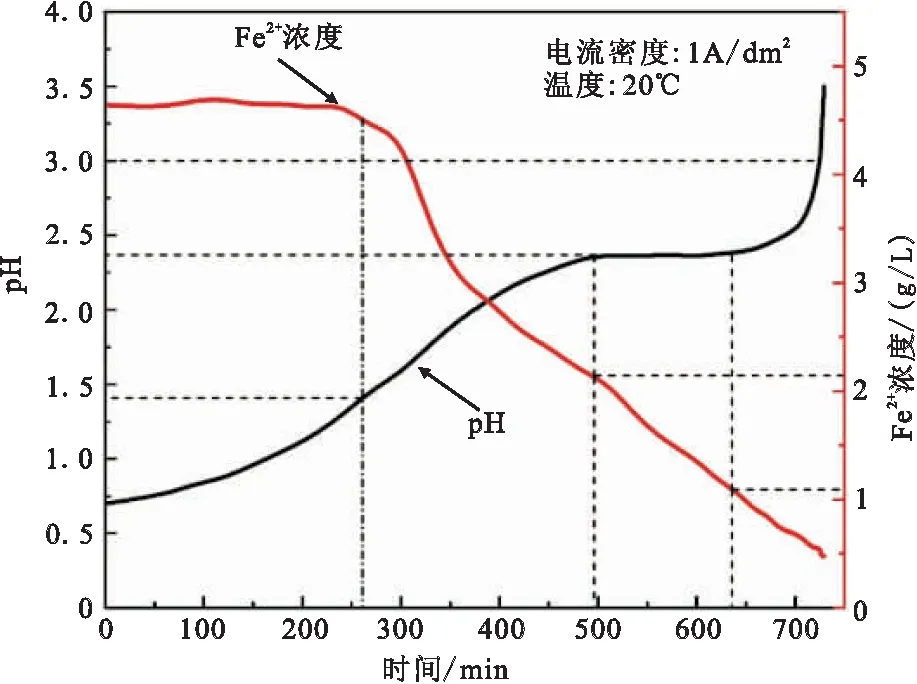
图2 阴极室电解液pH值和Fe2+浓度随时间的变化曲线(初始pH值0.7,Fe2+初始浓度5g/L,恒电流密度1A/dm2,电解温度20℃)
在前250 min中,Fe2+浓度没有发生变化,pH随着电解的进行逐渐升高,在此过程中阴极反应是H+的还原(反应3)。这是因为溶液中的H+浓度大于Fe2+浓度,H+的析出电位正于Fe2+,H+在阴极得到电子还原为氢气,并以气泡的形式排出,所以在电解初期的反应主要是氢的还原。
在260到500 min之间,电解液pH值升高到1.5左右,Fe2+浓度开始降低明显。同时发生反应Fe2+的还原(反应1)和H+的还原(反应3),这是因为随着H+的还原消耗,H+浓度降低,阴极表面H+与Fe2+析出电位接近,H+和Fe2+的还原同时进行,发生铁和氢气的共析出。
在500到640 min之间,pH值升高至2.4左右,并且维持在一个稳定的状态,阴极发生的主要反应为Fe2+的还原(反应1)。这是因为此时阴极室中Fe2+的浓度高于H+的浓度,在阴极周围的传质主要是Fe2+,只有少量的H+可以在阴极进行还原,主要发生的是Fe2+的还原。此外,H+的消耗使过电位不断变大,低于Fe2+的还原电位,使其析出变缓。
在640到720 min之间,pH继续开始增大,而且变大的趋势越来越快,Fe2+浓度下降到1 g/L左右。阴极溶液随着反应的进行颜色变得越来越黄,当pH值为3左右的时候,有红褐色的Fe(OH)3胶体产生。pH值增大到3.5左右,停止电解,反应结束。
电解过程既要满足Fe2+的还原,又要尽量避免Fe(OH)3的产生影响除铁,电解的pH值应该在1.5到3.0之间。
3.2 Fe2+初始浓度对除铁的影响
对阴极室中Fe2+初始浓度为1、3和5 g/L的FeCl2电解液进行恒电流电解。为控制阴极室电解液pH恒为2.00,电解过程中时刻检测储槽的pH,并使用蠕动泵向阴极室添加HCl,使阴极消耗的H+量与加入的H+量保持平衡,电流密度为2 A/dm2,电解温度为20℃。每隔15 min对阴极室进行取样5 mL,并采用重铬酸钾滴定法检测Fe2+浓度,得到不同初始浓度条件下Fe2+浓度随时间的变化曲线,绘制于图3中。
通过比较不同初始Fe2+浓度条件下的曲线,可以看出Fe2+浓度随着电解的进行而减少,并且减少的速率逐渐变缓,最终Fe2+浓度趋于稳定。三条曲线的变化趋势相同,初始浓度为5 g/L的曲线在前100 min Fe2+浓度降低到3 g/L,在100到290 min之间,Fe2+浓度由3 g/L降低到1 g/L与初始浓度为3 g/L的曲线用时相同,在290到340 min之间,Fe2+浓度由1 g/L降低到最低浓度与另两条曲线用时相同。分别对Fe2+达到平衡后的阴极液进行全铁浓度检测,得到三种条件下电解除铁后的总铁浓度,如表1所示。通过比较三种条件下的总铁浓度,可以看出总铁浓度几乎相同,以上说明初始Fe2+浓度只影响电解的时间长短,对电解后总铁浓度没有影响。
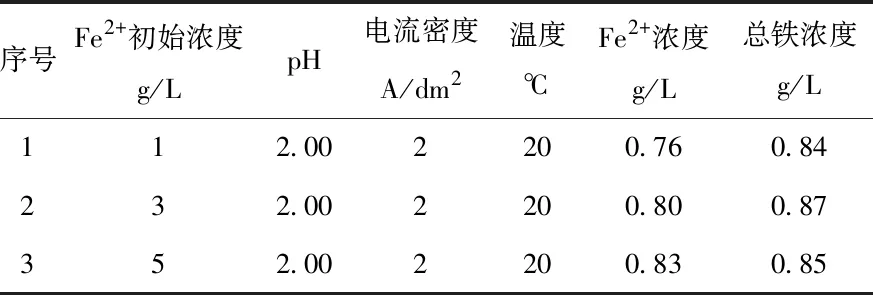
表1 不同初始Fe2+浓度电解后的铁浓度
3.3 电解液pH对除铁的影响
阴极室电解液为Fe2+初始浓度3 g/L的FeCl2溶液,进行恒电流电解,电流密度为2 A/dm2,电解温度为20℃,使用同样方法控制电解过程的pH分别恒定为2.00、2.25、2.50、2.75和3.00。每隔15 min对阴极室取样5 mL,并检测其Fe2+浓度,得到不同电解pH条件下阴极室电解液Fe2+浓度随时间的变化曲线,绘制于图4中。
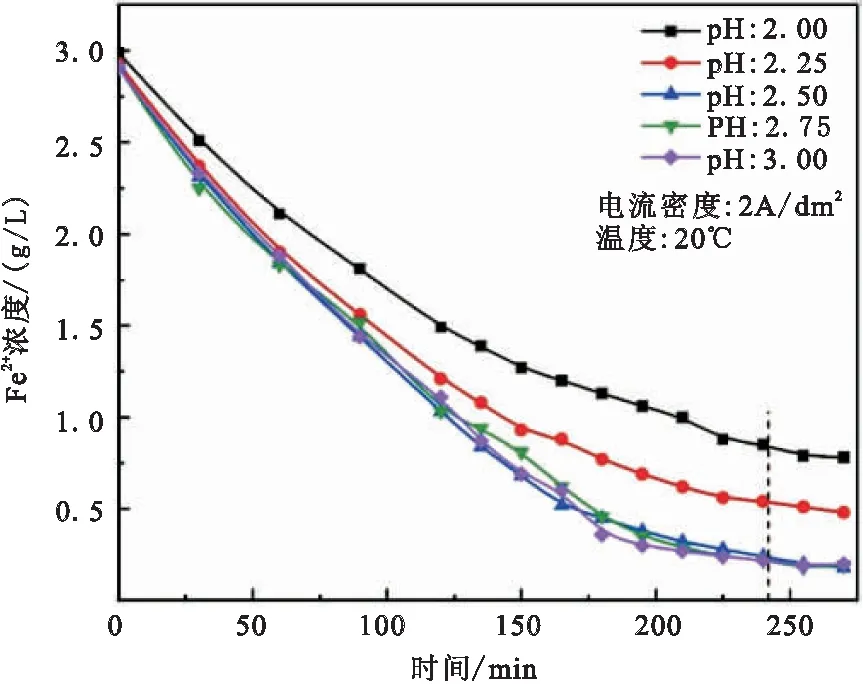
图4 不同电解pH条件下阴极室电解液Fe2+浓度随时间的变化曲线(pH值分别恒定为2.00、2.25、2.50、2.75、3.00,Fe2+初始浓度3g/L,恒电流密度2A/dm2,温度20℃)
观察不同电解pH值条件下Fe2+浓度随时间变化曲线,可以发现Fe2+浓度快速下降,在240 min左右达到基本平衡。在电解过程中阴极室电解液Fe2+浓度的下降速度逐渐减缓,原因是当Fe2+浓度下降,通过溶液传质以及阴极吸引而达到阴极附近还原的Fe2+也会减少,由于是恒电流电解,阴极附近的Fe2+减少,就会有更多的H+被电子还原,从而使Fe2+浓度的下降趋势逐渐减缓。
通过比较电解pH值为2.00、2.25和2.50的三条曲线,可以发现电解pH值越大,Fe2+浓度下降的越快。电解结束的Fe2+浓度分别为0.85、0.52和0.17 g/L,除铁效果变好。这是因为溶液pH值增高,阴极溶液中的H+浓度减少,在电解过程中被用于还原Fe2+的电子变多,有利于电解除铁的进行。电解pH值为2.50、2.75和3.00的三条曲线具有同样的变化趋势,最终Fe2+浓度也几乎相同,分别为0.17、0.20和0.19 g/L。这说明电解pH值增大到2.50之后,阴极溶液中的H+浓度已经降低到一定程度,继续降低也无法直接影响Fe2+的除铁效果。
对电解结束的阴极溶液取样进行全铁浓度检测,得到电解液pH值不同条件下电解除铁后的总铁浓度,如表2所示。最终总铁浓度高于Fe2+浓度,这是因为电解过程中阴极室的Fe2+会与电解液中的O2反应生成Fe3+,并在反应过程后期生成Fe(OH)3胶体。
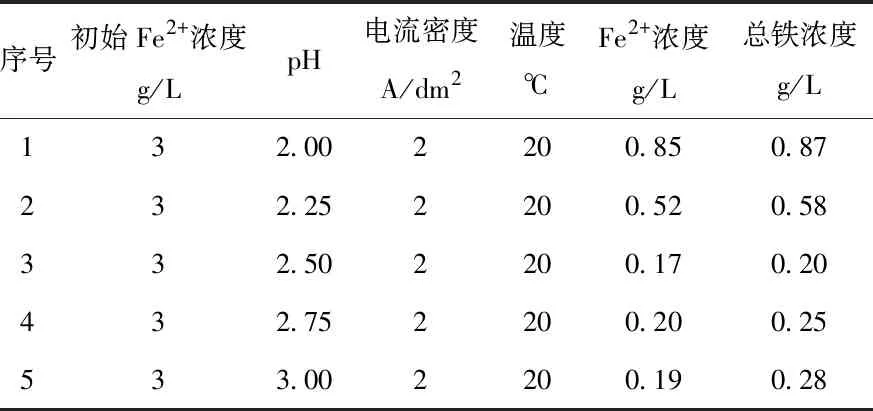
表2 不同电解pH值电解后的铁浓度
4Fe2++O2+4H+4Fe3++2H2
(6)
Fe3++3OH-→Fe(OH)3
(7)
随着电解的进行,可以观察到阴极室电解液缓慢的变黄,这是因为Fe3+与Cl-配位生成黄色的[FeCl4(H2O)2]-所致,说明溶液中有三价铁存在。电解液中的Fe3+会通过还原为Fe2+(反应2),但由于配位作用和传质的限制,不能使全部Fe3+都还原为Fe2+。电解液pH值大于2.50时,溶液中的Fe3+易于生成Fe(OH)3胶体沉淀。一旦生成Fe(OH)3胶体,难以恢复成离子状态,影响铁的还原析出。所以,电解液pH对电解除铁有一定影响,在低于2.50时电解液pH值的增高,电解后铁浓度会下降,当电解液pH高于2.50之后,电解后总铁浓度反而会增高。
3.4 电流密度对除铁的影响
阴极室电解液为Fe2+初始浓度3 g/L的FeCl2溶液,进行恒电流电解,电流密度分别为1、2、3和4 A/dm2。控制电解过程的阴极室电解液pH值恒为2.50,电解温度为20℃,得到阴极室电解液Fe2+浓度随时间的变化曲线,绘制于图5中。
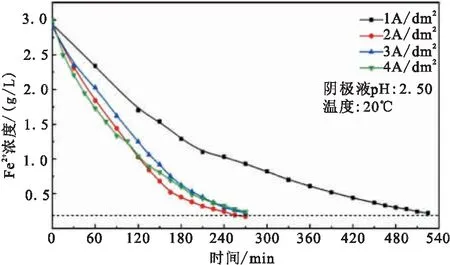
图5 不同电流密度条件下阴极室电解液Fe2+浓度随时间的变化曲线(恒电流密度分别为1、2、3和4 A/dm2,电解pH值为2.50,Fe2+初始浓度3 g/L,温度20℃)
通过比较恒电流密度为1和2 A/dm2的两条曲线,可以看出电流密度越大,Fe2+浓度下降的速度越快,电流密度为1 A/dm2达到Fe2+极值浓度的时间是2 A/dm2的2倍。比较恒电流密度为2、3和4 A/dm2的三条曲线,发现电流密度过高不会继续使Fe2+浓度下降的更快。虽然电流密度增高,但是阴极溶液中的传质速率有限,阴极表面传质层变厚,不能及时将Fe2+传递到阴极附近,发生Fe2+的还原反应,占阴极反应主体的是H+的还原反应。通过电解过程中Fe2+和H+还原量进行计算,得到整个电解过程中用于还原Fe2+的电子占总量的比例分别为22.43%(2 A/dm2)、16.78%(3 A/dm2)和13.40%(4 A/dm2)。
对电解结束的阴极溶液取样进行全铁检测,得到不同电流密度条件下的电解除铁后的总铁浓度,如表3所示。电流密度从1增加到2 A/dm2,总铁浓度下降到0.2 g/L,但增加到3和4 A/dm2后总铁浓度不降反升,这是由于对于初始浓度为3 g/L的FeCl2溶液,3和4 A/dm2的电流密度值过高,还原后的铁单质在电极表面以枝晶状存在,并随着电解的进行脱落,进入阴极室电解液中。在酸性条件下,铁单质失去了阴极保护会与H+发生置换反应,从而重新溶入电解液中。除此之外,电流密度过大会快速消耗H+导致阴极附近局部pH升高,阴极液中的Fe3+可能生成Fe(OH)3,导致电解后总铁浓度增加。
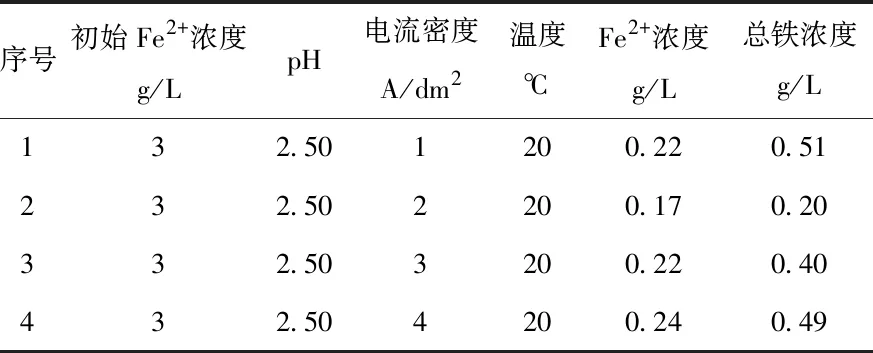
表3 不同电流密度条件下电解后的铁浓度
对于Fe2+初始浓度为3 g/L阴极室电解液,最佳的电流密度为2 A/dm2。值得注意的是在电解过程中,Fe2+浓度在不断下降,每个Fe2+浓度所对应的最佳电流密度也在时刻发生变化,其中的对应关系需要进一步实验来确定。
3.5 电解温度对除铁的影响
对阴极室电解液Fe2+初始浓度为1 g/L的FeCl2溶液进行恒电流电解,控制阴极室电解液pH值恒为2.50,电流密度为1 A/dm2,电解温度分别为20、30和40℃,得到不同温度条件下阴极室电解液Fe2+浓度随时间的变化曲线,绘制于图6中。

图6 不同温度条件下阴极室电解液Fe2+浓度随时间的变化曲线(电解温度分别为20、30和40℃,电解pH值恒为2.50,Fe2+初始浓度1 g/L,恒电流密度1 A/dm2)
通过对比电解温度为20、30和40℃的曲线,可以看出,Fe2+浓度的下降速度随温度升高而提高,下降到0.4 g/L的时间分别为110 min(20℃)、80 min(30℃)和60 min(40℃)。这是由于温度升高,Fe2+从溶液主体向电极表面的扩散速率提高,有利于阴极表面金属铁析出。随着电解进行(Fe2+浓度<0.4 g/L),Fe2+浓度下降速度变化都趋于平缓,三条曲线接近平行,这是因为Fe2+的浓度较低时,此时阴极的主体反应是H+的还原,提高温度对Fe2+的还原影响较小。
对电解结束的阴极溶液取样进行全铁检测,得到不同温度条件下的电解除铁后的总铁浓度,如表4所示。随着电解温度的升高,电解后的全铁浓度随之减小,但阴极液中Fe2+的比例分别为66%(20℃)、59%(30℃)和48%(40℃),温度的升高使电解液中的Fe3+比例升高,继续增加电解温度可能会导致Fe2+的氧化加剧,影响电解除铁的进行,故没有继续升高温度。
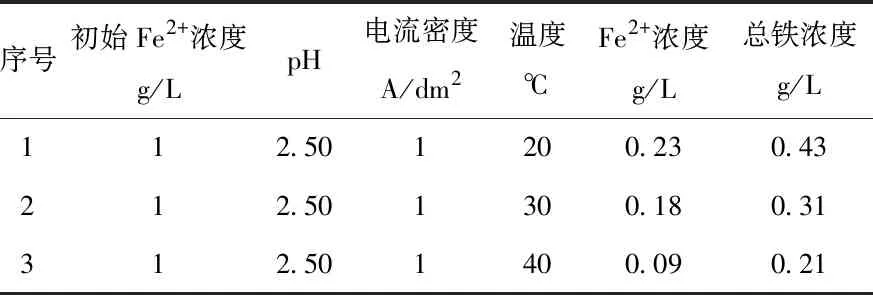
表4 不同温度条件下电解后的铁浓度
4 结 论
1)电解除铁的本质问题是铁和氢的共析,Fe2+的初始浓度只影响电解时长,对除铁的效果没有影响。
2)电解除铁的pH值应在1.5到3.0之间,pH越高电解后总铁浓度越低,最佳的电解pH值为2.50。pH继续增高会导致Fe(OH)3胶体生成,使电解后总铁浓度增高。
3)阴极室电解液Fe2+初始浓度为3 g/L时,最佳的电流密度为2 A/dm2。电流密度低时(1 A/dm2)电解时间长,电流密度过高时(3和4 A/dm2)电解除铁的效率变低,总铁浓度升高。
4)当Fe2+浓度大于0.4 g/L时,温度越高电解除铁速率越高,但对Fe2+浓度<0.4 g/L时影响不显著。

