基于免疫组化和癌症基因组图谱数据分析SOD1在宫颈癌中的表达
林冰洁,王齐心,聂晓菁,2,张孜睿卓,史永华,2
(1.新疆医科大学基础医学院病理学教研室,新疆 乌鲁木齐 830017;2.新疆医科大学新疆地方病分子生物学重点实验室,新疆 乌鲁木齐 830017)
宫颈癌(cervical cancer,CC)是威胁女性死亡的主要原因之一,2020年全球约有60万例新发病例和34万例死亡[1],是仅次于乳腺癌、结直肠癌、肺癌的第四常见肿瘤[2]。中国是宫颈癌发病率和死亡率最高的国家之一[3]。宫颈癌的一个重要临床病理特点是常伴有慢性炎症。微环境中持续存在的炎性刺激和缺氧致使活性氧簇(reactive oxygen species,ROS)显著增多,局部代谢异常。为抵抗过量的ROS,癌细胞内的抗氧化系统也相应增强,此时抗氧化途径的激活被认为是癌症发生过程的一个关键事件[4]。
超氧化物歧化酶(superoxide dismutases,SOD)是一种催化超氧化物自由基脱位为过氧化氢和分子氧的抗氧化酶。SOD1(Cu/Zn-SOD)作为其中的一种异构体,主要分布在细胞内,是一种内源性蛋白[5]。SOD1作为一种抗氧化剂,除与衰老相关的氧化应激有关外[6],还在调节细胞、保护基因组DNA稳定方面发挥重要的作用[7]。由于SOD1能够清除自由基,通常被认为其具有抑癌作用。深入研究发现,随着癌细胞内的ROS浓度升高,其引起的氧化应激反应随之上调,在肺肿瘤、乳腺肿瘤和鼻咽癌中均观察到SOD1表达升高[8-11]。本次研究旨在探讨SOD1在宫颈癌中的表达及其临床意义。
1 资料与方法
1.1 一般资料
选择新疆医科大学附属肿瘤医院2016年11月至2019年8月手术切除标本共150例,包括宫颈鳞癌、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN) II-III和正常宫颈组织各50例。纳入标准:宫颈鳞癌均经病理确诊;无严重并发症;有完整的病理资料。所有研究对象均知情同意自愿参与研究。收集标本相关的临床病理信息,包括年龄、临床分期、肿瘤直径、病理分级、浸润深度、淋巴结转移等。临床分期根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)的标准确定。
1.2 免疫组化
应用免疫组化(immunohistochemistry,IHC)检测SOD1在宫颈组织中的表达。按照免疫组化的常规操作进行,即准备好2μm厚的石蜡宫颈组织切片,脱蜡水化,抗原修复后滴加抗SOD1兔单克隆抗体(Priteintech,22206-1-AP) 4℃过夜,然后二抗室温孵育(羊抗兔IgG,中国北京中杉金桥公司)30分钟,3,3’-二氨基联苯胺(3,3N-Diaminobenzidine,DAB)显色,苏木素复染,脱水,透明,封片。SOD1染色由两名新疆医科大学病理教研室的专家审阅评价。SOD1结果用Image Pro Plus6.0软件进行量化分析。
1.3 TCGA数据库分析
本研究借助R2生物信息平台(http://hgser-ver1.amc.nl/cgi-bin/R2/main.cgi)对TCGA-305-rsem-tcgars数据集宫颈鳞癌组织样本中SOD1 mRNA的表达进行了数据挖掘,并分析KIM数据库中300例宫颈癌(包括宫颈鳞癌、腺癌和腺鳞癌)样本中SOD1 mRNA的表达水平与组织学类型的关系。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。计数资料用例数(n)和百分比(%)表示,组间比较采用卡方检验或方差分析。Kaplan-Meier法和Log-rank检验分析SOD1表达与生存的关系。P<0.05表示差异有统计学意义。
2 结果
2.1 SOD1在宫颈组织中的定位和表达
免疫组化结果显示,50例宫颈鳞癌中,38例(76%)SOD1表达阳性;50例CIN中,26例(52%)SOD1表达阳性;50例正常组织中,16例(32%)SOD1表达阳性。SOD1在宫颈鳞癌中表达最高、CIN次之、正常组织中最低,差异有统计学意义(χ2=19.50,P<0.05)。正常宫颈组织中SOD1均在胞浆中表达;CIN组织中,单纯胞浆表达12例,单纯胞核表达8例,胞浆和胞核均表达6例;宫颈鳞癌组织中,单纯胞浆表达7例,单纯胞核表达23例,胞浆和胞核均表达8例,见图1。在正常宫颈组织、CIN与宫颈鳞癌组织中,随着宫颈病变级别的升高,SOD1胞核阳性表达率逐渐升高,其差异具有统计学意义(χ2=6.850,P<0.05)。
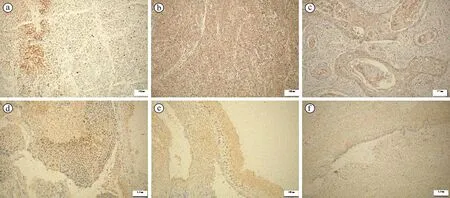
注:(a)宫颈鳞癌组织中SOD1的胞核表达;(b)宫颈鳞癌组织中SOD1的胞浆表达;(c)宫颈鳞癌组织中SOD1的胞核和胞浆共表达;(d)CIN组织中SOD1的胞核表达;(e)CIN组织中SOD1的胞浆表达;(f)正常宫颈组织中SOD1在基底细胞的表达(SP×200)。
2.2 宫颈鳞癌组织SOD1表达与临床病理参数的关系
在宫颈鳞癌中,SOD1的表达与组织浸润有关,其阳性表达组的宫颈癌浸润深度明显高于阴性表达组,差异具有统计学意义(χ2=10.424,P=0.001);SOD1的表达与病理学分级、肿瘤大小、淋巴结转移和临床分期均无关(P>0.05),见表1。
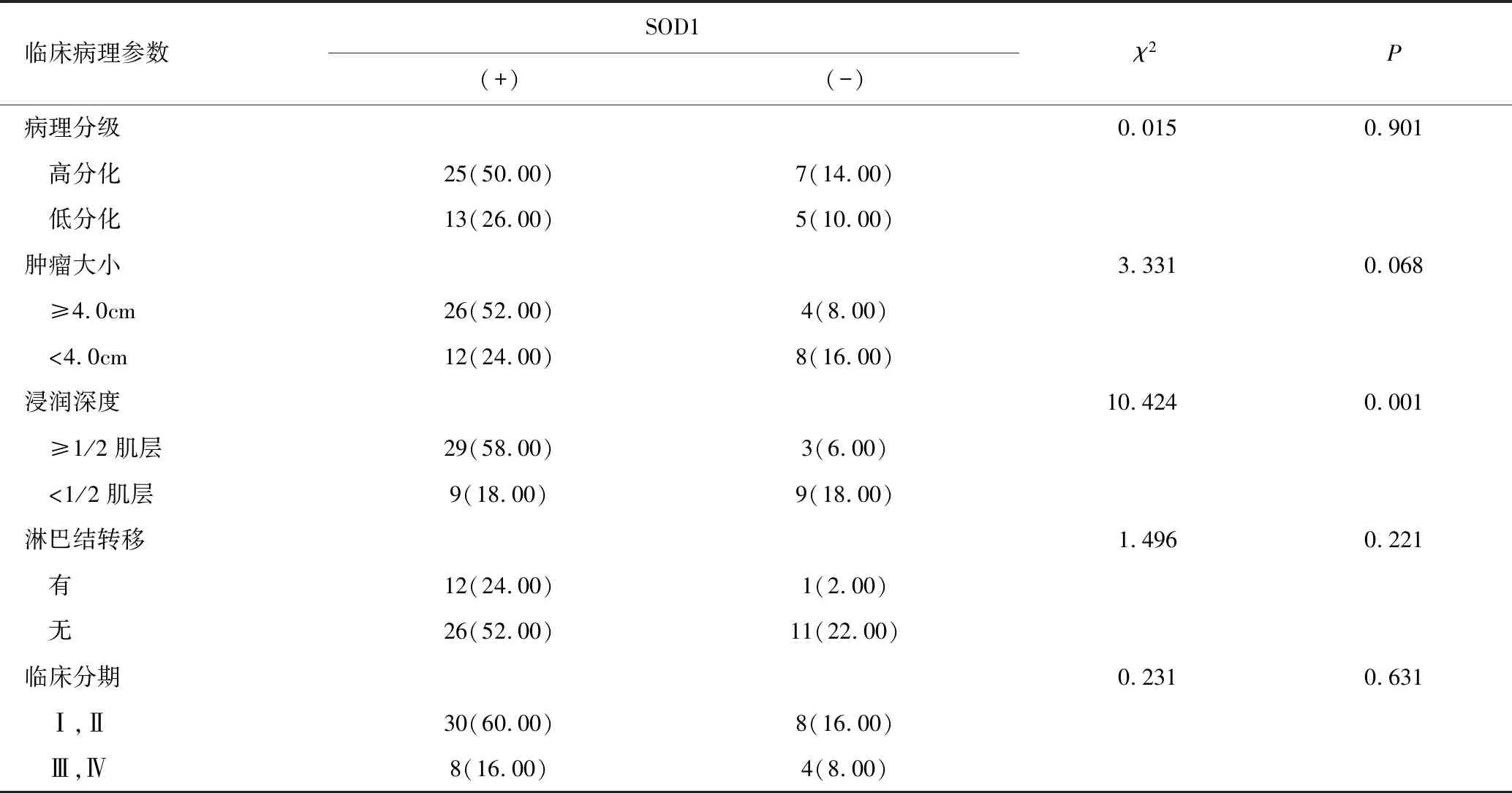
表1 宫颈鳞癌组织SOD1表达与临床病理参数的关系 [n(%)]
2.3 R2生物信息平台中SOD1表达分析
借助R2生物信息平台对TCGA-305-rsem-tcgars数据集宫颈鳞癌组织样本中SOD1 mRNA的表达进行了数据挖掘和分析,结果显示,SOD1 mRNA在宫颈癌所有临床分期中均表达,见图2。Kaplan-Meier生存分析提示,SOD1高表达组患者(120例)较SOD1低表达组(172例)具有更好的预后(χ2=5.18,P=0.023),见图3。对KIM-300-custom-ilmnht12v4数据集中宫颈癌组织样本SOD1 mRNA的表达情况进行分析,结果显示,SOD1在不同组织学类型宫颈癌中的表达差异具有统计学意义(F=4.84,P=0.009),见图4。
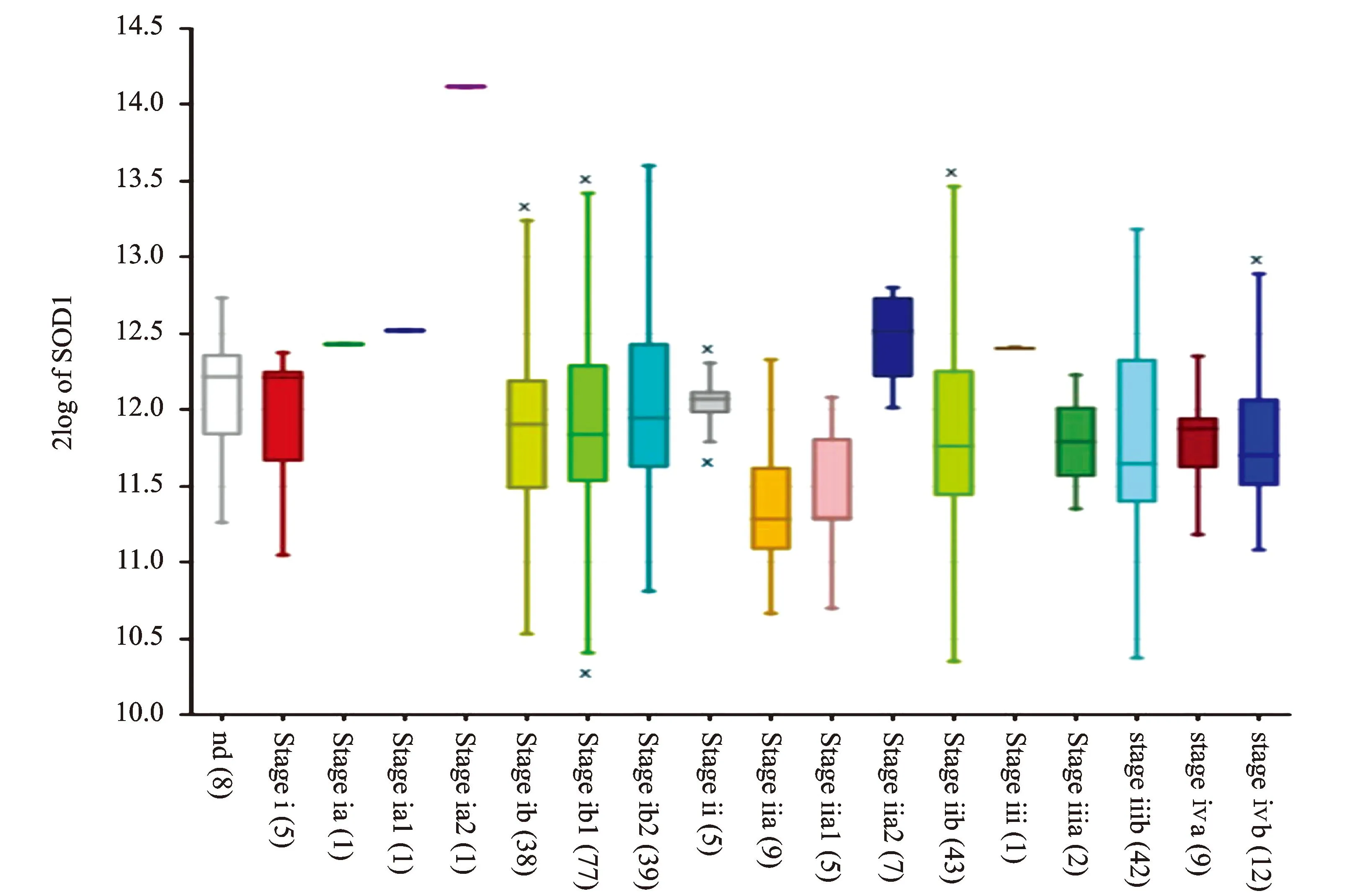
图2 SOD1 mRNA在305例宫颈鳞癌中的表达
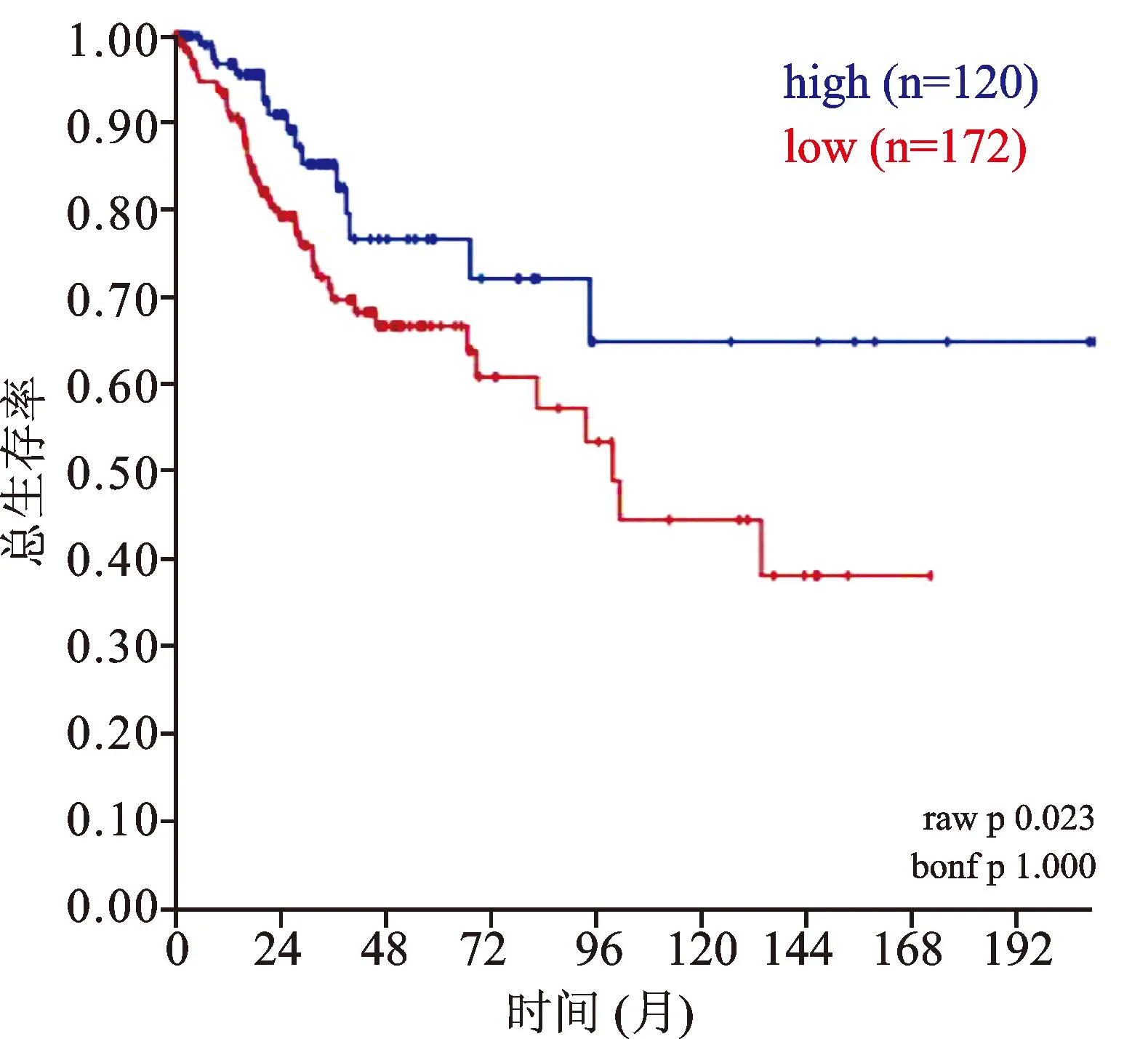
图3 292例宫颈鳞癌中SOD1表达与生存的关系
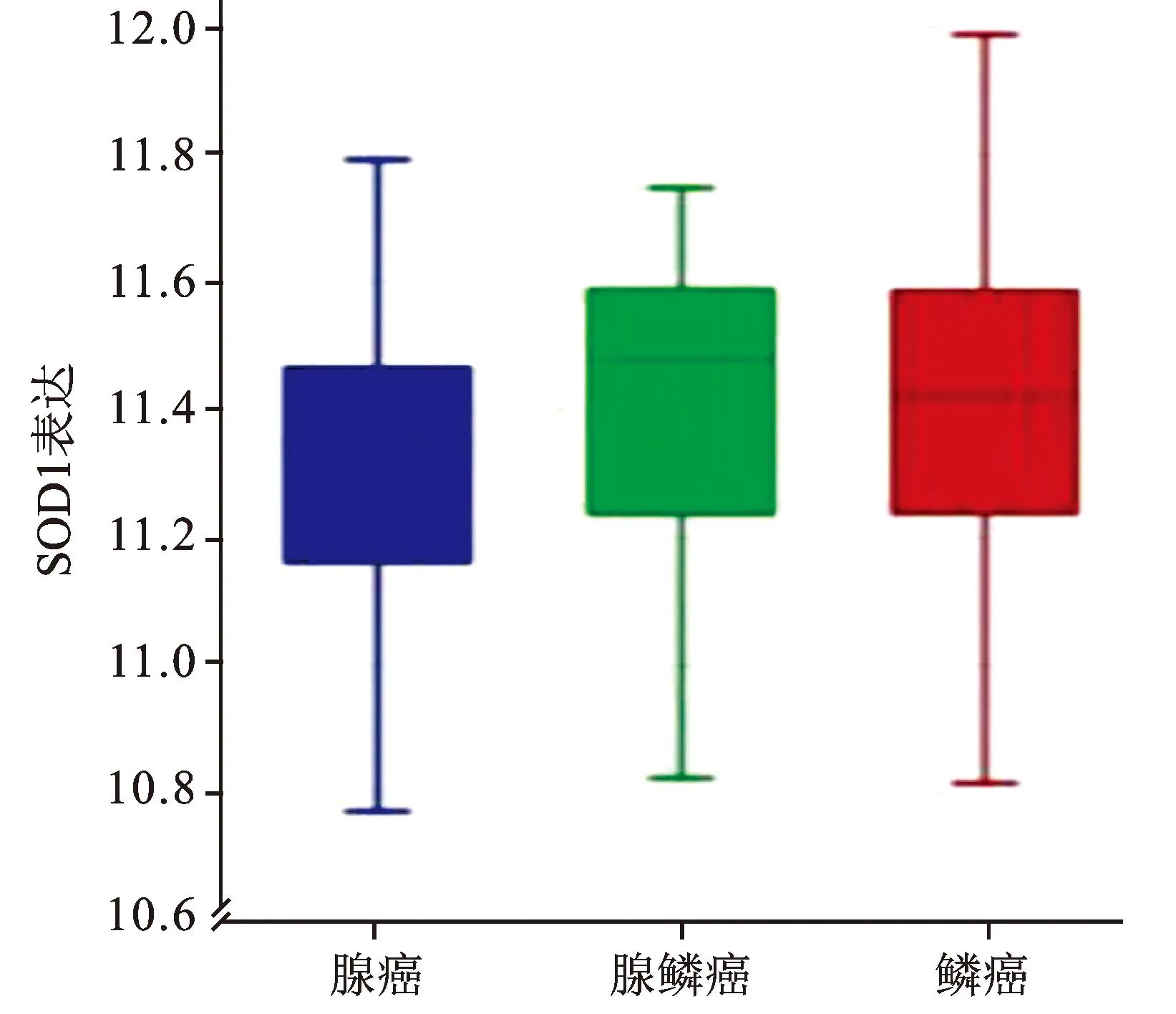
图4 300例宫颈癌中SOD1表达与组织学类型的关系
3 讨论
3.1 病理状态下SOD异常表达的生物学意义
SOD作为抗氧化系统的重要代表,其表达升高是慢性炎症持续刺激的必然结果。慢性炎症导致单核巨噬细胞系统的激活,产生高水平的ROS[12],ROS水平急剧增加至有毒浓度,氧化应激将造成不可逆的损伤[13]。此时,为抵抗过量的ROS,体内的抗氧化酶SOD表达上升。氧化应激和慢性炎症过程是紧密耦合的,如果不能阻止这些过程,可能会导致驱动癌变[14]。众所周知,宫颈癌与人乳头瘤病毒(human papilloma virus,HPV)持续感染密切相关,是慢性炎症相关癌症的典型代表。与正常细胞相比,癌细胞通常含有更高水平的ROS和抗氧化酶,特别是在晚期,癌细胞非常依赖高活性的抗氧化系统来维持快速增殖和存活[15]。人体中有三种SOD同工酶:SOD1提供了80%的总细胞SOD活性[16],在调节氧化应激反应中作为转录因子,可防止细胞过度损伤和凋亡[17];SOD2在不同类型的肿瘤中具有致癌和抑癌的双向作用[18];SOD3作为主要的ROS防御因子,在对胰腺导管癌的研究中发现其表达量降低与不良预后密切相关[19]。
本研究中,我们借助R2生物信息平台对TCGA-305-rsem-tcgars数据集305例宫颈鳞癌组织样本中的SOD1 mRNA表达进行了数据挖掘和分析,结果显示,SOD1高表达组患者的预后较好。同时对KIM-300-custom-ilmnht12v4数据集300例宫颈癌组织样本中的SOD1 mRNA表达分析提示,SOD1在宫颈腺鳞癌的表达高于其在鳞癌、腺癌中的表达,提示SOD1表达与宫颈癌的不同组织学类型相关。可见SOD在肿瘤发生发展中的生物学行为非常复杂,值得深入探讨。
3.2 宫颈癌中SOD1表达及其细胞定位的分析和意义
在本研究中,我们检测并分析了SOD1蛋白在宫颈病变内的表达,结果显示在正常宫颈组织、癌前病变、宫颈鳞癌中,随着宫颈病变级别的升高,SOD1的表达逐渐升高。有证据表明,SOD1是一种致癌基因,在体内促进癌细胞增殖,加速肿瘤发展,并在人类许多癌症中过表达。Li[20]等研究显示,SOD1在鼻咽癌中的表达显著增加,且高表达患者的生存时间较短。Gomez等[9]研究发现,SOD1对癌基因介导的乳腺癌细胞增殖至关重要,且增殖的特异性与癌细胞中超氧化物的升高相关,但在正常细胞中并没有观察到这些。此外,在所有分子亚型的乳腺癌内,SOD1表达升高与较低的生存率和转移增加密切相关。另有研究发现,SOD1也在多发性骨髓瘤中表达,其作用发生在疾病进展的较晚阶段,表明SOD1的表达增加提示着不良预后[21]。然而,本研究生物信息学分析表明SOD1高表达组的宫颈癌患者预后较好,与我们的实验结论及以上文献报道不一致,对此我们分析如下:生物信息学分析的结果是基于SOD1 mRNA的表达数据,我们的实验结果是基于免疫组化SOD1的蛋白表达数据,SOD1转录水平和翻译水平表达意义的不一致可能反映出SOD1存在翻译后调控或修饰。酶活性发挥的整体机制复杂,仅在转录或者翻译水平并不能推断酶最后的活性,此过程涉及翻译后修饰,细胞定位及与其他蛋白之间的互作。但这还需要我们进一步研究来佐证[22]。
SOD1作为转录因子参与到癌症进程中[23]。在HeLa细胞中,SOD1已被证明与癌基因和抑癌基因的启动子结合,通过下调抑癌基因、上调致癌基因促进肿瘤的发生。此外,SOD1除了抗氧化酶的作用外,还作为一种响应H2O2的调控蛋白,在许多哺乳动物基因的表达中发挥作用[24]。研究表明在应对高水平H2O2(0.4mM)的氧化应激时,SOD1会转移到细胞核,从而通过转录上调抗氧化基因的表达[17]。文献报道,核SOD1蛋白表达在多种人体组织中,尤其在睾丸、小脑、乳房、皮肤真皮层中表达丰富[23],并在乳腺癌和肺癌的细胞核中不断富集[4,9]。这支持了本研究中免疫组化染色实验结果,SOD1除在正常宫颈组织的胞浆内表达外,还表达于基底细胞胞核内。在正常宫颈组织逐渐进展为宫颈癌的过程中,SOD1在胞浆的表达逐渐减少,而在胞核的表达量逐渐增高。SOD1的表达与宫颈癌临床病理参数关系的分析结果显示,SOD1在胞核的表达与组织浸润有关。在对KRAS驱动的非小细胞肺癌(non-small cell lung cancer,NSCLC)的研究中报道,SOD1定位于细胞核,通过与PeBoW蛋白相互作用,在癌细胞增殖中起着重要的作用,并与NSCLC肿瘤的预后相关[4],这与本研究结果一致。
综上所述,在宫颈癌的发生、发展进程中, SOD1的异常表达与宫颈癌的浸润深度、组织学类型有关,宫颈癌中SOD1胞核表达量的增高对宫颈癌患者的预后具有一定的参考价值,开发其抑制剂用于联合抗肿瘤治疗具有潜在的可能性。

