多烯磷脂酰胆碱联合阿托伐他汀对酒精性脂肪肝患者肝功能及血浆ET、血清TNF-α的影响
邓广旭 廖芬 何笑金
现代人生活压力大, 饮食结构变化大, 导致近年来AFL 的发病率逐年升高。AFL 是由于长期大量饮酒,使肝细胞产生大量乙醛等毒性物质, 释放出大量的羟基和自由基, 引起机体代谢紊乱[1]。以肝区不适、食欲减退等为常见症状, 若得不到及时有效干预, 病情可发展为酒精性肝病、酒精性肝炎等, 继续发展可导致肝硬化, 甚至是肝癌, 治疗难度增大。对于AFL 的临床干预原则通常为药物保肝治疗、嘱患者戒酒、营养支持等。临床常用的保肝药物以PPC 为代表之一, 可有效降低机体炎性因子水平, 帮助氧自由基清除, 促进受损肝细胞修复和再生, 延缓和阻碍肝细胞发生坏死,保护肝功能。相关研究指出[2], 脂代谢紊乱在AFL 发生及推动病情进展中皆起着重要的作用。他汀类是获临床实践认可有效的调节血脂药物, 可降低血脂水平和肝中胆固醇含量, 对脂肪性肝病有良好的辅治作用[3]。本研究探讨PPC 联合阿托伐他汀治疗AFL 的疗效及对肝功能指标、血浆ET、血清TNF-α 的影响,现报告如下。
1 资料与方法
1.1 一般资料 选取2021 年2 月~2023 年2 月期间收治的98 例AFL 患者, 随机抽取分为对照组及观察组,各49 例。对照组中, 男31 例, 女18 例;年龄34~75 岁,平均年龄(57.13±7.79)岁;病程1~8 年, 平均病程(5.51±1.73)年;按超声表现为中度35 例, 重度14 例;按肝功能蔡尔德-皮尤改良评分(CTP)为A 级15 例,B 级22 例, C 级12 例;体质量指数(BMI)23.8~30.5 kg/m2,平均BMI(26.21±2.33)kg/m2。观察组中, 男28 例, 21 例;年龄35~74 岁, 平均年龄(57.24±7.61)岁;病程1~7 年,平均病程(5.27±1.69)年;按超声表现为中度37 例, 重度12 例;按CTP 评分为A 级17 例, B 级22 例, C 级10 例;BMI 23.2~30.1 kg/m2, 平均BMI(26.04±2.19)kg/m2。两组一般资料无统计学差异(P>0.05), 具有可比性。
1.2 纳入及排除标准
1.2.1 纳入标准 ①参照《脂肪性肝病》关于AFL的诊断标准[4], 经临床症状、酒精口服法负荷试验、肝功能检测、B 超检查等确诊;②年龄在34~75 岁;③病程≥1 年;④有长期饮酒史;⑤ALT 和AST 异常升高;⑥合并不同程度脂代谢异常;⑦首次接受脂肪肝相关药物治疗;⑧对研究均知情同意。
1.2.2 排除标准 ①合并免疫性肝病、病毒性肝炎、肝癌、肝硬化者;②伴下肢水肿、门静脉高压、黄疸、肝脾肿大者;③合并其他恶性肿瘤、全身感染者;④肾功能不全者;⑤对本研究用药有禁忌证或过敏史;⑥哺乳期、妊娠期妇女;⑦认知异常或精神疾病、治疗依从性差者。
1.3 治疗方法 两组患者均嘱咐戒烟酒、低脂高纤维饮食、适当有氧运动、补充维生素等。
对照组给予PPC 治疗。多烯磷脂酰胆碱注射液(成都天台山制药有限公司, 国药准字H20057684, 规格:5 ml∶232.5 mg)1 次/d, 10 ml/次, 静脉注射。观察组给予PPC 联合阿托伐他汀治疗。PPC 方案同对照组;阿托伐他汀钙片(浙江乐普药业股份有限公司, 国药准字H20133127, 规格:10 mg)1 次/d, 10 mg/次, 口服。两组皆连续治疗2 个月。
1.4 观察指标及判定标准 治疗前后取患者空腹肘静脉血, 经3000 r/min 离心15 min, 将血清与血浆分离, 分成3 份, 放入-80℃冰箱备用。仪器使用日立7180 型全自动化生化分析仪, 全程严格遵守实验室质控和试剂盒上说明书操作。
1.4.1 肝功能指标 采用中山创艺提供的试剂盒, 以速率法为检测方法, 对血清中ALT、AST 水平进行测定。
1.4.2 血脂指标 采用中山创艺提供的试剂盒, 以胆固醇氧化酶法检测TC, 以选择保护匀相法检测LDL-C,以抗体抑制匀相法检测HDL-C, 采用广州科方提供的试剂盒、以酶法检测TG。
1.4.3 炎性因子、血浆ET 采用深圳帝迈提供的CRP试剂盒, 以胶乳增强免疫散射比浊法检测血清中CRP,采用酶联免疫吸附试验(ELISA)检测血清TNF-α、血浆ET 水平。
1.4.4 临床效果 参考《脂肪肝防治指南》[5], 结合临床症状, 血脂、肝功能和B 超检查结果, 进行综合疗效评定。显效:食欲减退、周身乏力及肝区疼痛等症状完全消失, 血脂、肝功能指标恢复正常, B 超提示肝脏脂肪无明显沉积;有效:症状、血脂及肝功能指标有改善, B 超提示肝脏脂肪沉积减少;无效:症状、血脂、肝功能和B 超检查结果均无明显变化, 或加重。总有效率=(显效+有效)/总例数×100%。
1.4.5 不良事件 记录治疗期间恶心呕吐、周身乏力等药物不良反应, 并定期复查肾功能指标, 记录肾功能异常或血尿情况。
1.5 统计学方法 采用SPSS22.0 软件统计。以均数±标准差(±s)表示计量数据, 用t 检验;计数数据以率(%)表示, 用χ2检验。P<0.05 为有统计学差异。
2 结果
2.1 两组治疗前后肝功能指标比较 两组治疗后的ALT、AST 水平均比治疗前下降, 且观察组明显低于对照组(P<0.05)。见表1。
表1 两组治疗前后肝功能指标比较( ±s, U/L)
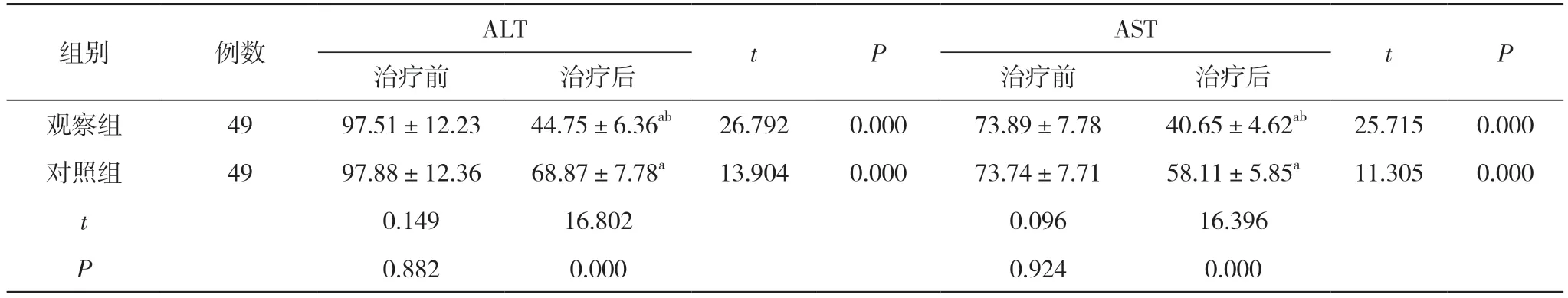
表1 两组治疗前后肝功能指标比较( ±s, U/L)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 ALT t P AST t P治疗前 治疗后 治疗前 治疗后观察组 49 97.51±12.23 44.75±6.36ab 26.792 0.000 73.89±7.78 40.65±4.62ab 25.715 0.000对照组 49 97.88±12.36 68.87±7.78a 13.904 0.000 73.74±7.71 58.11±5.85a 11.305 0.000 t 0.149 16.802 0.096 16.396 P 0.882 0.000 0.924 0.000
2.2 两组治疗前后血脂指标比较 两组治疗后的TG、TC、LDL-C 水平均比治疗前下降, HDL-C 水平比治疗前升高, 且观察组改善幅度比对照组更明显(P<0.05)。见表2。
表2 两组治疗前后血脂指标比较( ±s, mmol/L)
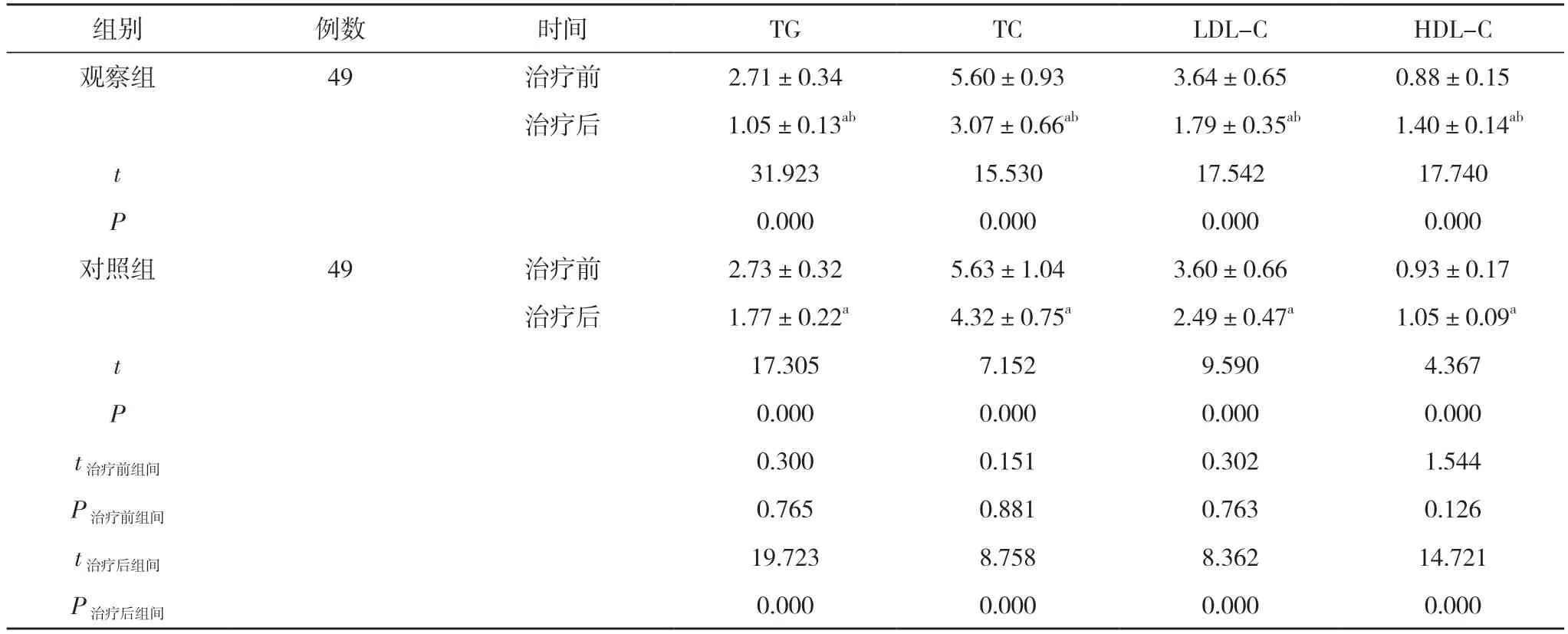
表2 两组治疗前后血脂指标比较( ±s, mmol/L)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 时间 TG TC LDL-C HDL-C观察组 49 治疗前 2.71±0.34 5.60±0.93 3.64±0.65 0.88±0.15治疗后 1.05±0.13ab 3.07±0.66ab 1.79±0.35ab 1.40±0.14ab t 31.923 15.530 17.542 17.740 P 0.000 0.000 0.000 0.000对照组 49 治疗前 2.73±0.32 5.63±1.04 3.60±0.66 0.93±0.17治疗后 1.77±0.22a 4.32±0.75a 2.49±0.47a 1.05±0.09a t 17.305 7.152 9.590 4.367 P 0.000 0.000 0.000 0.000 t治疗前组间 0.300 0.151 0.302 1.544 P治疗前组间 0.765 0.881 0.763 0.126 t治疗后组间 19.723 8.758 8.362 14.721 P治疗后组间 0.000 0.000 0.000 0.000
2.3 两组治疗前后炎性因子和血浆ET 水平比较 两组治疗后的CRP、TNF-α、ET 水平均比治疗前下降,且观察组明显低于对照组(P<0.05)。见表3。
表3 两组治疗前后炎性因子和血浆ET 水平比较( ±s)
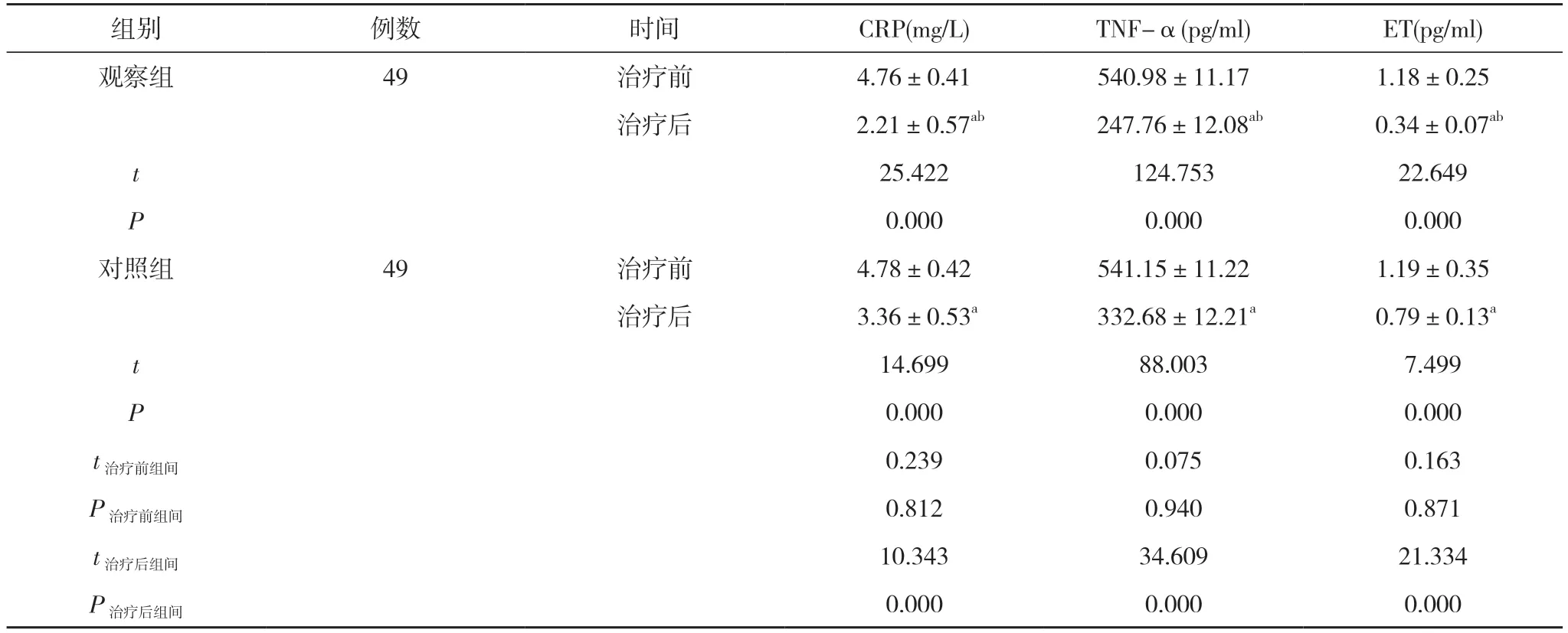
表3 两组治疗前后炎性因子和血浆ET 水平比较( ±s)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 时间 CRP(mg/L) TNF-α(pg/ml) ET(pg/ml)观察组 49 治疗前 4.76±0.41 540.98±11.17 1.18±0.25治疗后 2.21±0.57ab 247.76±12.08ab 0.34±0.07ab t 25.422 124.753 22.649 P 0.000 0.000 0.000对照组 49 治疗前 4.78±0.42 541.15±11.22 1.19±0.35治疗后 3.36±0.53a 332.68±12.21a 0.79±0.13a t 14.699 88.003 7.499 P 0.000 0.000 0.000 t治疗前组间 0.239 0.075 0.163 P治疗前组间 0.812 0.940 0.871 t治疗后组间 10.343 34.609 21.334 P治疗后组间 0.000 0.000 0.000
2.4 两组临床效果比较 观察组治疗后总有效率明显高于对照组(P<0.05)。见表4。

表4 两组临床效果比较[n, n(%)]
2.5 两组治疗期间不良事件发生情况比较 两组不良事件发生率无统计学差异(P>0.05)。见表5。

表5 两组治疗期间不良事件发生情况比较[n, n(%)]
3 讨论
AFL 是临床上常见的一种慢性肝病, 其发生主要与长期酒精饮用过量有关, 初时症状不典型, 随着病情发展至中、重度脂肪肝, 可出现食欲减退、周身乏力、肝区疼痛等症状, 病情继续进展, 甚至可出现肝纤维化、肝硬化、癌变等严重后果。临床建议早预防、早干预,基础干预手段一般是戒烟酒、营养干预、补充维生素等, 药物治疗多以保肝、降脂、抗氧化等药物为主, 以减轻肝损伤程度, 阻碍病情的进展。PPC 是常用的一种保肝药物, 其含B、E 族维生素, 有协助保护肝细胞功能的作用;通过主动结合肝细胞和其细胞器, 对胶原的合成及脂质过氧化过程进行抑制, 促进肝细胞膜的修复和维稳, 从而修复和保护受损的肝细胞生物膜、肝窦内皮细胞[6]。相关研究指出[7], PPC 可通过使低密度脂蛋白(LDL)下降, 高密度脂蛋白(HDL)升高, 促进机体摄取胆固醇的作用, 从而调节脂代谢。PPC 能激活卵磷脂胆固醇酰基转移酶与脂质代谢酶, 调节脂代谢过程, 促使肝内堆积胆固醇HDL 转化, 血清胆固醇水平随之明显下降。还有研究中指出[8], PPC 内含的不饱和胆碱成分, 可增强膜蛋白酶的生物活性, 从而使肝细胞的炎症纤维化变性的过程得到抑制, 预防和阻碍病情进展。但PPC 单一用药疗效不够理想, 尤其调节脂代谢方面的效果欠佳, 需辅以其他药物联合治疗, 协同增效。
本研究中, 两组治疗后的肝功能及血脂指标均比治疗前改善, 与对照组相比, 观察组各指标改善更明显, 且观察组治疗2 个月后的总有效率明显更高, 提示PPC 联合阿托伐他汀治疗AFL 的效果优于单用PPC 治疗, 可有效降低血脂水平, 保护肝功能。相关研究指出[9], 体内的脂质代谢紊乱与脂肪肝的发生、推动病情发展皆存在密切关系, 机体处于脂代谢紊乱之下, 肝脏代谢碳水化合物、脂肪酸的过程会受阻, 大量毒性物质堆积肝内, 诱导肝细胞氧化应激反应, 大量增殖星状细胞, 从而激发肝细胞损伤。因此, 临床认为在保肝治疗的同时, 积极采用降脂药物调节脂代谢紊乱, 可提升保肝治疗效果, 对减轻肝炎性损伤和氧化应激损伤有积极的作用, 改善预后[10-13]。阿托伐他汀是常用和有效的调脂类药物, 通过对TC、TG 结合血液胆固醇的通道进行阻断, 抑制LDL-C 的合成, 使得血液中脂蛋白、胆固醇的浓度下降, 抑制脂质在肝区内的堆积和释放, 还能使纤溶酶活性降低, 从而抑制其过度表达, 起到良好调节血脂、阻碍脂肪病变的发生和发展的作用, 有利于损伤的肝组织恢复[14-16]。
相关研究指出[17], 血浆ET 及相关炎性因子表达水平与肝脏损伤程度存在明显相关性, 因此, 血浆ET及炎性因子的高表达, 提示着机体处于肝细胞损害和炎症损伤状态。血浆ET 是细菌进入机体后, 会刺激激活环氧化酶和脂加氧酶的活性, 释放出大量的炎性因子, 如CRP、IFN-α、白细胞介素等引起炎症反应;还可刺激外周单个核细胞和中性粒细胞, 产生大量活性氧自由基, 引起肝氧化应激损伤;ET 还可对内皮细胞起作用, 产生多种生物活性因子, 内皮细胞和白细胞大量粘附, 从而介导由此所致的肝窦损伤[18-20]。本研究中, 两组治疗后的血浆ET 及炎性因子均比治疗前改善, 观察组改善更明显, 提示PPC 联合阿托伐他汀治疗AFL, 可有效降低炎症反应, 可能抑制由ET 所诱导的氧化应激肝损伤。另外, 本研究中两组治疗期间不良事件发生率无统计学差异(P>0.05), 提示PPC 联合阿托伐他汀治疗AFL, 不会增加胃肠道反应和肾脏毒性,安全性较好。
综上所述, PPC 联合阿托伐他汀治疗AFL 的疗效确切, 可有效降低炎症反应和血脂水平, 保护肝功能,不良事件少, 安全可靠。

