FOLFOX-肝动脉灌注化疗联合应用仑伐替尼和程序性死亡受体1抑制剂治疗中晚期肝癌
徐军红 姚红兵 王雪尧 郭威 陆才进 吴嘉兴 蒋建晖 赵东康
桂林医学院第二附属医院1放射介入科,2肝胆胰外科 (广西桂林 541199)
肝癌是一种全球范围内常见的恶性实体肿瘤,在发病率和患病率方面呈现上升趋势[1]。根治性切除是肝癌的主要治疗策略,但由于高复发和转移率,肝癌患者在手术后的5 年生存率仍然较低[2]。此外,缺乏早期肝癌特异性生物标志物,导致许多患者在晚期诊断,因此不适合手术,5 年生存率低于16%[3-4]。为了改善晚期肝癌患者的生存状况,医学界采用了多种治疗方法,其中系统化疗是常见的选择之一[5]。肝动脉化疗栓塞(transarterial chemoembolization,TACE)通过栓塞肿瘤组织的供血动脉,从而减少肿瘤细胞的血液供应来抑制肿瘤细胞生长。尽管目前TACE 作为晚期肝癌的一线治疗手段,但是TACE 不能有效延长晚期肝癌患者的疾病进展时间和客观缓解率,因此TACE 对部分肝癌患者的疗效有限[6]。近年来,FOLFOX 方案备受瞩目,作为以奥沙利铂为基础的一种化疗方案,展现出显著的治疗成效[7]。奥沙利铂通过抑制DNA 的复制和转录、阻碍细胞有丝分裂以及提高细胞内活性氧化物水平等途径,诱导癌细胞凋亡。奥沙利铂与氟尿嘧啶联合应用时,可发挥药物协同效应,如加强细胞毒性、提升治疗效果,并减少耐药性风险。此外,亚叶酸钙在FOLFOX 方案中的使用,能够抑制二氢叶酸还原酶活性、加强对腺嘧啶脱氧核苷的抑制、促进DNA合成抑制,增强氟尿嘧啶的抗肿瘤效应,并减少化疗药物对正常细胞的毒性作用[8]。因此,FOLFOX化疗方案在晚期肝癌患者中备受临床关注。这一治疗方案为晚期肝癌患者带来了希望,提高了患者的生存率和生存质量。肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)是一种用于治疗肝癌的局部治疗策略[9]。该方法通过经肝动脉直接输注化疗药物,实现药物在肝脏中的局部浓度增加,以提高药物在肿瘤组织中的有效浓度,同时降低对正常组织的毒性作用。相对于传统的静脉注射化疗方式,HAIC 具备以下优势:一是可实现高浓度药物的输注;二是可减少全身毒性的发生;三是有助于克服肿瘤对药物的耐药性现象[10]。免疫治疗在晚期肝癌的治疗中扮演着至关重要的角色。晚期肝癌常常具有复杂的免疫逃逸机制,使肿瘤细胞能够逃避免疫系统的识别和攻击,导致传统治疗方法的失效[11]。程序性死亡受体1(PD-1)是一种免疫检查点蛋白,其在活化的T 淋巴细胞表面表达,并与肿瘤细胞表面的PD-L1 结合,从而抑制T 细胞的杀伤功能,这种抑制使得肿瘤细胞能够逃避免疫系统的攻击[12]。PD-1/PD-L1细胞信号传导通路在肿瘤免疫逃逸中发挥着重要的作用。纳武利尤单抗(nivolumab)和帕博利珠单抗(pembrolizumab)是目前被广泛应用于晚期肝癌治疗的免疫检查点抑制剂。这些药物已经在国内外的治疗指南中被推荐用于那些对索拉非尼耐药或无法耐受索拉非尼的肝癌患者[13]。卡瑞丽珠单抗(sintilimab)是一种抗PD-1 单抗,被广泛研究和应用于肝癌的治疗中。一项Ⅱ期临床试验研究结果显示卡瑞丽珠单抗与贝伐单抗联合治疗组在中位无进展生存期和总生存期方面均显著优于索拉非尼治疗组[14]。本研究旨在评估卡瑞丽珠单抗联合仑伐替尼和FOLFOX 方案治疗晚期肝癌患者的临床疗效,以为临床治疗方案选择提供全面参考和指导。
1 资料与方法
1.1 一般资料 本研究以2021 年1 月至2023 年1月在桂林医学院第二附属医院收治的160例中晚期肝癌患者为研究对象。其中,男96 例,女64 例;年龄43 ~ 75 岁,平均(56.45 ± 4.69)岁;肝癌临床分期采用巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期系统进行,B期101例,C 期59;肝功能评价采用Child-Pugh 分类和ALBI 评分系统,肝功能Child-Pugh 分级:A 级98 例,B 级62 例;ALBI 分级,1 级:7 例,2 级:94 例,3 级:59 例。
纳入标准:(1)乙肝感染,诊断标准参照2017年发布的《原发性肝癌诊疗规范》,经上腹部B 超、增强CT/MRI、细胞学或病理学确诊;(2)年龄达到或超过18 周岁;(3)至少1 个可根据RECIST1.1 标准进行测量的病灶;(4)经组织病理学或细胞学确诊无法手术切除,并处于中晚期阶段;(5)美国东部肿瘤协作组(ECOG)评分为0-1;(6)Child-Pugh肝功能分级为A 或B 级;(7)预期生存期≥ 3 个月;(8)患者及其家属均已在知情的基础上签署了知情同意书,并对治疗方案有充分的了解。本研究经桂林医学院第二附属医院伦理委员会审批通过(编号:WSSY-2021002)。
排除标准:(1)原发性肝外肿瘤;(2)存在门静脉主干或腔静脉内癌栓;(3)曾有实体器官移植或骨髓抑制史;(4)需要全身治疗的急性自身免疫疾病;(5)存在自身免疫缺陷、需要接受类固醇或其他免疫抑制治疗。
1.2 分组和治疗方案 按照随机数字表法,将参与者分为对照组和观察组,每组80 例。对照组中男53 例,女27 例;年龄43 ~ 71 岁,平均(55.15 ±3.29)岁;肝癌临床分期,B 期51 例,C 期29 例;肝功能按Child-Pugh 分级,A 级患者为45 例,B 级为35 例,肝功能按ALBI 分级,1 级:3 例,2 级:48 例,3 级:29 例。观察组中男43 例,女37 例;年龄44 ~75 岁,平均(56.55 ± 4.31)岁;肝癌临床分期,B 期50 例,C 期30 例;肝功能按Child-Pugh 分级,A 级患者为53 例,B 级为27 例,肝功能按ALBI 分级,1 级:4 例,2 级:46 例,3 级:30 例。两组患者的资料比较,差异无统计学意义,具有可比性。
对照组患者给予TACE 治疗方案:患者取仰卧位,采用Seldinger 技术行股动脉穿刺插管至肝动脉,经数字减影血管造影检查后使用微导管超选择性的插入肿瘤靶血管,在X 线观察下注入5-氟尿嘧啶1 000 mg,奥沙利铂150 mg,阿霉素或者表阿霉素与超液碘化油15 mL 的混合乳化剂,注入碘化油化疗乳化剂的用量根据肝癌患者的一般情况、肝功能情况以及患者病灶大小确定,必要时加用Embosphere 微球栓塞。术后行穿刺股动脉局部加压包扎24 h,并且给予护肝、护胃等对症治疗。术后接受每日一次口服仑伐替尼治疗(体质量≥ 60 kg 者,剂量为12 mg;体质量<60 kg 者,剂量为8 mg),以及卡瑞丽珠单抗每3周1 次静脉输注治疗,剂量为200 mg。治疗周期为12 周。
观察组的患者均接受了FOLFOX 方案经HAIC治疗。HAIC的手术步骤如下:经股动脉进入,局部使用利多卡因麻醉。选择5F RH(右心)导管,将其放置于肝动脉,通过5 mL/s 的碘海醇进行造影,以确认肿瘤供血动脉。然后,使用2.7 FP rogreat微导管进入左/右肝动脉,或者固定在肝固有动脉位置。放置微导管后,注入20 mL 肝素水以防止导管凝血。外露部分的导管在腹股沟和右下腹盘旋固定,并覆盖无菌纱布。术后,患者在病房休息时,可间歇进行踝部运动,以预防下肢深静脉血栓形成。FOLFOX 方案为:奥沙利铂(法国赛诺菲安万特公司)85 mg/m2、亚叶酸(江苏奥赛康药业有限公司生产)400 mg/m2、氟尿嘧啶(上海锦帝九州药业有限公司生存)400 mg/m2静脉推注,随后氟尿嘧啶2 400 mg/m2持续静脉输注46 h,每3 周1 次。观察组除接受FOLFOX 方案经HAIC 治疗外,还同时接受每日一次口服仑伐替尼治疗(体质量≥ 60 kg者,剂量为12 mg;体质量< 60 kg 者,剂量为8 mg),以及卡瑞丽珠单抗每3 周1 次静脉输注治疗,剂量为200 mg。治疗周期为12 周。
1.3 临床疗效评价 两组患者在治疗方案实施后每3 周接受增强CT、磁共振成像等影像学检查,根据RECIST 1.1 标准评估实体瘤治疗的疗效。完全缓解(CR):根据增强CT、磁共振成像结果,靶病灶完全消失;部分缓解(PR):根据增强CT、磁共振成像结果,靶病灶的基线直径总和缩小超过30%。疾病进展(PD):根据增强CT、磁共振成像结果,靶病灶的基线直径总和增加120%或出现新病灶,包括肝外转移灶。疾病稳定(SD):根据增强CT、磁共振成像结果,靶病灶的基线直径总和介于PR和PD。临床疗效评价指标:客观缓解率(ORR)=(CR 例数+PR 例数)/总例数。疾病控制率(DCR)=(CR 例数+PR 例数+SD 例数)/总例数。无进展生存期(PFS)是指从治疗开始到疾病进展或死亡事件发生之间的时间段。总生存期(OS)是指从治疗开始到患者死亡的时间。
1.4 不良反应观察 按照CTCAE 5.0 的通用不良事件术语标准,对药物引起的不良反应进行分级评估。评估的不良反应包括以下标准:发热(体温> 38 ℃)、白细胞减少症(外周血白细胞计数持续< 4.0 × 109/L)、手足综合征(手足掌底部皮肤肿胀、剥落、水泡、皲裂、出血或红斑,伴有疼痛)、消化道反应(腹痛、厌食、腹泻、消化道出血、呕吐)、高血压、肾功能异常和脱发。这些指标被用来监测患者在治疗过程中药物不良反应的情况。
1.5 统计学方法 采用SPSS 22.0 软件对收集到的数据进行统计分析。对于符合近似正态分布的计量数据,使用均数±标准差来描述。对不同组间的比较,使用独立样本t检验;对同一组内部的比较,使用配对t检验。对于计数数据,使用n(%)来表示,使用χ2检验进行比较。利用Kaplan-Meier 方法绘制生存曲线,并用Log-rank 检验比较不同组间的差异。P< 0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效评价 经治疗后,观察组的ORR 为48.75%,对照组的ORR 为40%,两组的ORR差异无统计学意义。观察组的DCR为86.25%,对照组的DCR 为65%,观察组的DCR 显著高于对照组(P< 0.05)。见表1。

表1 两组临床疗效对比Tab.1 Comparison of clinical efficacy between two groups 例
2.2 两组生存状况比较 观察组的中位PFS 为15.69 个月,显著长于对照组的10.31 个月,差异有统计学意义。观察组的中位OS 为16.81 个月,显著长于对照组的9.89 个月,差异有统计学意义(P<0.05)(图1、2)。

图1 观察组和对照组肝癌患者的PFS 曲线Fig.1 PFS curves of liver cancer patients in the observation group and control group

图2 观察组和对照组肝癌患者的OS 曲线Fig.2 OS curves of liver cancer patients in the observation group and control group
2.3 两组不良反应发生情况的比较 两组在发热、白细胞减少症、手足综合征、消化道反应、高血压、肾功能异常、脱发发生情况的比较差异无统计学意义。见表2。
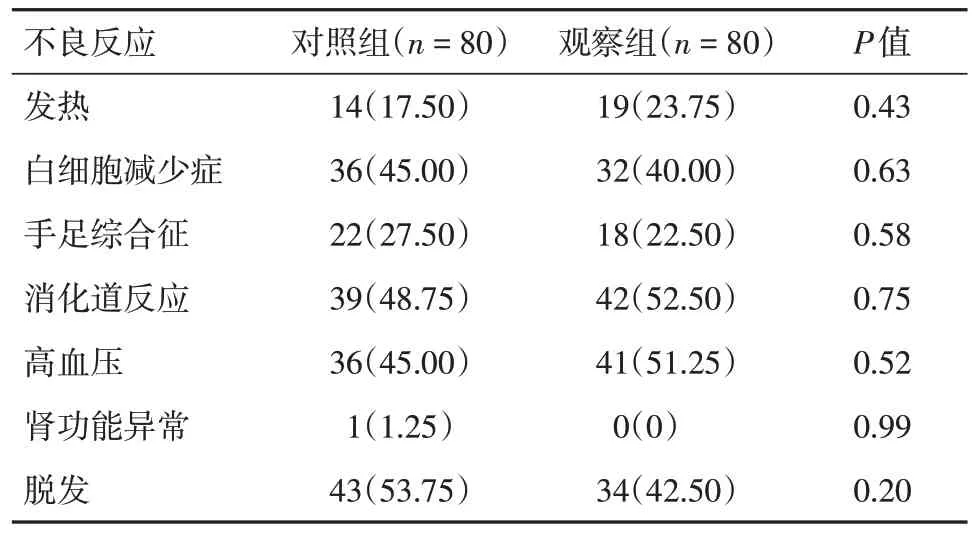
表2 两组患者的不良反应发生情况Tab.2 The incidence of adverse reactions in two groups 例(%)
3 讨论
当涉及到治疗中晚期肝癌的方案时,FOLFOX方案被广泛采用,并在改善患者的生存率方面表现出显著效果。针对中晚期肝癌,单一的靶向或免疫治疗常难以有效控制肿瘤发展,无法达到最佳的生存效果[15]。因此,联合治疗方案被广泛认可。多项研究已经证实,相较于独立使用靶向或免疫治疗,联合治疗在提高疾病控制率和延长患者生存时间方面效果更为显著。这种联合治疗的优势在于针对肝癌发展的多个关键途径进行干预,从而提高治疗效果。联合方案能够协同作用,抑制肿瘤生长和扩散,并增强免疫系统的抗肿瘤能力[16-17]。因此,联合治疗被视为一种更全面、有效的策略,为中晚期肝癌患者带来了新的治疗希望[18-19]。HAIC 通过将化疗药物直接注入肝动脉的方式,使药物浓度在肿瘤组织中高度集中,相比于静脉注射化疗,可以提供更高的药物浓度。这种局部给药的方式,可以减少药物对正常组织的毒性和副作用,相较于全身化疗,患者的整体耐受性可能更好。一项包括157 例肝癌患者的前瞻性随机研究[20]显示,通过将FOLFOX 方案与HAIC 联合使用仑伐替尼和特瑞普利单抗,能够显著延长肝癌患者的无进展生存期和总生存期。有研究[21]表明与单纯的PD-1 抑制剂联合仑伐替尼治疗相比,HAIC 联合PD-1 抑制剂和仑伐替尼对于肝癌患者的治疗效果具有显著的改善。这种联合治疗方案显著提高肝癌患者的疾病控制率,即减少肿瘤的进展和复发。此外,中位OS 和中位PFS也得到了显著延长,这表明联合治疗对于改善患者的生存状况具有重要意义。本研究结果显示,虽然没有提高客ORR,FOLFOX 方案与HAIC 联合使用仑伐替尼和卡瑞丽珠单抗治疗中晚期肝癌患者可提高DCR。
近年来,T 细胞检查点抑制剂作为一种重要的癌症治疗策略取得了显著进展[22]。T 细胞检查点是一种重要的免疫调节机制,用于维持免疫系统的平衡和防止过度的免疫活性。PD-1 是T 细胞上的一种免疫检查点分子,而PD-L1 是其配体[23]。当PD-L1 表达在抗原递呈细胞或肿瘤细胞上时,PD-1 与PD-L1 结合会发出抑制信号,阻断T 细胞的活化和攻击功能。这一信号通路有助于限制免疫细胞对正常组织的攻击,并维持免疫平衡。然而,肿瘤细胞可以利用这一机制来逃避免疫系统的攻击,通过高表达PD-L1 来抑制T 细胞的功能,从而实现免疫逃逸[24]。卡瑞丽珠单抗通过与免疫细胞表面上的PD-1 分子结合,阻断PD-1 与其配体PD-L1/2 的相互作用,从而恢复激活的T 细胞的抗肿瘤免疫应答[25]。卡瑞丽珠单抗已被批准用于治疗多种类型的癌症,包括肺癌、肝癌、鼻咽癌和恶性黑色素瘤[24]。研究[26]表明,卡瑞丽珠单抗能够显著提高患者的生存期和缓解肿瘤相关症状,同时具有可接受的安全性和耐受性。一项临床实验研究[27]结果显示通过HAIC 联合抗PD-1 免疫疗法的治疗方案可以有效提高肝癌患者的中位总生存期。联合应用FOLFOX 方案和PD-1 抑制剂可以协同作用,通过化疗和免疫治疗的双重机制,增强抗肿瘤效应,这种联合治疗策略已在多种癌症类型中取得了显著的疗效[21,28-29]。本研究结果显示,FOLFOX 方案与HAIC 联合使用仑伐替尼和卡瑞丽珠单抗治疗方案可以有效调高中晚期肝癌患者的OS 和PFS。化疗药物的药物毒性导致的不良反应可能会对患者的生存质量和治疗进程产生一定的影响。患者可能会经历身体不适、疼痛、乏力、情绪波动等不适感。研究结果显示,联合应用FOLFOX 方案和HAIC 治疗,辅以仑伐替尼和卡瑞丽珠单抗,并未带来额外的不良反应。这一观察提示了这种联合治疗方案在安全性方面的良好表现,为进一步探索治疗方案提供了有益参考。
综上所述,本研究采用了联合治疗策略,将FOLFOX 方案与HAIC、卡瑞丽珠单抗和仑伐替尼联合应用。这种综合治疗策略的优势在于同时针对多个肝癌发展的关键途径,提高了治疗效果。研究结果显示,联合治疗方案提高了OCR、OS 和PFS,联合治疗并未引发更多的不良反应,患者的耐受性良好。这一发现对于治疗方案的可行性和患者生存质量至关重要。虽然研究结果差异有统计学意义,但样本量相对较小,更大规模的临床研究可能需要进一步验证这些结果。此外,本研究的观察期为12 周,可能无法全面评估治疗的长期效果,进一步的长期随访研究将更有说服力。未来的研究可以考虑将基因型和临床特征纳入治疗策略,以实现更加个体化的治疗方案,提高治疗的针对性。
【Author contributions】XU Junhong and YAO Hongbing performed the experiments and wrote the article.WANG Xueyao,GUO Wei,WU Jiaxing,and JIANG Jianhui performed the experiments.ZHAO Dongkang revised the article.LU Caijin,XU Junhong and YAO Hongbing designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.

