三七对慢性肾衰竭大鼠Sortilin蛋白、Toll样受体及血管钙化的影响
黄志敏 陆良喜 江旖旎 刘晓羽 张知英 吴金玉
1广西中医药大学第一附属医院、广西中医药防治医学分子生物重点实验室(南宁 530023);2广西中医药大学研究生院(南宁 530001)
慢性肾脏疾病(chronic kidney disease,CKD)已经成为日益严重的公共健康问题,到2040 年预计CKD 将成为全球第五大最常见的死亡疾病[1]。心血管疾病被认为是慢性肾衰竭(chronic renal failure,CRF)患者的主要并发症和死亡原因。血管改变特别是动脉粥样硬化和血管钙化(vascular calcification,VC)是CKD相关心血管疾病死亡率的重要影响因素[2]。有研究[3]认为VC 主要出现在肾脏病的终末期或透析患者中,然而最近的动物模型证实VC 可以出现在肾脏病更早的阶段,可能在CKD 2 期就已出现VC,并且CKD 3 期以上患者VC 发病率较非CKD 患者高4 倍以上[4]。因此,寻找延缓CRF 血管钙化的药物对预防和降低CRF 心血管事件尤为重要。全基因组关联研究发现编码Sortilin 蛋白的Sort1 基因位于染色体1p13.3 位点,是血脂异常和冠状动脉粥样硬化的致病基因[5],氨甲酰化Sortilin 可能是CKD 血管钙化的危险因素[6]。Sort1 介导免疫细胞中相关炎症因子的表达,可能与Toll 样受体(Toll-like receptors,TLRs)TLR3、TLR4、TLR7、TLR9 信号通路相关[7]。肾脏替代治疗是西医的优势,中医药治疗CRF 的优势在于延缓早、中期疾病进展。本研究以Sortilin 为切入点,基于Sortilin 与TLRs 的生物学功能探讨三七对CRF 血管钙化的影响,阐明三七抗CRF 血管钙化的作用机制。
1 材料与方法
1.1 设计 随机对照动物实验。
1.2 时间及地点 于2022 年1 - 6 月在广西中医药防治医学分子生物重点实验室完成。
1.3 材料
1.3.1 实验动物及分组 12 周龄清洁级SD 雄性大鼠,体质量(210 ± 39) g,共36只。采购自长沙市天勤生物技术有限公司,许可证号是:SCXK(湘)2019-0014。本研究实验方案已通过实验动物福利伦理审查委员会批准(编号:DW20221221-242)。在广西中医药防治医学分子生物重点实验室饲养,保持室温18 ~ 25 ℃,分笼饲养。采用随机数字表法,把SD 大鼠随机分为正常组、模型组、三七低剂量组、三七中剂量组、三七高剂量组、骨化三醇组,每组6 只。动物实验过程中严格遵守伦理道德标准。
1.3.2 实验药物、主要仪器和试剂 腺嘌呤(A8330,25 g,厂家:Solarbio),三七单味配方颗粒(江苏省江阴市天江药业有限公司),骨化三醇胶丸(上海罗氏制药有限公司,国药准字J20150011)。
光学显微镜(日本OLYMPUS,BX43),透射电子显微镜(HITACHI,HT7800/HT7700),酶标仪(BIOTEK,Elx800),核酸蛋白定量仪(美国丹诺尔,DS-11),电泳仪(北京六一公司,DYCZ-24DN型)。茜素红S染色液(北京索莱宝科技有限公司,G1452),RUNX2 抗体(武汉三鹰,20700-1-ap),BMP2 抗体(affinity,AF5163),SM22α(affinity,AF9266),TLR7抗体(武汉三鹰,17232-1-AP),TLR9 抗体(Affinity,DF2970),Sortilin 抗体(武汉三鹰,12369-1-AP),山羊抗兔的二抗(北京中杉,ZB2301),山羊抗鼠的二抗(北京中杉,ZB2305),白介素-6(interleukin-6,IL-6)(伊莱瑞特,E-EL-R0015c),IFN-γ(联科生物,EK380),IL-17A(伊莱瑞特,E-EL-R0566c),IL-10(伊莱瑞特,E-EL-R0016c)。
1.4 实验方法
1.4.1 CRF 血管钙化模型制备[8]加适当蒸馏水将腺嘌呤制成混悬液,实验第1 ~ 4 周,除正常组外每日定时给予2.5%腺嘌呤混悬液[250 mg/(kg·d)]灌胃,同时联合使用1.8%高磷饲料喂养;第5 ~ 8周隔日予腺嘌呤灌胃。正常组普通饲料喂养。HE染色可见模型组大鼠肾小球变性,肾小管扩张、萎缩、变形,肾小管内可见大量炎症细胞浸润,间质纤维明显增生,肾小管及肾间质可见大片腺嘌呤结晶。提示模型成功。
1.4.2 给药干预 造模当天开始,采用水溶液灌胃方式给药,正常组和模型组大鼠每天灌胃等体积的0.9%生理盐水;大鼠中药给药剂量根据人-大鼠体表面积(1∶6.25)换算,同时给予成人药量的1、2、4 倍剂量:即分别以含生药0.45、0.9、1.8 g/kg三七颗粒水冲剂给三七低、中、高剂量组灌胃。骨化三醇组大鼠(参考陈奇主编《中药药理实验方法学》体表面积等效剂量换算比率按人常用量0.25 μg/d,大鼠剂量0.25 μg × 0.018 = 0.004 5 μg,200 g 体质量大鼠的剂量为0.004 5 μg,0.004 5 μg/0.2 kg=0.022 μg/kg,溶于生理盐水)每天给予骨化三醇胶丸水溶液灌胃。各组大鼠按1 mL/100 g 体质量灌胃,每天1 次,连续8 周。
1.5 主要观察指标
1.5.1 主动脉钙盐茜素红染色 剥离胸主动脉,固定组织,石蜡包埋,切片脱蜡至水洗,蒸馏水洗数次;加入茜素红S 染液染色5 ~ 10 min;蒸馏水冲洗;脱水透明,中性树胶封片固定。显微镜下观察钙盐沉积情况。
1.5.2 透射电镜观察主动脉钙化 4%多聚甲醛灌注,取材4 ℃固定液固定2 h,4 ℃下PBS 漂洗3 次,每次30 min。样品梯度脱水后,加入丙酮,对样品渗透、包埋、固化处理。修片样品厚度60 ~80 nm,用2.6%枸橼酸铅溶液避二氧化碳染色,在电镜下观察。
1.5.3 生化学指标检测 紫外比色法检测血清钙(Ca)、磷(P)、肌酐(Cr)、尿素氮(BUN)、总胆固醇(TC)、甘油三酯(TG)水平。
1.5.4 Western blot 法检测主动脉Sortilin、TLR7、TLR9、RUNX2、BMP2、SM22α蛋白表达 取50 mg主动脉组织于液氮中剪碎研磨成细粉末状,分装于离心管中,加入500 μL 的RIPA 裂解液,提取总蛋白。按操作步骤进行电泳、转膜,进行Sortilin(1∶2 000)、TLR7(1∶1 000)、TLR9(1∶1 000)、RUNX2(1∶1 000)、BMP2(1∶800)、SM22α(1∶1 500)免疫检测,成像仪中曝光、拍照。蛋白表达量=目的蛋白灰度值/内参灰度值。
1.5.5 ELISA 法检测大鼠血清IFN-γ,IL-6,IL-10和IL-17A 水平 严格按照ELISA 试剂盒说明书测定血清中IFN-γ,IL-6,IL-10 和IL-17A 浓度。
1.6 统计学方法 采用SPSS 22.0 软件做统计分析,服从正态分布并且方差齐计量资料以±s表示,不服从正态分布或者方差不齐计量资料以[M(Q)]表示。服从正态分布且方差齐采用单因素方差分析,事后检验采用LSD-t;不服从正态分布或方差不齐的,采用非参数检验。以P< 0.05 为差异有统计学意义。
2 结果
2.1 实验动物数量分析 实验所选用36 只SD雄性大鼠,在实验过程中无脱失,全部纳入统计分析。
2.2 各组大鼠主动脉钙盐沉积茜素红染色结果分析 正常组大鼠主动脉未见红色钙化点,模型组可见大面积红色钙盐沉积,与模型组相比,三七低、中、高剂量组和骨化三醇组钙盐沉积减少,其中三七中、高剂量组、骨化三醇组明显减少。见图1。
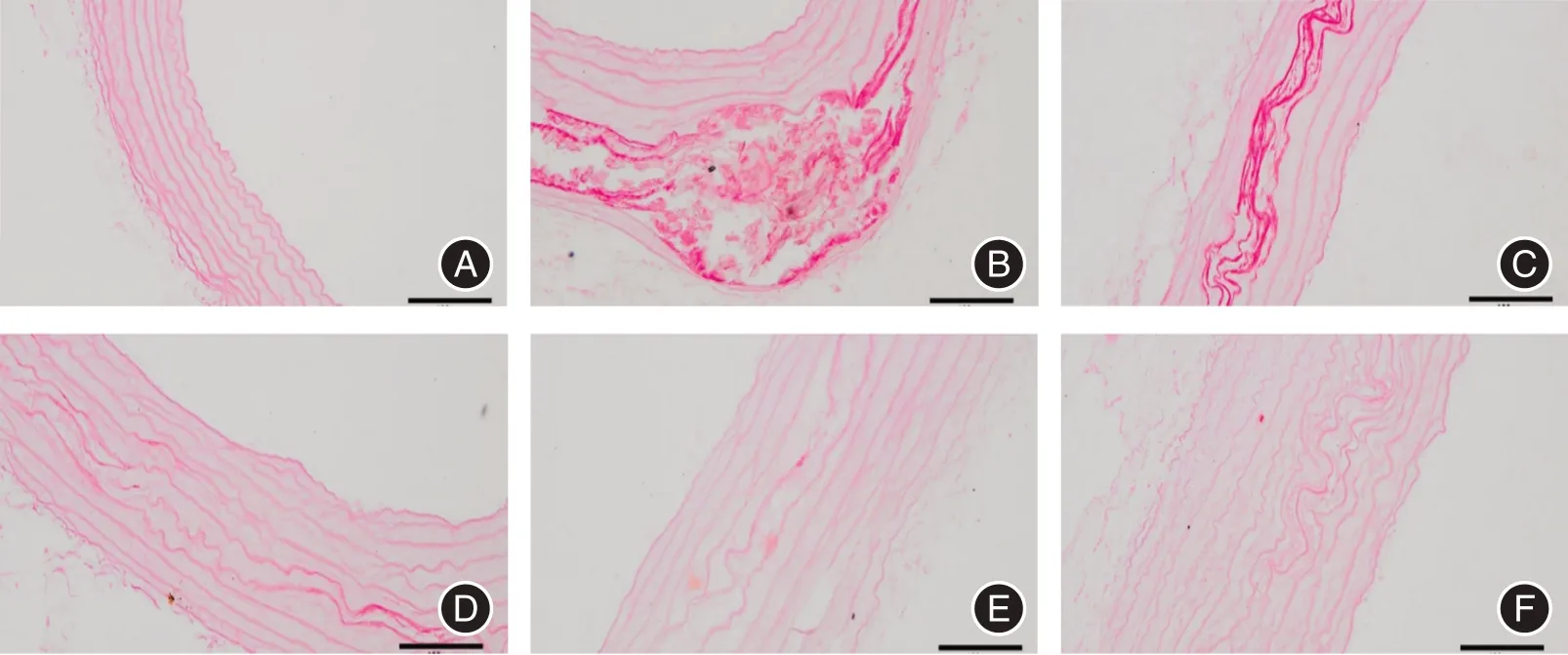
图1 各组大鼠主动脉钙盐茜素红染色结果(标尺100 μm)Fig.1 Aortic calcium salt by stained with alizarin red of rats in each group (scale 100 μm)
2.3 各组大鼠主动脉钙化及平滑肌线粒体超微结构透射电镜结果 如图2 所示,正常组主动脉平滑肌线粒体形态大小正常。模型组基质中有大量的钙化结晶。三七低、中剂量组和骨化三醇组线粒体结构受损。三七低剂量组间质中存在大量钙结晶。三七高剂量组线粒体结构完整,未发现钙化。

图2 各组大鼠主动脉透射电镜超微结构变化(标尺1μm)Fig.2 Ultrastructural changes of aorta under transmission electron microscope of rats in each group(scale 1μm)
2.4 各组大鼠血清生化指标结果比较 与正常组比较,模型组大鼠血清BUN、Cr、P、TG、TC 含量明显升高(P< 0.01),Ca 含量明显降低(P< 0.01)。与模型组比较,三七中、高剂量组和骨化三醇组大鼠血清BUN、Cr、P、TG、TC含量明显降低(P< 0.05,P< 0.01),Ca 含量明显升高(P< 0.05,P< 0.01),并且三七高剂量组和骨化三醇组效果更显著。见表1。
表1 各组大鼠血清BUN、Cr、Ca、P、TG 和TC 含量水平的比较Tab.1 Comparison of serum BUN,Cr,Ca,P,TG,and TC levels of rats in each group n = 6,±s,M(Q)

表1 各组大鼠血清BUN、Cr、Ca、P、TG 和TC 含量水平的比较Tab.1 Comparison of serum BUN,Cr,Ca,P,TG,and TC levels of rats in each group n = 6,±s,M(Q)
注:与正常组比较,ΔP < 0.05,ΔΔP < 0.01;与模型组比较,▲P < 0.05,▲▲P < 0.01
分组正常组模型组三七低剂量组三七中剂量组三七高剂量组骨化三醇组F/χ2值P值TC(mmol/L)1.66(0.21)3.60(0.82)ΔΔ 3.32(0.71)ΔΔ 2.81(0.53)ΔΔ▲▲2.03(0.27)ΔΔ▲▲2.26(0.34)ΔΔ▲▲27.99< 0.05 BUN(mmol/L)4.46(1.17)29.09(8.19)ΔΔ 23.49(7.91)ΔΔ 16.02(3.85)ΔΔ▲▲9.92(2.60)ΔΔ▲▲14.17(2.71)ΔΔ▲▲29.31< 0.05 Cr(μmol/L)41.85 ± 8.51 165.75 ± 32.41ΔΔ 141.06 ± 20.75ΔΔ▲113.85 ± 19.08ΔΔ▲▲68.32 ± 20.70Δ▲▲97.83 ± 16.68ΔΔ▲▲28.67< 0.05 Ca(mmol/L)2.54 ± 0.38 1.56 ± 0.31ΔΔ 1.72 ± 0.23ΔΔ 1.94 ± 0.25ΔΔ▲2.29 ± 0.37▲▲2.01 ± 0.27ΔΔ▲8.18< 0.05 P(mmol/L)2.03(0.30)6.13(1.99)ΔΔ 5.01(1.05)ΔΔ 3.95(0.53)ΔΔ▲▲2.92(0.85)ΔΔ▲▲3.75(0.60)ΔΔ▲▲28.19< 0.05 TG(mmol/L)0.48(0.07)1.46(0.48)ΔΔ 1.29(0.29)ΔΔ 0.99(0.15)ΔΔ▲0.78(0.22)ΔΔ▲▲0.84(0.14)ΔΔ▲▲27.61< 0.05
2.5 各组大鼠BMP2、RUNX2、SM22α、Sortilin、TLR7、TLR9 蛋白表达结果分析 与正常组比较,模型组大鼠主动脉组织BMP2、RUNX2、Sortilin、TLR7、TLR9 蛋白表达显著升高(P< 0.01),SM22α蛋白表达显著下降(P< 0.01)。与模型组相比,三七低、中、高剂量组和骨化三醇组BMP2、RUNX2、Sortilin、TLR7、TLR9蛋白表达下降显著(P< 0.01),SM22α 蛋白表达显著上调(P< 0.05,P< 0.01)。详见表2,图3、4。
表2 各组大鼠主动脉BMP2、RUNX2、SM22α、Sortilin、TLR7 和TLR9 蛋白的表达Tab.2 Expression of BMP2,RUNX2,SM22α,Sortilin,TLR7 and TLR9 protein in aorta of rats in each group n = 6, ± s,M(Q)

表2 各组大鼠主动脉BMP2、RUNX2、SM22α、Sortilin、TLR7 和TLR9 蛋白的表达Tab.2 Expression of BMP2,RUNX2,SM22α,Sortilin,TLR7 and TLR9 protein in aorta of rats in each group n = 6, ± s,M(Q)
注:与正常组比较,△P < 0.05,△△P < 0.01;与模型组比较,▲P < 0.05,▲▲P < 0.01
分组正常组模型组三七低剂量组三七中剂量组三七高剂量组骨化三醇组F值P值TLR9 0.18(0.04)0.71(0.21)ΔΔ 0.54(0.09)ΔΔ▲▲0.37(0.06)ΔΔ▲▲0.27(0.08)Δ▲▲0.23(0.07)▲▲31.95< 0.05 BMP2 0.31 ± 0.11 1.14 ± 0.05ΔΔ 0.83 ± 0.09ΔΔ▲▲0.62 ± 0.13ΔΔ▲▲0.61 ± 0.06ΔΔ▲▲0.49 ± 0.08ΔΔ▲▲59.52< 0.05 RUNX2 0.40 ± 0.05 1.14 ± 0.07ΔΔ 0.91 ± 0.05ΔΔ▲▲0.81 ± 0.08ΔΔ▲▲0.58 ± 0.06ΔΔ▲▲0.62 ± 0.03ΔΔ▲▲119.94< 0.05 SM22α 0.88 ± 0.04 0.28 ± 0.07ΔΔ 0.36 ± 0.05ΔΔ▲0.56 ± 0.05ΔΔ▲▲0.73 ± 0.04ΔΔ▲▲0.76 ± 0.03ΔΔ▲▲132.51< 0.05 Sortilin 0.42(0.06)1.01(0.03)ΔΔ 0.84(0.10)ΔΔ▲▲0.76(0.13)ΔΔ▲▲0.56(0.04)ΔΔ▲▲0.49(0.06)Δ▲▲32.42< 0.05 TLR7 0.32 ± 0.04 0.96 ± 0.07ΔΔ 0.72 ± 0.08ΔΔ▲▲0.66 ± 0.06ΔΔ▲▲0.47 ± 0.06ΔΔ▲▲0.50 ± 0.04ΔΔ▲▲79.40< 0.05
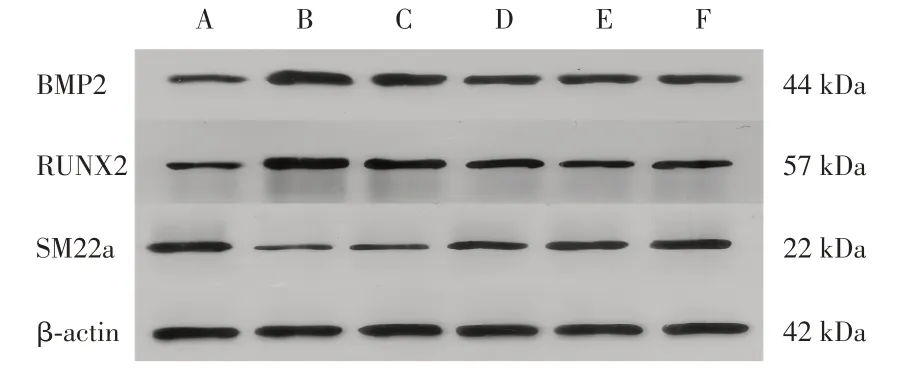
图3 各组大鼠主动脉BMP2、RUNX2、SM22α 蛋白的表达Fig.3 Expression of BMP2,RUNX2,SM22αprotein in aorta of rats in each group

图4 各组大鼠主动脉Sortilin、TLR7、TLR9 蛋白的表达Fig.4 Expression of Sortilin,TLR7 and TLR9 protein in aorta of rats in each group
2.6 各组大鼠血清相关炎症因子水平分析 与正常组比较,模型组大鼠血清IFN-γ、IL-6、IL-10、IL-17A 含量明显升高(P< 0.01)。与模型组比较,三七中、高剂量组和骨化三醇组大鼠血清IFN-γ、IL-6、IL-10、IL-17A 含量明显降低(P< 0.01),并且三七高剂量组和骨化三醇组降低更显著。见表3。
表3 各组大鼠血清IFN-γ、IL-6、IL-10 和IL-17A 水平的比较Tab.3 Comparison of serum IFN-γ,IL-6,IL-10 and IL-17A levels of rats in each group n = 6,±s,pg/mL

表3 各组大鼠血清IFN-γ、IL-6、IL-10 和IL-17A 水平的比较Tab.3 Comparison of serum IFN-γ,IL-6,IL-10 and IL-17A levels of rats in each group n = 6,±s,pg/mL
注:与正常组比较,△P < 0.05,△△P < 0.01;与模型组比较,▲P < 0.05,▲▲P < 0.01
组别正常组模型组三七低剂量组三七中剂量组三七高剂量组骨化三醇组F值P值IL-17A 39.99 ± 2.76 85.24 ± 13.05ΔΔ 72.40 ± 7.34ΔΔ▲59.19 ± 7.08ΔΔ▲▲48.16 ± 7.76▲▲55.61 ± 8.51ΔΔ▲▲23.10< 0.05 IFN-γ 34.17 ± 10.34 99.67 ± 19.91ΔΔ 90.27 ± 15.39ΔΔ 74.42 ± 11.15ΔΔ▲▲54.16 ± 11.92Δ▲▲62.43 ± 11.31ΔΔ▲▲18.39< 0.05 IL-6 80.67 ± 16.07 260.41 ± 57.42ΔΔ 195.63 ± 38.73ΔΔ▲▲163.49 ± 27.88ΔΔ▲▲122.63 ± 21.18Δ▲▲141.43 ± 29.69ΔΔ▲▲19.49< 0.05 IL-10 91.58 ± 12.56 170.83 ± 20.93ΔΔ 158.30 ± 16.23ΔΔ 139.14 ± 17.94ΔΔ▲▲103.25 ± 13.56▲▲124.29 ± 10.89ΔΔ▲▲23.12< 0.05
3 讨论
CKD 发生VC 的机制复杂,目前认为与钙磷代谢紊乱、血管平滑肌表型转化、微炎症、氧化应激、自噬、钙化促进因子与抑制因子失衡等有关[9]。VC 过程中血管平滑肌细胞(vascular smooth muscle cell,VSMC)的表型转换主要表现为BMP2和RUNX2等骨形成相关蛋白的表达增加,SM22α、α-SMA等VSMC 抑制因子的减少[10-13]。本实验研究结果提示模型组肾纤维化明显,钙磷及血脂代谢紊乱,主动脉大量钙盐沉积。模型组主动脉BMP2 和RUNX2 蛋白表达升高,SM22α 蛋白表达减少,提示已发生VSMC 的表型转换,CKD 血管钙化动物模型建立成功。延缓CKD 血管钙化进程可以降低CKD 心血管事件发生率[2],本研究中三七和阳性药物处理后,降低大鼠主动脉BMP2 和RUNX2蛋白表达,促进SM22α 蛋白表达,提示三七能延缓CKD 血管钙化进程。
Sortilin 蛋白具有多种生物学功能,研究发现Sortilin 蛋白通过调节外泌体装载组织非特异性碱性磷酸酶,加速囊泡内钙盐沉积,直接促进动脉钙化[14-15]。Sortilin 可能通过调节脂质代谢[16],参与VC 的发生。与具有相同变异的非糖尿病患者相比,携带SORT1 变异的糖尿病患者血浆载脂蛋白、超低密度脂蛋白、TG 和LDL 水平下降幅度更大[17]。Sortilin 与CKD 血管钙化关系密切,在CKD患者中研究发现Sortilin 氨甲酰化与冠状动脉钙化相关,与年龄和肾功能无关;氨甲酰化Sortilin 可能导致CKD 患者心血管并发症的升高,是心血管钙化的危险因素[6]。本研究中模型组Sortilin 蛋白表达明显升高,脂质代谢紊乱,三七治疗后Sortilin 蛋白表达下降,脂质代谢改善,推测三七可能通过调节Sortilin 蛋白的表达影响脂质代谢,与其他学者的研究结论相似。
VC 以动脉壁内钙和磷酸盐的积累为特征,CKD 血管钙化以中膜层为主。持续的慢性微炎症状态是VC 形成的病理基础[18]。CKD 血管钙化大鼠发生了明显的炎症反应失衡,其中促炎因子CINC、IFN-γ、IL-1α、IL-6、MCP-1、ICAM-1、TIMP-1、L-selectin 占主导作用[19]。CKD 患者的慢性微炎症状态以TNF-a 和IL-6 水平升高为特征,而IL-6可能促进CKD 中血管钙化的发生和发展[20],阻断IL-6 信号通路可明显减弱尿毒症诱导的VSMC 成骨细胞转变和钙化[21]。研究[6]发现IL-6 与体外氨基甲酰化Sortilin 的亲和力增强,直接作用血管细胞,促进血管钙化。除与IL-6 结合外,Sortilin蛋白还被证明可与免疫细胞中的其他细胞因子结合,如IFN-α、IFN-γ、IL-17A、IL-10 和IL-12[7]。本研究结果提示CKD 血管钙化模型存在微炎症状态,多种炎症因子,如IFN-γ、IL-6、IL-10、IL-17A明显升高,经过三七治疗后Sortilin 及炎症因子水平均下降,推测三七可能通过调节Sortilin 蛋白的表达影响炎症因子水平,与其他学者的研究结论相似。
TLRs 是固有免疫系统的重要组成部分,可识别不同种类的病原体相关分子模式。TLR9 激活可以刺激血管炎症反应促进斑块形成[22]。在CRF大鼠模型中TLR9 激活后促进VSMC 中BMP-2 表达的增加,促进血管钙化[23]。TLR7 在动脉粥样硬化斑块中高表达,即使是症状较轻的患者其动脉粥样硬化斑块中TLR7 表达仍然较高;进一步研究发现TLR7 激活后,斑块内巨噬细胞和T 细胞迅速释放IL-10[24]。另外,TLR7 促进IL-6 分泌在载脂蛋白e 缺陷小鼠的动脉粥样硬化过程中发挥作用[25]。本研究结果中同样发现TLR9、TLR7 参与了CKD 大鼠血管钙化进程。
本研究中CKD 血管钙化大鼠主动脉钙盐沉积,脂质代谢异常,钙化相关蛋白BMP2、RUNX2、SM22α 表达异常,相关炎症因子表达升高,这一结果与现有研究[26]Sortilin 通过多途径调控脂质代谢,促进炎症反应,导致血管钙化或动脉粥样硬化的结论一致,并且这可能与TLR9、TLR7 信号通路相关,这一结论与国外研究[7]结果一致。三七干预处理后,可以改善上述指标的变化。提示三七是延缓CRF 大鼠血管钙化的有效药物。为防治CKD 心血管事件的研究提供思路。本研究不足之处在于TLRs 与Sortilin 的关系未能进一步探究,Sortilin 是VC 的关键蛋白,其在VC 中的作用机制复杂,还需进一步研究。
【Author contributions】HUANG Zhimin performed the experiments and wrote the article.ZHANG Zhiying,JIANG Yini and LIU Xiaoyu performed the experiments.LU Liangxi revised the article.WU Jinyu designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.

