脂联素对脓毒症小鼠急性肾损伤的治疗作用及机制
叶方雄,郭诚,万雨涵,李威,袁进,洪茂林,杨定平
1 武汉大学人民医院肾病内科,武汉 430060;2 鄂州市中医医院重症医学科;3 襄阳职业技术学院;4 鄂州市中医医院脑病科
脓毒症是一种宿主对感染反应失调所致的临床综合征,以严重的全身炎症和多器官功能障碍综合征(MODS)为特点[1]。发生脓毒症时,外源性毒素可刺激机体产生并释放大量细胞因子和炎性介质,激发组织炎症反应,引起包括脑、心脏、肾脏在内的多种脏器损伤,其中急性肾损伤(AKI)是最常见的并发症[2-3]。脂联素(APN)是一种脂肪细胞分泌的多聚性脂肪因子,能提高胰岛素敏感性,具有抗炎、改善糖脂代谢、抑制动脉粥样硬化及抗纤维化特性[4]。APN 浓度的降低与心肌梗死、冠心病、高血压和其他代谢性心血管功能障碍有关[5]。近年研究表明,APN 在脓毒症免疫应答及抗炎过程中发挥重要作用,脓毒症患者APN 水平的下调与其严重程度呈负相关[6]。LIU 等[7]发现,APN 能通过激活AMPK/mTOR 通路减少肝细胞凋亡,对脓毒症大鼠的肝损伤具有保护作用,但APN 对脓毒症AKI 的影响鲜见报道。2021 年9 月—2022 年12 月,我们通过腹腔注射脂多糖(LPS)建立脓毒症小鼠模型,观察APN 在脓毒症肾损伤小鼠中的治疗作用,并探讨其可能机制。
1 材料与方法
1.1 实验动物与试剂 雄性SPF 级C57BL/6 小鼠24 只,6~8 周龄,体质量22~25 g,由武汉大学人民医院动物实验中心提供,许可证编号SYXK(鄂)2015-0027。LPS 购自美国Sigma 公司;APN 购自美国PeproTech公司,超氧化物阴离子荧光探针(DHE)购自上海碧云天生物科技有限公司;BCA 蛋白浓度检测试剂盒购自美国Thermo Fisher 公司;核苷酸结合寡聚域样受体3(NLRP3)单克隆抗体、半胱氨酸天冬氨酸蛋白酶(Caspase)-1 单克隆抗体购自英国Abcam 公司;白细胞介素(IL)-1β 多克隆抗体、GADPH 单克隆抗体购自武汉三鹰生物技术有限公司;NLRP3、IL-1β 和肿瘤坏死因子(TNF)-α 引物由武汉塞维尔生物科技有限公司设计提供;全自动生化分析仪购自深圳雷杜生命科技有限公司。
1.2 动物模型及分组处理 采用随机数字表法将小鼠分为空白对照组(CON 组)、模型组(LPS组)、实验组( LPS+APN 组)。按10 mg/kg 腹腔注射LPS 制备脓毒症模型,CON 组腹腔注射等量0.9%氯化钠注射液,实验组在造模前8 h 按0.1 mg/kg 尾静脉注射APN 进行干预。造模后24 h 处死小鼠,眼球取血2 mL,离心收集上清,-80 ℃冰箱中保存;纵切左侧肾脏,置于4%多聚甲醛溶液中固定,右侧肾脏用液氮速冻制作冰冻切片待用。
1.3 肾组织病理学评定 固定好的肾组织脱水,包埋于石蜡中,将组织切成3 μm 切片,行HE 染色,参照文献[8]依据Paller 评分法进行肾小管损伤病理评分:形态正常为0分;肾小管扩张、细胞扁平、刷状缘损伤为1 分;管腔脱落或坏死为1 分;上皮细胞核固缩、空泡状或颗粒状为1 分;刷状缘脱落、肾小管管型为2分。
1.4 肾功能检测 取小鼠血清,采用全自动生化分析仪检测肌酐(Scr)和尿素氮(BUN)浓度,评估小鼠肾功能。
1.5 活性氧(ROS)检测 采用超氧化物阴离子荧光探针(DHE)。用DSMO 溶解DHE 配制成染色探针工作液,清洗液清洗冰冻切片3 min,滴加染色探针工作液,37 ℃培养箱避光孵育40 min,装载荧光探针完毕,移除染色液,并用PBS 洗涤切片3 次,加盖玻片封片,以535 nm 作为激发波长,在荧光显微镜下观察ROS的荧光强度,使用Image-Pro Plus 软件对平均荧光强度进行量化分析。
1.6 NLRP3、IL-1β、TNF-α mRNA 表达检测 采用RT-qPCR 法。TRIzol 试剂提取肾脏组织中的RNA,紫外分光光度计确定各组小鼠总RNA 浓度后逆转录为cDNA。用Mx3000P qPCR 系统在96 孔光学反应板上对NLRP3、IL-1β、TNF-α 和GAPDH 的mRNA表达进行定量分析。NLRP3 正向引物:5'-TAAGAACTGTCATAGGGTCAAAACG-3',反向引物:5'-GTCTGGAAGAACAGGCAACATG-3';IL-1β 正向引物:5'-AGGCTCCGAGATGAACAACAAA-3',反向向引物:5' -GTGCCGTCTTTCATTACACAGGA-3';TNF-α 正向引物:5'-CTCTTCTGTCTACTGAACTTCGGG-3',反向引物:5'-GGTGGTTTGTGAGTGTGAGGGT-3';GAPDH 正向引物:5'-CCTCGTCCCGTAGACAAAATG-3',反向引物:5'-GTAACAGTCCGCCTAGAAGCAC-3'。qPCR 反应条件:95 ℃初始变性3 min、95 ℃变性30 s、60 ℃退火40 s、72 ℃延伸30 s,重复40个循环,最后75 ℃延伸8 min。以GAPDH作为内参基因,使用2-ΔΔCt法分析数据并计算基因的相对表达量。实验重复3次,取平均值。
1.7 NLRP3、Caspase-1、IL-1β蛋白表达检测 采用Western blotting 法。从肾组织匀浆中提取总蛋白,BCA 法测量蛋白质浓度。在上样缓冲液中95 ℃加热变性10 min,将蛋白质上样至SDS-聚丙烯酰胺凝胶,电泳转膜到PVDF 膜上。5%的脱脂奶粉封闭1 h,4 ℃下与NLRP3、Caspase-1、IL-1β、GAPDH 一抗孵育过夜。TBST 洗涤3 次,用辣根过氧化物酶标记的二抗孵育1 h,在化学发光仪中显影观察,采集图像并用Image Lab软件分析条带灰度值,以目的蛋白灰度值/内参灰度值表示目的蛋白的相对表达量。
1.8 统计学方法 采用GraphPad Prism 8 统计软件。符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肾损伤比较 CON 组小鼠肾小球形态结构正常,毛细血管光滑通畅,肾小管上皮细胞完整;与CON 组相比,LPS 组小鼠肾脏可见肾小管扩张,上皮细胞核溶解坏死,刷状缘损伤,肾小管出现细胞管型;与LPS 组相比,LPS+APN 组小鼠肾脏损伤明显减轻。见图1。与CON 组比较,LPS 组小鼠肾脏损伤评分、Scr 及BUN 水平升高(P<0.05);与LPS 组比较,LPS+APN 组肾脏损伤评分、Scr 及BUN水平下降(P<0.05)。见表1。
表1 各组小鼠Paller评分、Scr、BUN比较(± s)

表1 各组小鼠Paller评分、Scr、BUN比较(± s)
注:与CON组比较,*P<0.05;与LPS组比较,#P<0.05。
组别CON组LPS组LPS+APN组BUN(mg/dL)19.22 ± 2.87 55.34 ± 9.25*41.97 ± 6.04*#n8 8 8 Paller评分(分)0.63 ± 0.52 7.62 ± 1.19*4.38 ± 0.92*#Scr(μmol/L)21.73 ± 5.43 116.70 ± 14.16*79.88 ± 10.63*#

图1 各组小鼠肾脏病理学比较(HE染色,×400)
2.2 各组小鼠肾组织活性氧比较 CON 组、LPS组、LPS+APN 组ROS 相对荧光强度分别为1.00 ±0.00、26.67 ± 3.38、16.32 ± 2.51。LPS 组小鼠肾组织切片红色荧光明显强于对照组,LPS+APN组红色荧光较对照组强,而比LPS 组弱(P<0.05)。
2.3 各组小鼠肾组织NLRP3、IL-1β、TNF-α mRNA表达比较 与对照组比较,LPS 组NLRP3、IL-1β、TNF-α 的mRNA 表达明显升高(P均<0.05);与LPS组比较,LPS+APN 组NLRP3、IL-1β、TNF-α 的mRNA表达明显降低(P均<0.05)。见表2。
表2 各组肾组织NLRP3、IL-1β和TNF-α mRNA相对表达量比较(± s)

表2 各组肾组织NLRP3、IL-1β和TNF-α mRNA相对表达量比较(± s)
注:与CON组比较,*P<0.05;与LPS组比较,#P<0.05。
组别CON组LPS组LPS+APN组TNF-α mRNA 1.01 ± 0.16 2.52 ± 0.49*1.52 ± 0.33*#n8 8 8 NLRP3 mRNA 1.04 ± 0.31 3.93 ± 0.74*1.86 ± 0.47*#IL-1β mRNA 1.01 ± 0.15 2.74 ± 0.50*1.43 ± 0.16*#
2.4 各组小鼠NLRP3、Caspase-1、IL-1β 蛋白表达比较 与对照组比较,LPS 诱导的脓毒症小鼠肾组织NLRP3、Caspase-1 和IL-1β 蛋白表达明显升高(P均<0.05);与模型组比较,APN 干预组小鼠肾脏NLRP3、Caspase-1和IL-1β蛋白表达明显下降(P均<0.05)。见表3。
表3 各组肾组织NLRP3、Caspase-1、IL-1β蛋白相对表达量比较(± s)
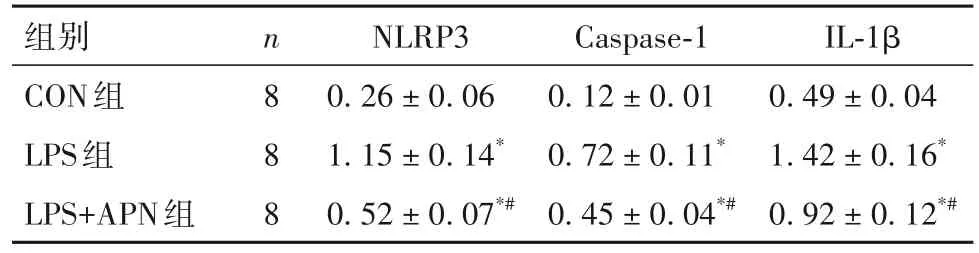
表3 各组肾组织NLRP3、Caspase-1、IL-1β蛋白相对表达量比较(± s)
注:与CON组比较,*P<0.05;与LPS组比较,#P<0.05。
组别CON组LPS组LPS+APN组IL-1β 0.49 ± 0.04 1.42 ± 0.16*0.92 ± 0.12*#n8 8 8 NLRP3 0.26 ± 0.06 1.15 ± 0.14*0.52 ± 0.07*#Caspase-1 0.12 ± 0.01 0.72 ± 0.11*0.45 ± 0.04*#
3 讨论
脓毒症是危重病患者死亡的主要原因之一,据统计,危重患者中AKI 的发病率高达60%,不低于40%的脓毒症会出现包括AKI在内的多器官功能衰竭,脓毒症相关急性肾损伤(SA-AKI)患者进展为慢性肾病的风险显著增加[2,9]。近年来,随着拯救脓毒症运动的推广和集束化治疗的应用,脓毒症病死率较前有所下降[10]。SA-AKI 的病理机制尚未完全清楚,目前普遍认为各种病原菌感染后导致全身性炎症反应综合征,大量炎症因子和介质如TNF-α、IL-1等相互作用引起的“瀑布炎症反应”是SA-AKI 发生的重要原因[11]。因此,抑制炎症因子释放及防止炎性介质的产生成为治疗SA-AKI的关键。
APN 是一种具有内源活性的多肽,由4 个结构域组成并参与代谢和炎症过程。APN 通过加速抗炎因子的分泌,减少炎性介质的产生和释放,从而发挥抗炎作用,避免机体发生过度的免疫反应[12-13]。有研究表明,在盲肠结扎穿刺法建立的大鼠脓毒症模型中,APN 能显著降低血清TNF-α 等炎症因子表达[7]。本研究结果显示,LPS 小鼠肾组织病理评分高,肾小管上皮细胞损伤严重,肾功能指标Scr、BUN水平升高,炎性因子IL-1β 及TNF-α 的转录和分泌增加。相较于模型组,存在APN 干预的小鼠病理评分低,肾小管上皮细胞及毛细血管损伤减轻,Scr、BUN 下降,炎性因子的转录和分泌减少。说明APN对SA-AKI具有保护作用。
细胞焦亡是一种与炎症相关的程序性细胞死亡,由Caspase 介导,分为依赖Caspase-1 介导的经典途径和依赖Caspase-4/5/11 介导的非经典途径[14]。NLRP3 炎症小体由NLRP3、接头蛋白ASC 和效应蛋白Caspase-1组成,是一种大分子蛋白复合体。最新研究发现,无论是经典途径还是非经典途径,NLRP3炎症小体在细胞焦亡过程中均发挥重要调控作用[15]。脓毒症发生时,细胞缺氧导致线粒体功能紊乱,产生释放大量ROS,激活NLRP3,进而触发细胞焦亡。活化的NLRP3 招募ASC 和Caspase-1,形成NLRP3 炎症小体复合物,ASC 通过切割无活性的Caspase-1 前体成为成熟的Caspase-1。成熟的Caspase-1 随后催化IL-1β 和IL-18 前体剪切成熟,分泌到细胞外,启动相应的信号级联反应,并最终导致IL-1β、IL-18、TNF-α 等大量炎性介质释放[16]。本研究中,相较于对照,LPS 小鼠肾组织活性氧含量升高,炎症小体相关蛋白NLRP3、Caspase-1 表达增多,炎性因子IL-1β 的mRNA 及蛋白表达增加,与既往文献报道一致。
在脓毒症中,APN 与疾病的严重程度及预后相关,而外源性的APN 在抗氧化过程中发挥重要作用。张占琴等[17]研究表明,APN 能调节凋亡相关蛋白Caspase-3、Bax 及抗凋亡蛋白Bcl-2 表达,通过抑制线粒体损伤诱导的氧化应激保护小鼠的神经及认知功能,减轻脓毒症小鼠脑损伤。亦有研究证实APN 通过调节AMPK、Akt和NF-κB 信号通路限制单核细胞微粒诱导的内皮细胞活化,而NF-κB 通路的活化,在NLRP3 经典信号通路的激活以及炎性因子IL-1β、TNF-α 的释放过程中发挥关键作用[18]。本实验结果显示,在LPS 诱导的脓毒症急性肾损伤小鼠的肾组织中,活性氧含量增加,炎性因子TNF-α分泌明显增多;APN 干预后,脓毒症小鼠肾组织活性氧的含量及TNF-α 表达明显减少。说明APN 对脓毒症急性损伤的保护作用与活性氧的调节及炎性介质的减少有关。
综上所述,APN 可通过调控炎症反应及细胞焦亡相关通路对SA-AKI起保护作用,其机制可能与降低肾组织氧化应激水平,抑制NLRP3 炎性小体的产生,减少TNF-α、IL-1β 等炎性因子的释放有关。本研究为SA-AKI的治疗提供了新思路,但仍存在以下不足:一是APN 调控氧化应激的分子机制尚不清楚;二是脓毒症的发生由多种原因导致,本研究以LPS 诱导的脓毒症为模型,存在一定局限性,这些在后期研究中有待进一步完善。

