重庆两家三甲医院肺炎克雷伯菌菌毛变化分析*
方立超,程 平,贺 娟,李 艳,黄 辉,邓 均,蒋丽莉,杨 帆,邱宗文,郑峻松△
(第三军医大学:1.医学检验系既药学院临床检验学教研室;2.西南医院检验科;3.新桥医院检验科,重庆400038)
近年来肺炎克雷伯菌(K.pneumoniae)感染有明显增加的趋势,并且成为革兰阴性杆菌和医院内感染的主要致病菌之一。由于各种抗菌药物的广泛使用导致K.pneumoniae对以β-内酰胺类抗生素为主的多种抗菌药物产生耐药性,常可以引起各种难治性感染。越来越多的证据表明,菌毛在该菌致病过程中发挥了重要作用,与细菌的黏附定植相关。细菌可借助于菌毛尖端的黏附素对宿主黏膜上皮细胞的黏附作用黏附到宿主组织器官,通过这种黏附,细菌得以定居,从而获得侵袭的通道,这是机体致病的首要条件[1]。该菌有两类菌毛,即Ⅰ型和Ⅲ型菌毛。Ⅰ型菌毛属于甘露糖敏感性(mannose-sensitive)菌毛,即在甘露糖存在时会阻断菌毛与红细胞的凝集现象,主要黏附在尿道上皮细胞;Ⅲ型菌毛具有甘露糖抵抗血凝特性(MRHA),故又称为甘露糖抵抗血凝特性菌毛,主要黏附在呼吸道上皮细胞[2]。
为了探讨医院内K.pneumoniae感染发病情况、菌种分布特点,指导临床诊治、控制医院感染以及进行流行病学研究,2007年7月至2008年7月共收集了重庆两家三甲医院(新桥医院和西南医院)检验科细菌室158株K.pneumoniae,并运用PCR方法、血凝及血凝抑制实验对收集菌株产生Ⅰ型、Ⅲ型菌毛的情况进行了分析,现报道如下。
1 材料与方法
1.1 标本来源 2007年7月至2008年7月分别从西南医院和新桥医院检验科细菌室收集K.pneumoniae共计158株,其中痰液138株,皮下积液7株,脑脊液5株,伤口分泌物8株。
1.2 试剂 D-甘露糖为上海化学试剂厂产品,Taq DNA聚合酶和Genomic DNA kit为天根生物产品,DL2000 marker为Takara产品。改良 Minka培养基:酪蛋白胨 5.00 g,酵母浸粉1.00 g,KH2PO41.36 g,Na2HPO48.00 g,甘油 5.00 m L,微量盐溶液1.00 mL,蒸馏水定容至1 000 mL,p H7.0~7.2。微量盐溶液配方:MgSO4.2H 2 O 10 g,MnCl2.4H 2 O 1 g,FeCl2.6H2O 0.135 g,CaCl2.2H2O 0.4 g,定容至1 L,2~8℃保存。
1.3 细菌培养 将各菌株分别经改良Minka液体培养基37℃静置培养48 h,同样培养条件下连续传代3次,即为菌毛化菌体[3]。
1.4 模板DNA的制备 各株菌经培养后,用基因组提取试剂盒提取细菌基因组,作为扩增菌毛主要结构基因的DNA模板。
1.5 引物设计与合成 针对Ⅰ型和Ⅲ型菌毛各设计1对引物[3],由上海英俊公司合成。两对引物序列如下,Ⅰ型(扩增长度 549bp)上游引物:5′-ACG CGT CGA CAT GAT GAA AAAAAT AAT CCCCCT G-3′,下游引物 :5′-CCG CTC GAG CTA TCCCCT GCG CCG GCG AG-3′;Ⅲ型(扩增长度 609bp)上游引物 :5′-CCG CTC GAG TTA CTG ATA AGT AAT TTC GTA AG-3′,下 游引物:5′-CGC GGA TCC ATG AAA AAG GTT CTT CTC TCT G-3′。

表1 K.pneumoniaⅠ、Ⅲ型菌毛分析结果〔株(%)〕
1.6 PCR扩增 PCR扩增体系:模板 DNA各 1μL,正反向引物各1μL,2Master Mix 12.5μL,ddH2O 9.5μL(体系为25 μL)。反应条件如下:94℃预变性5 min,94℃45 s,60℃60 s,72℃60 s,29个循环;最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,电压120 V,电泳时间20 min。
1.7 血凝/血凝抑制实验[4]采健康豚鼠血,分离红细胞,用PBS制成2%红细胞悬液。菌株经改良Minka液体培养基培养传代至第3代,制成约50×109cfu/m L细菌悬液,每株菌分为两个样本,一个不加D-甘露糖,另一个加D-甘露糖至终浓度为0.5%,比较D-甘露糖对血凝反应的抑制作用。首先在96孔V型板中加入上述制备的各2个供试样本的菌悬液30μL,同时设生理盐水阴性对照(观察有无自凝现象);再加入等量(预冷)的2%豚鼠红细胞悬液,在微量振荡器上混匀 30~60 s,置4℃1~2 h,观察血凝反应和D-甘露糖是否抑制凝集;最后取甘露糖抵抗血凝试验阳性的菌株,待4℃下完全凝集后,置37℃恒温箱中30 min,检查凝集现象是否被解脱。待凝集解脱后,重新混匀,置4℃1 h,观察是否再现凝集反应。若供试菌株对豚鼠红细胞的凝集反应不能抵抗D-甘露糖的抑制作用,该菌株产生的是Ⅰ型菌毛抗原;如果供试菌株对豚鼠红细胞的凝集反应能够抵抗D-甘露糖的抑制作用,37℃出现解脱,4℃又重现凝集反应,即判定为MRHA阳性菌株,该菌株能够产生Ⅲ型菌毛抗原。
2 结 果
2.1 PCR产物电泳结果 PCR产物经琼脂糖凝胶电泳,158株供试菌株中,有7株菌针对Ⅰ型菌毛主要结构亚单位基因(fimA)序列的引物扩增出549 bp目的片段,145株菌针对Ⅲ型菌毛的主要结构亚单位基因(mrk A)序列的引物扩增出609 bp的目的片段,与预期的大小完全相符,2株菌既扩增出了fimA又扩增出了mrkA目的片段,还有6株菌未扩增出fimA或mrk A目的片段(表1),部分菌株 PCR扩增结果,见图1、2。
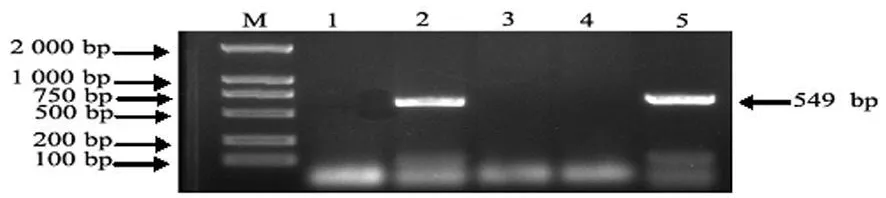
图1 fimA扩增产物
2.2 血凝实验/血凝抑制实验 158株供试细菌中,除11株外,其余147株均能凝集2%的豚鼠红细胞,有7株不能抵抗D-甘露糖的抑制作用,140株能抵抗D-甘露糖的抑制作用,且抗D-甘露糖血凝反应在37℃下均能被解脱,在4℃下重现完全凝集,符合阳性判定标准,即能够产生Ⅲ型菌毛,阴性对照组无自凝现象。

图2 mrk A扩增产物
3 讨 论
158株供试菌株中,145株扩增出了mrk A目的片段,其中7株扩增出了fimA目的片段,其中2株扩增出前述两个目的片段,另6株菌未扩增出前述目的片段,这些扩增出目的片段的菌株,有5株菌无血凝特性。何礼洋等[3]报道用PCR方法鉴定K.pneumoniaeⅠ型、Ⅲ型菌毛,较之血凝实验、血凝抑制实验敏感。其原因为:(1)菌毛表达与否和培养条件关系密切;(2)与菌毛的血凝谱有一定关系。有的菌毛可凝集人、猪、羊、豚鼠及鸡等动物的红细胞,而有的菌毛只凝集猪及鸡等少数动物的红细胞,所以即使有菌毛,也不一定能根据血凝特性划分类型。此外,还可因出现红细胞非特异性凝集而产生假阳性。在K.pneumoniae所属的Ⅰ型及Ⅲ型菌毛中,Ⅰ型菌毛能与近曲小管细胞和尿中可溶性含甘露糖蛋白结合,表明Ⅰ型菌毛介导泌尿生殖道的细菌移植[4]。表达有Ⅲ型菌毛的K.pneumoniae能黏附到内皮细胞和呼吸道、泌尿生殖道的上皮细胞上,在肾脏Ⅲ型菌毛能介导细菌黏附到肾小管基底膜、Bowman囊和肾小管上[5]。本实验说明供试菌株多数是产生Ⅲ型菌毛的,且多数是来于痰液标本,大多数产生Ⅲ型菌毛的菌株主要造成呼吸道感染。
临床研究分析表明,K.pneumoniae分布广泛,在痰及咽拭物、脓汁、尿、血、脑脊液、腹腔液、胆汁、白带、前列腺液、骨髓液、眼分泌液都可分离到产ESBLS的克雷伯菌。K.pneumoniae是目前革兰阴性菌中除大肠杆菌外重要的条件致病菌。已成为医院感染的高危菌[6]。近年来K.pneumoniae耐药率显著增高,尤其是产ESBLs菌株明显增加,直接导致老年患者肺炎死亡率增高[7]。由于K.pneumoniae对以β-内酰胺类抗生素为主的多种抗菌药物产生耐药性,使得医院K.pneumoniae感染的控制成为烫手山芋[8]。就医院感染K.pneumoniae菌毛类型的分类,对研究人K.pneumoniae的致病机制及诊断与防治均有重要意义。这两家三甲医院分布的K.pneumoniae主要是产生Ⅲ型菌毛的菌株,主要是造成呼吸道感染,这对于寻求抗生素替代疗法,研发针对性的疫苗和药品无疑具有指导意义。
(志谢:感谢吉林大学畜牧兽医学院韩文瑜老师提供改良Minka液体培养基配方。)
[1] Regue M,Hita B,Pique N,et al.A gene,uge,is essential for klebsiella pneumoniae virulence[J].Infect Immun,2004,72(1):54.
[2] Witkowska D,Mieszala M,Gamian A,et al.M ajor structural proteins of type 1 and type 3 klebsiella fimbriae are effective protein carriers and immunogens in conjugates as revealed from their immunochemical characterization[J].FEMS Immunol Med Microbiol,2005,45(2):221.
[3] 何礼洋,韩文瑜,贾艳,等.鸡源肺炎克雷伯菌菌毛的分型[J].中国生物制品学杂志,2007,20(8):575.
[4] Purcell BK,Clegg S.Construction and expression of recombinant plasmids encoding type 1 fimbriae of a urinary Klebsiella pneumoniae isolate[J].Infect Immun,1983,39(3):1122.
[5] Tarkkanen AM,Virkola R,Clegg S,et al.Binding of the type3 fimbriae of Klebsiella pneumoniae to human endothelial and urinary bladder cells[J].Infect Immun,1997,65(4):1546.
[6] 熊一平,余显书,曹何,等.147株肺炎克雷伯菌引起医院感染调查和药敏结果分析[J].重庆医学,2004,33(2):283.
[7] 胡波,刘威,王芹.肺炎克雷伯菌肺炎耐药性检测与分析[J].重庆医学,2004,33(9):1354.
[8] 周安宇.746例痰标本中的病原菌分布及耐药性分析[J].重庆医学,2008,37(11):1239.

