细菌及真菌血流感染宏基因组学检测标本预处理方法探索*
朱 盈,杨启文
1.中国医学科学院北京协和医院检验科,北京 100730;2.中国医学科学院北京协和医学院,北京 100730
近年来,由于静脉导管留置、机械通气、肠外给药等侵入性设备及治疗的广泛应用,免疫抑制剂及大量抗菌药物的滥用,血流感染的发病率逐年上升[1]。然而,临床血流感染标本中病原微生物水平较低,部分标本病原菌甚至无法培养,导致标本阳性检出率较低,临床诊断困难。宏基因组学近年来被广泛应用于环境学、农业学等方面的研究。宏基因组学直接从环境样品中提取全部微生物的DNA,或通过测序探究环境中微生物的群落结构和功能,克服了传统培养方法的缺陷,极大地丰富了对标本微生物多样性及其功能的认识[2]。宏基因组学在医学微生物方面的研究有以下优势:不受靶标限制、可以预测耐药性、快速制备文库和实时采集数据[3]。将宏基因组学测序技术应用于临床微生物诊断可以全面快速地探索标本中病原菌的分布特征及耐药基因组学和毒力基因组学的特征。研究有效的去宿主核酸处理方法有助于提高检测的灵敏度和准确度,减少数据分析困难,并且能在一定程度上降低检测成本。为此,本研究将临床常见的3种病原微生物(金黄色葡萄球菌、肺炎克雷伯菌和白色念珠菌)注入到健康人血液中制备模拟标本,以综合评估3种标本预处理方法[皂素去宿主核酸法(Saponin法)、SDS去宿主核酸法(SDS法)和水洗法]的去人源核酸效果,旨在对将来的宏基因组学测序技术流程进一步发展及改进提供参考。
1 材料与方法
1.1标本来源 本研究使用临床模拟血液标本,将健康献血者含白细胞血浆与悬浮红细胞按体积1∶1混合,模拟全血标本。实验菌株使用临床质控菌株金黄色葡萄球菌ATCC 25923、白色念珠菌ATCC 90028和临床肺炎克雷伯菌(R16)。将菌悬液注入到全血标本中,最终得到浓度为103cfu/mL的含菌血液[4]。每份标本进行2次重复平行试验。
1.2仪器与试剂 核酸提取选用Zymo BIOMICS DNA minipre Kit核酸提取试剂盒。实时荧光定量聚合酶链反应(qPCR)使用罗氏LightCycler®480仪器,选用Takara TB Green Premix Ex Taq 酶或Apllied Biosyetems TaqMan Universal Master Mix Ⅱ试剂进行检测。在去宿主核酸处理步骤中使用热不稳定性耐高盐核酸酶(HL-SAN)(ActicZymes®)、Saponin干粉(Sigma-Aldrich®)、SDS、蛋白酶K冻干粉(Solarbio)。
1.3方法
1.3.1Saponin法[3]取8 mL含菌血液,800 r/min离心5 min,留取血浆,弃下层血细胞;将血浆以9 000 r/min离心5 min,弃上清液,200 μL 磷酸盐缓冲液(PBS) 重悬沉淀,再加入200 μL 5% Saponin溶液(终浓度为2.5%),37 ℃振荡孵育15 min,孵育过程中每2 min混匀1次,保证中间充分反应;加入350 μL无菌纯水,静置30 s,再加入12 μL NaCl溶液(5 moL/L),涡旋混匀。8 000 r/min离心5 min,弃上清液,100 μL PBS重悬沉淀,再加入100 μL HL-SAN buffer(5.5 moL/L NaCl,100 mmoL/L MgCl2水溶液),混匀。加入10 μL HL-SAN,立即混匀,37 ℃ 1 300 r/min孵育15 min;每管加入1 mL PBS,8 000 r/min离心3 min;弃上清液,1 mL PBS重悬,8 000 r/min离心3 min;弃上清液,用250 μL PBS重悬沉淀,重悬液用于核酸提取。
1.3.2SDS法 取8 mL含菌血液,800 r/min离心5 min,留取血浆,弃下层血细胞;将血浆以9 000 r/min离心5 min。弃上清液,加入160 μL 无菌PBS 重悬沉淀,再加入80 μL 无菌5% SDS溶液(终浓度为1.6%),37 ℃振荡孵育15 min,孵育过程中每2 min混匀1次,保证中间充分反应;加入350 μL无菌纯水,静置30 s,再加入12 μL NaCl溶液(5 mol/L),涡旋混匀。8 000 r/min离心5 min,弃上清液,加入PBS洗涤SDS,再以8 000 r/min离心5 min。重复上一步。100 μL PBS重悬沉淀,再加入100 μL HL-SAN buffer,混匀。加入10 μL HL-SAN,立即混匀,37 ℃ 1 300 r/min孵育15 min;每管加入1 mL PBS,8 000 r/min离心3 min;弃上清液,1 mL PBS重悬,8 000 r/min离心3 min;弃上清液,用250 μL PBS重悬沉淀,重悬液用于核酸提取。
1.3.3水洗法 取8 mL含菌血液,3 200 r/min离心30 s,留取血浆,弃下层血细胞;量取血浆于新的5 mL低吸附管内,并加入等体积无菌超纯水,涡旋混匀;室温孵育5 min,期间不断混匀;13 300 r/min离心2 min;弃上清,250 μL PBS重悬沉淀,重悬液用于核酸提取。
1.3.4核酸提取 严格按照Zymo BIOMICS DNA minipre Kit核酸提取试剂盒说明书进行核酸提取。
1.3.5qPCR 分别使用nuc[5]、phoE和CALB[6]基因对标本中的金黄色葡萄球菌、肺炎克雷伯菌和白色念珠菌进行荧光定量分析。采用GAPDH[7]和β-actin[7]基因对标本中的人源核酸进行荧光定量分析。其中GAPDH、β-actin、nuc、phoE基因的检测采用探针法qPCR,CALB基因的检测采用染料法qPCR。均采用25 μL体系,程序设定为95 ℃ 10 min 1个循环:预变性;40个循环(95 ℃ 15 s,60 ℃ 1 min):变性,退火,延伸; 40 ℃ 1 s 1个循环:冷却。具体引物及探针序列见表1。

表1 实验所用引物和探针
1.4统计学处理 将制备的未去宿主处理和去宿主处理的临床模拟标本组的核酸作为模板,进行qPCR检测,获得各标本中不同目的基因的Ct值。因Ct值与核酸水平呈反比,故比较其Ct值即可对比其中人源核酸及病原菌核酸的数量。按如下公示计算:未进行去宿主处理的标本Ct值-对应的去宿主处理后的标本Ct值=ΔCt
2 结 果
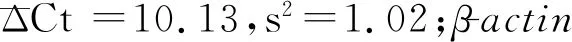
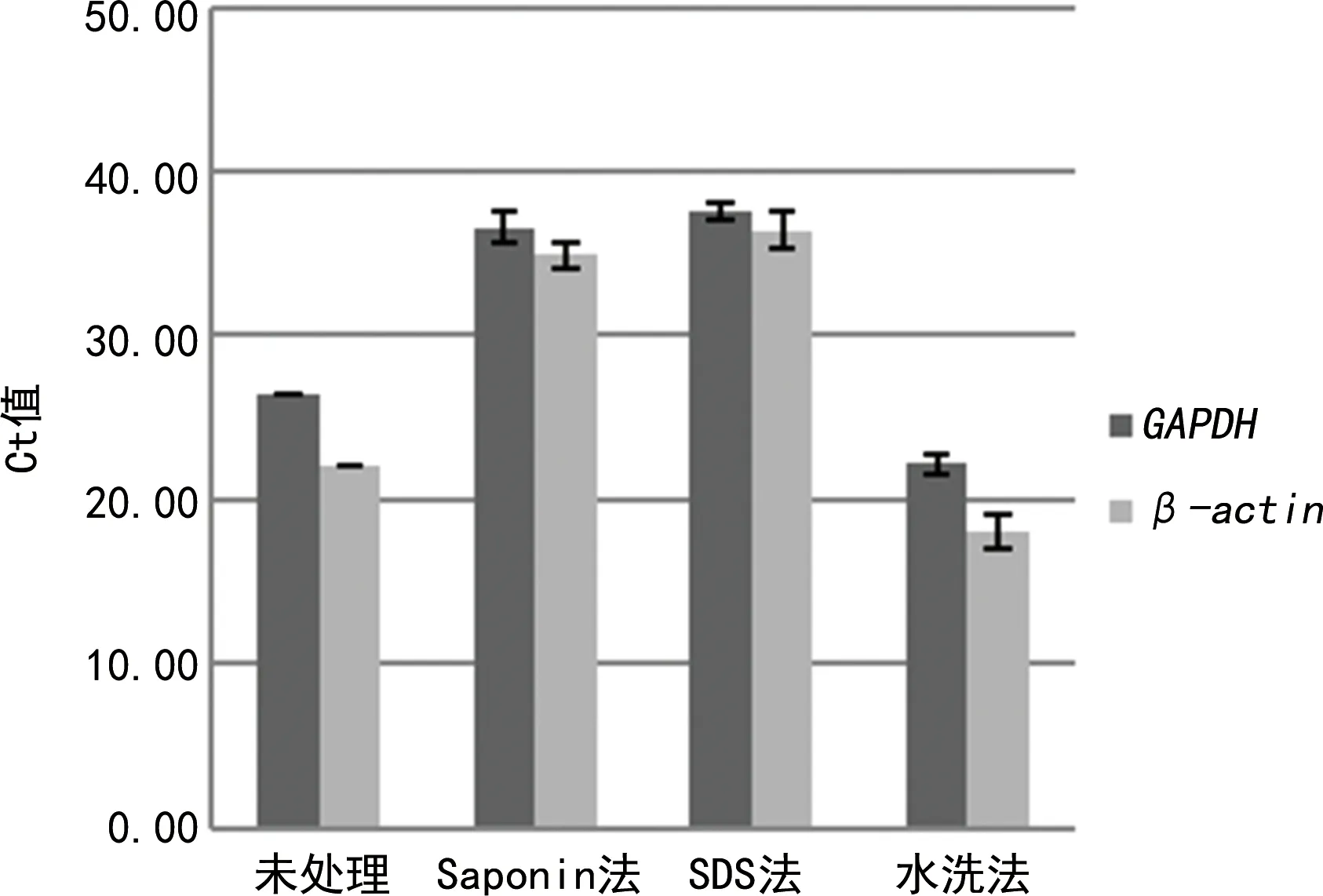
图1 标本中人源核酸变化
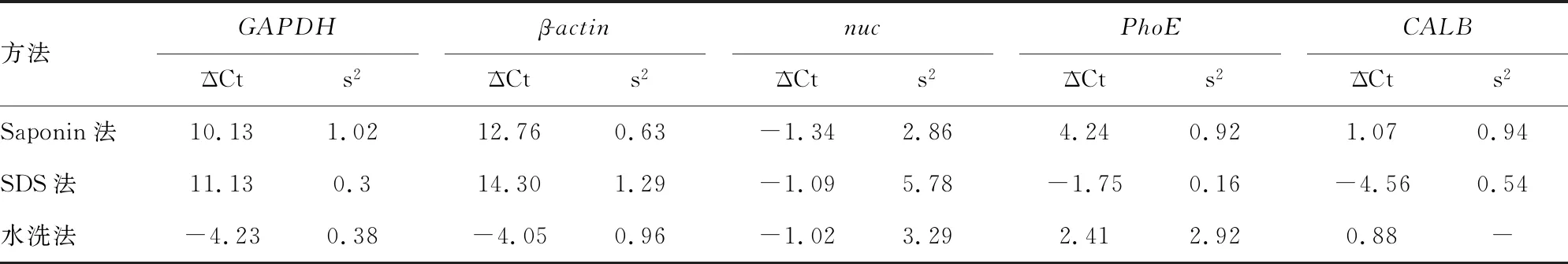
表2 3种方法标本中核酸总体变化
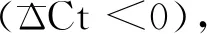
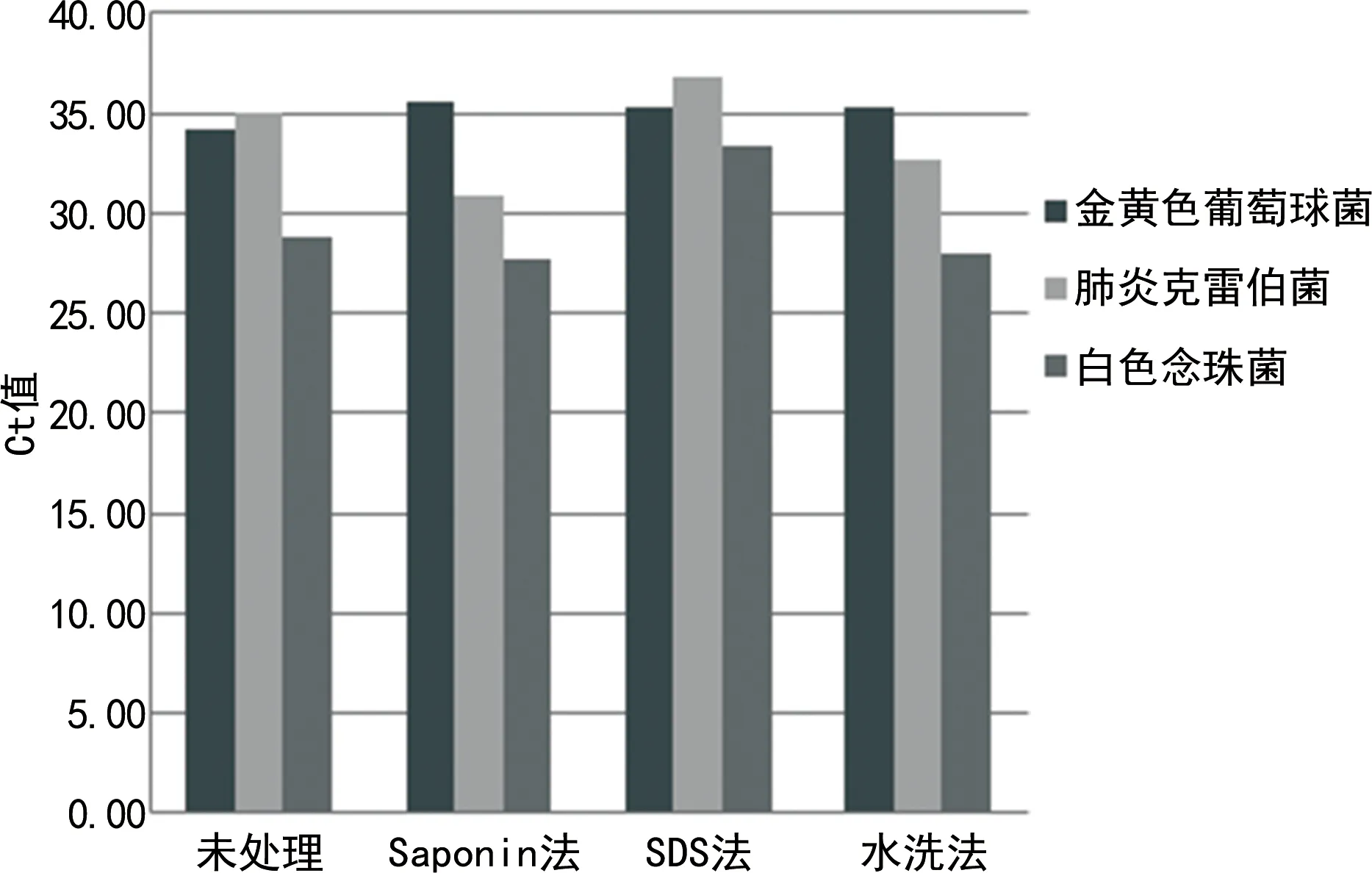
图2 标本中病原菌基因变化
3 讨 论
本研究采用Saponin法和SDS法进行去宿主核酸的原理类似,Saponin和SDS皆为表面活性剂,可以起到裂解细胞膜的作用,因为细菌、真菌均有细胞壁,对细胞膜有保护作用,所以可以针对性地裂解人源细胞膜,暴露人源核酸,并且通过渗透裂解进一步裂解细胞膜,同时使用非特异性核酸内切酶HL-SAN进行核酸降解。由于SDS法对HL-SAN的酶发挥作用有影响,所以在SDS法的流程中增加了洗涤的步骤。水洗法的实验原理是通过ANSON等[8]实验中评估的不同离心条件来分离菌体与人类细胞,选择最佳离心条件,同时使用低吸附管,减少核酸耗损,然后再用等体积无菌纯水涡旋、孵育,达到低渗裂解的效果,再离心,分离暴露的人源核酸和完整的菌体,最终达到去宿主核酸的目的。
Saponin法整体效果最优,去宿主核酸处理步骤使病原菌菌体充分暴露,核酸提取效率明显增加。而SDS法虽有效去除了人源核酸,但病原菌核酸也发生了丢失,判断可能是因为SDS解构蛋白能力较强,导致在去宿主核酸处理的步骤中,病原菌核酸也发生了丢失。
本研究结果显示,水洗法去宿主核酸效果劣于Saponin法和SDS法,考虑到操作误差及检测中的随机误差同时存在于另外两种方法,故可以排除随机误差的影响,认为是方法学的问题:一方面水洗法的步骤较为简单,低渗裂解比较温和,核酸去除效果不佳;另一方面去宿主处理后的标本经过了稀释重悬,在核酸提取步骤中破膜效果更好,核酸提取效率提高。对标本进行水洗法去宿主核酸处理后再提取核酸虽然提高了病原菌核酸提取效率,但同时也提高了人源核酸的提取效率,并且对人源核酸的富集效果优于病原菌核酸,因此,没有达到理想的去宿主核酸效果。
目前,去宿主核酸处理主要包括细胞处理和核酸处理两种方法。本实验中,水洗法利用了人源细胞与菌体的密度差异去除宿主细胞,在人源核酸去除方面效果略差于Saponin法和SDS法。而在关晴辉[9]的研究中,利用人类细胞与细菌直径的差异,使用过滤膜处理模拟痰标本,最终的去宿主核酸效果与NEB试剂盒相近且耗时更短。细胞处理法试剂耗材少、成本低、耗时短,值得进一步研究优化。
核酸层面的处理方法包括商品化试剂盒、渗透压裂解细胞膜和细胞裂解液(Saponin、Triton X-100、吐温-20)等。MAROTZ等[10]研究表明,渗透压裂解细胞膜的效果比较差,不宜单独使用,但可以在实验流程中配合其他细胞裂解液使用以提高去宿主核酸效率。PMA、Saponin、Triton-100、吐温-20等均为表面活性剂,能够裂解膜蛋白,配合核酸内切酶(HL-SAN、Turbo DNase等)使用可以达到去宿主核酸效果[10-15],本研究中Saponin法和SDS法就是采用该原理,联合使用渗透压裂解液、表面活性剂和核酸内切酶,证明该方法可行且效果较好。
本方案还有待改进,下一步实验应考虑将方案应用于真实多样的临床标本,并采用宏基因组学测序对去宿主核酸处理方法的灵敏度、重复性和特异性进行验证,同时对于Saponin及SDS裂解液的水平还可以进一步进行探索。尽可能提高方法的检测下限及排除干扰是分子诊断技术将来的发展方向。检测下限降低能够保证检测方法的灵敏度,并且在患者发病早期甚至还未发病前进行预测诊断,提前干预,减少不恰当的诊疗。而高灵敏度的检测方法带来的也可能是更多的干扰信息,环境中诸多的污染菌群及人体定植菌群极易混入检测标本中,规范标本采集技术、缩短标本周转时间、提高临床结果判读能力是解决该问题的关键。对于背景更复杂的其他标本(如痰液、肺泡灌洗液等),各种方法的处理流程及效果尚需进一步探讨。且本研究未将病毒纳入研究对象,在之后的研究中可以考虑扩大研究范围,全面探索细菌、真菌及病毒感染标本的去宿主处理方法。
未来的去宿主处理方法可以从技术层面研究新方法,降低人源细胞的干扰,富集病原菌,提高检出率。同时,还可以探索新物质,寻找更高效的去除标本中人类细胞或核酸的试剂或酶,或者寻找新的方法,在尽可能剔除人源细胞或核酸的基础上,减少病原菌核酸丢失。解决标本前处理问题,提高标本中病原菌核酸占比,能进一步推动宏基因组学测序技术在病原微生物诊断及预测方面的应用,最大限度地缩短病原菌鉴定及耐药基因检测的时间。快速准确的血流感染诊断、及时高效的耐药基因筛查能够帮助临床医生尽早选择适当的抗菌药物进行治疗,改善治疗疗效,减少临床不恰当的经验用药案例,为临床诊疗提供极大的便利。同时,随着病原菌基因组学研究的进一步深入,临床对于耐药基因的认识也会越来越深,使用宏基因组学测序技术可以更快、更全面地获得菌株耐药信息,帮助临床优化抗菌药物管理,对应对突发流行性疾病十分重要。同时也能为宏基因组学测序技术在其他方面的应用提供思路,如肿瘤DNA检测、流行病学调查研究等。

