血清GDF-15、BNP水平与慢性阻塞性肺疾病急性加重期患者肺动脉高压的相关性*
熊小平,张红丽,席建宏,拜合提尼沙·吐尔地
新疆医科大学第一附属医院RICU,新疆乌鲁木齐 830000
气道慢性炎症是慢性阻塞性肺疾病(COPD)的重要病因,据报道,COPD多发生于中老年群体,近年发病率有所升高[1]。随着COPD的病情进展,肺组织出现持续损伤,可导致急性加重,发展为COPD急性加重期(AECOPD)。AECOPD患者病情严重,部分患者外周气道阻塞、肺实质损坏、肺血管持续痉挛等使肺气体交换能力下降,可导致肺血管广泛收缩,引起肺动脉高压(PH)[2]。一旦发生PH,COPD患者可能会产生慢性肺源性心脏病,增加心力衰竭的风险,预后不佳[3]。因此,寻求可早期预测AECOPD患者PH发生风险的指标十分必要。以往临床常以右心漂浮导管法作为检查PH的主要手段,虽然诊断准确率高,但创伤大,患者接受度低,且无法早期预测PH发生风险,应用受限[4]。生长分化因子-15(GDF-15)是一种具有免疫调节作用的细胞因子,正常情况下,机体支气管内GDF-15水平较低,在炎症或损伤等状态下,血清GDF-15表达水平明显升高,并参与炎症[5]。脑钠肽(BNP)主要来源于心室,具有利尿、排钠及舒张血管等作用,被广泛用于评估心血管疾病[6]。但近年有研究发现,血清BNP与肺微循环血管阻力有一定关系,BNP可减少氧自由基分泌,减轻炎症程度,缓解肺血管重构[7]。因炎症是AECOPD的发病基础,推测血清GDF-15、BNP可能与AECOPD患者PH发生有关,但目前此类研究较少,基于此,本研究旨在观察血清GDF-15、BNP在AECOPD患者中的表达水平,并分析二者与PH发生的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2018年3月至2020年3月在本院确诊并接受治疗的93例AECOPD患者作为研究对象,本研究实施获得本院医学伦理委员会批准,患者及家属对本研究相关情况知情并签署知情同意书。93例患者中男49例,女44例;年龄45~73岁,平均(60.52±3.85)岁;COPD病程:<5年32例,5~10年47例,>10年14例;肺功能分级[8]:Ⅰ级30例,Ⅱ级46例,Ⅲ级17例;合并基础疾病(主要包括高血压、糖尿病、血脂异常)31例。
1.2纳入和排除标准
1.2.1纳入标准 (1)AECOPD符合《慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)》[9]中诊断标准:患者呼吸困难加重,咳嗽、喘息及胸闷等症状加剧,痰液量增多,痰液呈脓性;且经CT、X线片及实验室等检查确诊。(2)参照上述诊治指南为患者实施合理治疗,如吸氧、糖皮质激素及支气管扩张剂等药物干预。(3)患者依从性好,能够配合相关人员接受检查,完成本调查研究。(4)患者精神正常。
1.2.2排除标准 (1)合并肺结核、哮喘等其他呼吸系统疾病;(2)合并肝衰竭或肾衰竭等重要脏器疾病;(3)合并肺癌、胃癌等恶性肿瘤;(4)伴慢性心力衰竭、脑梗死等影响血清GDF-15水平的疾病;(5)伴急性心肌梗死、冠状动脉综合征等影响血清BNP水平的疾病。
1.3方法
1.3.1AECOPD患者PH评估及分组方法 患者入院48 h内进行右心导管检查,参照《肺动脉高压筛查诊断与治疗专家共识》[10]中标准评估AECOPD患者PH状况,若出现下述情况即可判断为发生PH:患者出现活动后气短、乏力,可伴胸痛、眩晕、咯血等症状;于海平面状态下,患者静息时,右心导管检查肺动脉收缩压超过30 mm Hg(1 mm Hg=0.133 kPa)或平均肺动脉压超过25 mm Hg,或运动时平均肺动脉压超过30 mm Hg。将发生PH患者纳入PH组,反之纳入无PH组。
1.3.2实验室指标检测方法 于患者入院时采集清晨空腹外周静脉血5 mL,室温下静置1 h,以3 000 r/min离心10~15 min(山东梁嘉机械设备有限公司提供的TG16-X型离心机),取上清液,置于-80 ℃环境下保存待检;采用酶联免疫吸附试验检测血清GDF-15、BNP、Toll样受体4(TLR4)水平,试剂盒均由美国R&D公司提供;采用免疫散射比浊法测定血清C反应蛋白(CRP)水平,试剂盒由上海恒远生物科技有限公司提供。所有操作严格按照试剂盒说明书进行。
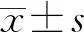
2 结 果
2.1AECOPD患者PH发生情况 93例AECOPD患者中有34例患者发生PH,发生率为36.56%。
2.2两组患者基线资料及实验指标比较 PH组患者血清CRP、TLR4、GDF-15、BNP水平均高于无PH组,差异均有统计学意义(P<0.05);两组其他基线资料比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组患者基线资料及实验指标比较
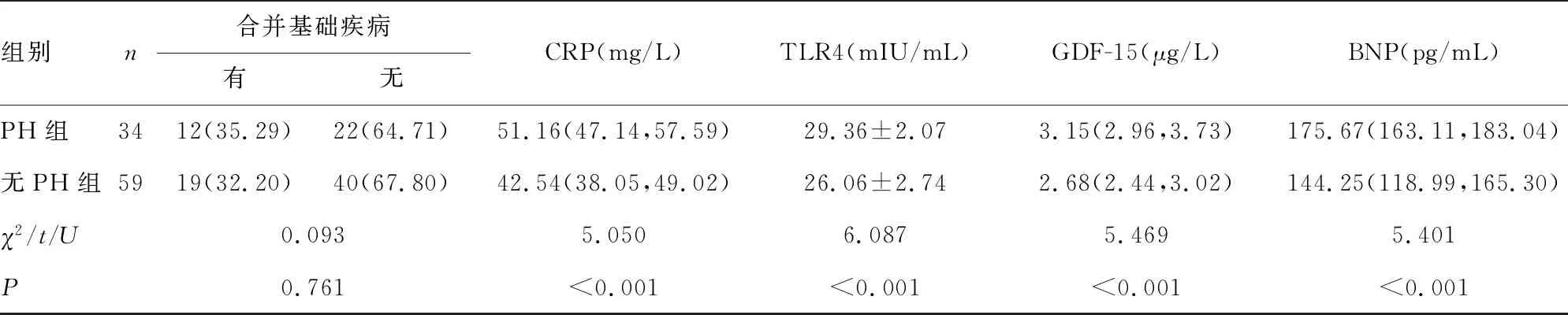
组别n合并基础疾病有无CRP(mg/L)TLR4(mIU/mL)GDF-15(μg/L)BNP(pg/mL)PH组3412(35.29)22(64.71)51.16(47.14,57.59)29.36±2.073.15(2.96,3.73)175.67(163.11,183.04)无PH组5919(32.20)40(67.80)42.54(38.05,49.02)26.06±2.742.68(2.44,3.02)144.25(118.99,165.30)χ2/t/U0.0935.0506.0875.4695.401P0.761<0.001<0.001<0.001<0.001
2.3各项主要指标与AECOPD患者PH发生关系的回归分析 将2.2中比较差异有统计学意义的变量作为自变量(均为连续变量),并将AECOPD患者PH发生情况作为因变量(1=发生,0=未发生),经Logistic回归分析发现,CRP、TLR4、GDF-15、BNP过表达与AECOPD患者PH发生有关(OR>1,P<0.05),后建立多元回归模型,结果显示,CRP、TLR4、GDF-15、BNP过表达与AECOPD患者PH发生有关,可能是AECOPD患者PH发生的风险因子(OR>1,P<0.05)。见表2。

表2 各项主要指标与AECOPD患者PH发生关系的回归分析
2.4入院时血清GDF-15、BNP单独及联合检测预测AECOPD患者PH发生风险的价值分析 将AECOPD患者PH发生情况作为状态变量(1=发生,0=未发生),并将血清GDF-15、BNP水平作为检验变量,绘制ROC曲线(图1),结果显示,当血清GDF-15、BNP的cut off值分别取2.86 μg/L、151.53 pg/mL时,提示AECOPD患者PH发生风险高,且此时GDF-15、BNP单独及联合检测预测AECOPD患者PH发生的AUC分别为0.842、0.837、0.845,均有一定预测价值。见表3。

图1 入院时血清GDF-15、BNP单独及联合检测预测AECOPD患者PH发生风险价值的ROC曲线
2.5血清GDF-15、BNP水平之间的关系 经双变量Spearman直线相关检验结果显示,血清GDF-15、BNP水平之间呈正相关(r=0.152,P=0.040)。散点图见图2。

表3 入院时血清GDF-15、BNP单独及联合检测预测AECOPD患者PH发生风险价值分析结果

图2 血清GDF-15、BNP水平之间相关性散点图
3 讨 论
PH是AECOPD常见的并发症,传统观点认为缺氧是导致PH发生的主要机制,但经氧疗干预无法纠正,PH发生风险仍较高[11]。林沛茹等[12]研究发现,AECOPD患者发生PH的风险较高,全身炎症在PH中发挥重要作用。本研究中93例AECOPD患者经评估发现,有34例患者发生PH,发生率为36.56%,证实了上述研究结论。因此,寻求可早期预测AECOPD患者PH发生的指标至关重要。
COPD的病理基础主要为慢性炎症导致的呼吸道阻塞及气流受限,这种长期存在的呼吸道阻塞及气流受限可使患者出现慢性缺氧状态,长期慢性缺氧将诱发PH[13],可见炎症在PH中发挥重要作用。CRP属于一种急性时相反应蛋白,一旦机体发生感染或炎症时,CRP水平急剧升高,被认为是评估急性炎症的关键指标[14]。有研究显示,CRP在COPD发生和发展中发挥重要作用,动态监测血清CRP水平对评估患者病情发展有一定价值[15]。但CRP是一项非特异性炎症指标,容易受较多因素干扰,如年龄、合并基础疾病等,用于评估AECOPD患者PH发生存在不足,因此,本研究未将其作为主要研究指标。TLR4是参与机体免疫的重要炎症因子,已被证实可促进白细胞介素-3、白细胞介素-10等可溶性细胞因子合成,这些细胞因子可促进机体免疫应答;此外,TLR4还可诱导促炎因子释放,在气道炎性损害中发挥重要作用[16]。本研究发现,PH组患者血清CRP、TLR4水平均高于无PH组,且经Logistic回归分析显示,血清CRP、TLR4过表达与AECOPD患者PH发生有关,可能是PH发生的风险因子,但需要注意的是,血清CRP、TLR4对AECOPD患者PH的影响风险系数值较GDF-15、BNP低。因此,本研究未将CRP、TLR4等常规炎症指标作为主要炎症因子过多阐述。
GDF-15是转化生长因子-β超家族重要成员,其水平与肺功能损伤有关,GDF-15水平越高,肺功能损害越重,这与血清GDF-15水平异常升高会造成气道上皮细胞防御功能损伤、气道黏液分泌增加、气道阻力增大、不利于肺通气有关[17-18],提示GDF-15参与COPD的发生及发展。BNP是由心室肌细胞快速分泌的一种心脏神经激素,心肌缺血、损伤及坏死等心肌结构或功能变化均可促进BNP合成,且在低氧血症及炎症中BNP水平也异常升高[19]。据报道,BNP可减轻炎症引起的氧化应激反应,在COPD发生和发展中发挥重要作用,与PH有一定关系[20]。
本研究结果显示,PH组患者血清BNP、GDF-15水平均高于无PH组,经Logistic回归分析显示,血清BNP、GDF-15过表达可能是AECOPD患者PH发生的风险因子,提示BNP、GDF-15过表达与AECOPD患者的PH发生有关,可能是PH发生的风险因子及预测因子。分析可能原因为,GDF-15可参与细胞生长及炎症等过程,GDF-15可通过诱导激活磷脂酰肌醇-3-激酶/蛋白激酶B信号通路,促进黏蛋白5AC在气道上皮细胞表达,进而增加痰液量,加重气道阻塞;此外,GDF-15过表达会激活炎症,增加气道中性粒细胞数量,进而激活炎症细胞因子,扩大炎症,加剧AECOPD患者病情恶化,增加PH发生的风险[21]。BNP增加AECOPD患者PH发生风险的机制可能为,BNP高表达可诱导局部自身免疫性损伤加剧,促进肺泡上皮过氧化损伤及修复机制障碍等,BNP可促进AECOPD进展过程中小气道重塑、平滑肌增生等,进而增加肺通气阻力,导致AECOPD病情恶化,增加PH发生的风险[22]。
为进一步明确GDF-15、BNP是否可预测AECOPD患者发生PH,本研究进一步绘制ROC曲线,结果显示,患者入院时血清GDF-15、BNP单独及联合检测预测AECOPD患者PH发生风险均有一定价值,且当二者的cut off值分别取2.86 μg/L、151.53 pg/mL时可获得最佳预测价值,提示早期监测AECOPD患者血清GDF-15、BNP水平对预测PH发生风险有重要意义,未来可考虑动态监测AECOPD患者血清GDF-15、BNP表达水平,若发现二者表达水平异常升高,可采取合理干预措施,如及时抗感染治疗,以降低PH发生的风险。此外,本研究还观察了血清GDF-15、BNP之间的关系,发现二者呈正相关,提示GDF-15、BNP可能相互作用,共同参与AECOPD的发生及发展,但二者相互作用具体机制尚未阐明。本研究还存在一定的局限,如仅观察CRP、TLR4、GDF-15、BNP与PH发生的关系,其他可能的相关指标并未纳入,仍有待进一步观察其他血清炎症指标与AECOPD患者PH发生的关系;此外,本研究未深入探究主要血清指标与AECOPD患者PH程度的关系,具体情况还需进一步研究证实。
综上所述,AECOPD患者入院时血清GDF-15、BNP水平异常表达与PH发生有一定关系,二者过表达可能是PH发生的风险因子,早期监测患者血清GDF-15、BNP表达水平,对预测AECOPD患者PH的发生有一定价值。

