198例化脓性肝脓肿患者病原学及临床特点分析*
张 颖,郭 思,2△,许泼实,2
1.河南大学人民医院/河南省人民医院检验科,河南郑州 450003;2.郑州大学华中阜外医院检验科,河南郑州 450003
化脓性肝脓肿(PLA)是由肝内脓液聚集,继发于肝实质细菌感染引起的局部炎性反应[1-2],是肝胆外科常见的感染性疾病之一。近年来,随着人口老龄化加剧,抗菌药物和免疫抑制剂的使用,以及医疗设备种类的增多和使用频繁,亚洲地区PLA的发病率逐渐增高[3],为每年17.59/100 000~11.99/100 000,远远高于西方国家[4]。PLA是一种潜在的致死性疾病,病死率高达19%[5]。因PLA临床表现缺乏特异性,精确的病原学评估是早期诊断和治疗的关键,其病原学特点因地区而异。在西方国家,最常见的致病菌是大肠埃希菌(EC),其次是肺炎克雷伯菌(KP)、肠球菌和链球菌。而在亚洲地区,最常见的致病菌是KP,并且在西方国家被报道的概率越来越高,KP已经成为亚洲及欧美国家的一种威胁生命的病原体[6-7]。1986年我国台湾报道了可引起多部位脓肿的KP,定义为高毒力肺炎克雷伯菌(hvKP),与经典肺炎克雷伯菌不同,hvKP可导致远处侵袭性感染,一旦发生侵袭性扩散,往往会产生严重的、不可逆转的后遗症,如失明、中枢神经系统损伤等[8]。本研究回顾性分析2016年6月至2020年8月河南省人民医院收治的198例PLA患者的临床资料,进一步分析KP-PLA与EC-PLA的临床特点、治疗及预后,为PLA早期、精准的诊断及更好的经验性抗菌药物选择提供理论依据。
1 资料与方法
1.1一般资料 选择2016年6月至2020年8月河南省人民医院收治的临床诊断为PLA的198例患者作为研究对象,回顾性分析其临床资料。纳入标准:(1)患者有发热、寒战、肝区不适及肝区压痛等临床表现;(2)腹部超声、计算机断层扫描或磁共振成像符合肝脓肿表现;(3)细菌培养阳性;(4)抗菌药物治疗后病灶消退;(5)经皮穿刺或外科手术治疗后证实。排除标准:(1)真菌性肝脓肿、阿米巴肝脓肿、结核性肝脓肿及由恶性胆道梗阻所致的肝脓肿;(2)临床资料缺失。根据细菌培养结果将KP-PLA设为KP-PLA组,EC-PLA设为EC-PLA组。
1.2方法 根据患者的住院病历,收集患者性别、年龄、基础疾病、症状体征、实验室及影像学检查、并发症、治疗方法、临床结果等,疗效观察时间从入院至出院。判断标准:(1)痊愈表现为症状和体征消失,脓肿完全吸收;(2)好转表现为症状和体征消失,影像学检查提示脓肿呈吸收期改变;(3)未愈表现为症状和体征无好转,脓肿大小无变化或甚至加重,或出现新发脓肿而再次入院;(4)死亡。痊愈、好转视为有效,未愈、死亡视为无效。
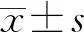
2 结 果
2.1一般资料 198例PLA患者来自肝胆外科、感染科、普外科、消化内科等,无寄生虫肝脓肿患者。其中男120例(60.6%),女78例 ( 39.4%),男女比例为1.5∶1.0;平均年龄(54.7±14.0)岁;吸烟72例(36.4%);饮酒56例(28.3%);基础疾病:高血压32例(16.2%),糖尿病70例(35.4%),胆石病42例(21.2%),病毒性肝炎10例(5.1%),肝硬化10例(5.1%),肝胆肿瘤40例(20.2%),冠状动脉疾病22例(11.1%),肝胆系统手术史74例(37.4%);临床表现: 发热186例(93.9%),寒战94例(47.5%),腹痛80例(40.4%),恶心呕吐58例(29.3%); 实验室检查:白细胞计数>10×109/L 114例(57.6%),白细胞计数<4×109/L 4例(2.0%); 脓肿部位:左侧32例(16.2%),右侧124例(62.6%),双侧42例(21.2%);脓肿个数:单个脓肿67例(33.8%),多个脓肿131例(66.2%);治疗方案:单纯抗菌药物治疗10例(5.1%),抗菌药物+经皮穿刺引流治疗134例(67.7%),抗菌药物+外科手术治疗54例(27.2%);并发症:胸腔积液94例(47.5%),脓毒血症24例(12.1%),感染性休克10例(5.1%),低蛋白血症20例(10.1%),并发疾病行二次手术58例(29.3%); 临床结果:死亡1例(0.5%),复发29例(14.6%)。
2.2病原学分布情况 纳入研究的198例PLA患者中细菌培养阳性99例,其中血培养20例,穿刺液63例,2例获得两种生物标本,97例获得1种生物标本,共检出115株细菌,其中86例(86.9%,86/99)检出单一细菌。检出的115株细菌中,KP培养阳性率最高(51株,44.3%),其次为EC(14株,12.2%)。革兰阳性菌(28株,24.3%)最常见的为屎肠球菌(10株,8.7%),其次为粪肠球菌和金黄色葡萄球菌(均为3株,2.6%)。多种病原菌混合性感染13例(13.1%,13/99),PLA患者的主要病原微生物培养结果见表1。

表1 198例PLA患者主要病原菌种类及分布
2.3主要病原菌的体外药敏试验结果 共培养出51株KP,其中超广谱β-内酰胺酶(ESBLs)阳性3株(5.9%),检出耐碳青霉烯类KP 1株,分离自一位47岁中年男性,合并有肝胆恶性肿瘤,有肝胆系统手术史,考虑为胆道感染引起的肝脓肿。培养出EC 14株,其中ESBLs阳性11株(78.6%)。分离出的主要病原菌KP和EC的药敏试验结果见表2。
2.4KP-PLA组和EC-PLA组患者临床特点比较 纳入研究的KP-PLA患者51例,EC-PLA患者14例。两组患者在年龄、性别、个人嗜好(吸烟、饮酒)、临床表现方面比较,差异均无统计学意义(P>0.05);KP-PLA组患者更易合并糖尿病,EC-PLA组患者常合并肿瘤、肝胆系统手术史,两组差异均有统计学意义(P<0.05)。见表3。
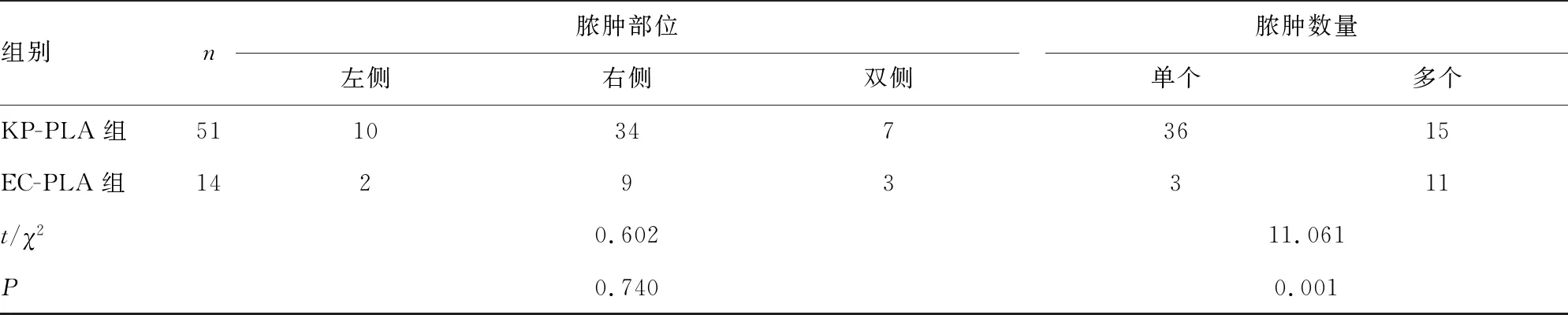
2.5两组患者实验室及影像学检查结果比较 KP-PLA组和EC-PLA组患者均有不同程度的感染指标水平升高,同时伴有肝功能损伤及清蛋白(ALB)水平降低,两组患者均以右侧肝脓肿多见,与KP-PLA组比较,EC-PLA组患者总胆红素(TBIL)水平更高且脓肿常为多发,差异均有统计学意义(P<0.05)。见表4。
2.6两组患者治疗方案及并发症比较 两组患者共有5例(7.7%)采用单纯抗菌药物治疗,60例(92.3%)采用抗菌药物+穿刺引流治疗;在并发症方面,EC-PLA组患者脓肿更易复发,与KP-PLA组比较,差异有统计学意义(P<0.05),见表5。
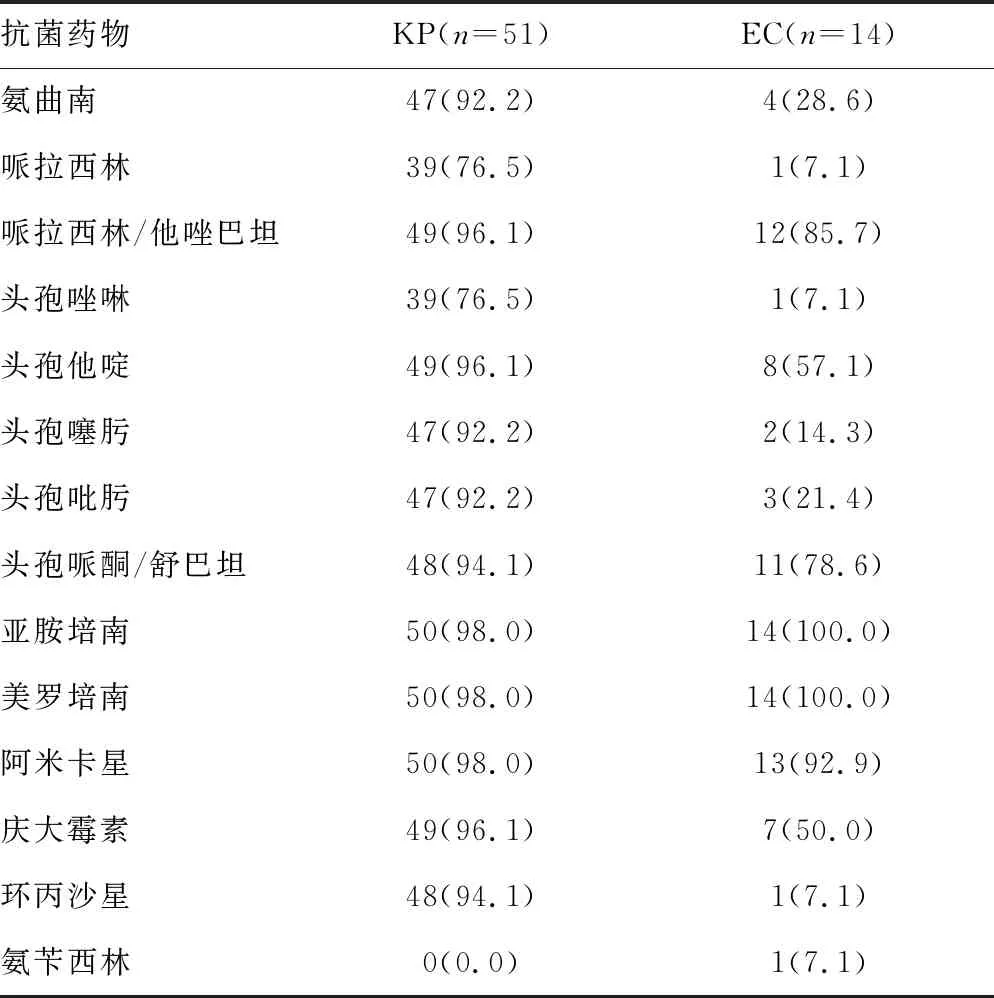
表2 PLA患者分离出的KP和EC的药物敏感率[n(%)]
表3 KP-PLA组和EC-PLA组患者临床特点比较
表4 两组患者实验室及影像学检查结果比较
组别n脓肿部位左侧右侧双侧脓肿数量单个多个KP-PLA组51103473615EC-PLA组14293311t/χ20.60211.061P0.7400.001

表5 KP-PLA组和EC-PLA组患者治疗方法及并发症比较(n)
3 讨 论
本研究198例PLA患者中男性多于女性,平均年龄(54.7±14.0)岁,这与KONG等[9]报道的2010-2014年299例PLA患者的临床和微生物特点研究结果一致。有研究表明,PLA患者多以发热、右上腹痛、呕吐等低特异性症状为主诉入院,常常合并有糖尿病和肝胆系统疾病[10]。本研究186例(93.9%)患者有发热,94例(47.5%)患者合并有寒战,70例(35.4%)患者合并有糖尿病,102例(51.5%)患者合并有胆道基础疾病。在临床工作中,遇到糖尿病合并有肝胆系统疾病的患者,当出现发热、寒战等临床表现时,应警惕PLA发生。本研究以右侧肝脓肿多见,考虑与肝脏解剖结构及肝脓肿感染途径有关,肝脏右叶大于左叶且肝右叶血流量较左叶大,此外,门静脉主干与右前分支成角接近180°,病原菌自门静脉入肝的血液进入右前支阻力最小。本研究以多发性肝脓肿居多,与既往研究多为右侧单发性脓肿不一致,考虑可能与纳入研究的PLA患者,绝大部分为下级医院转入,院前病程较长,老年患者居多且多合并有胆道疾病,高龄患者免疫力差,感染难以局限有关[9-11]。
KP-PLA组和EC-PLA组患者临床表现无明显差异,单纯通过临床表现来确定病原菌比较困难。糖尿病是KP-PLA已知的临床诱发因素,但地区差异和人口结构变化导致KP-PLA患者的糖尿病发病率不同。本研究54.9%的KP-PLA患者合并有糖尿病,糖尿病患者体内高糖水平为细菌生长提供了良好的内部环境,长期血糖升高使机体免疫功能受损,白细胞黏附、趋化及吞噬能力被抑制。此外,糖尿病常常会引起血管粥样斑块形成及内膜破坏等。因此,糖尿病患者极易感染,且感染往往很严重,并且易并发感染性休克和多器官功能障碍[2],临床医师应高度警惕其临床特点,对KP-PLA合并糖尿病患者应严格监测和控制血糖水平。与KP-PLA组比较,EC-PLA组患者平均年龄较大,多合并有肿瘤及肝胆系统手术史,脓肿常表现为多发且更易复发。EC是人和动物肠道内的正常菌群,当宿主免疫力下降或细菌侵入肠外组织或器官时,可引起肠外感染,当其大量繁殖,释放出大量毒素进入胆汁中,胆汁逆向反流,导致胆源性肝脓肿。EC-PLA更易复发考虑与年龄、基础疾病、多重耐药及致病菌有关。hvKP的确切定义仍存在争议,拉丝试验阳性的KP菌株并不一定表现出超强毒力,一些毒力因子,如K1/K2血清型、RmpA和需氧肌动蛋白,似乎与hvKP的超强毒力密切相关。在实验室检查方面,EC-PLA组和KP-PLA组患者白细胞计数、中性粒细胞计数、肝功能相关指标均有不同程度的异常,EC-PLA组患者TBIL水平升高更明显,但TBIL水平升高的程度是否与疾病的严重程度相关仍需要大量的临床数据验证。
近年来,随着微创介入的不断进步,PLA的治疗方法已经从传统的开腹脓肿切开引流逐步发展到超声或CT引导下穿刺引流,超声或CT引导下穿刺引流有创伤小、恢复快等优点,对肝脓肿的诊断与治疗有重要意义[11]。本研究中两组患者治疗方案和院内病死率方面无明显差异,90%以上的患者选用抗菌药物+穿刺引流治疗,住院病死率(1.5%)低于姚娜等[12]的研究,可能是因为及时准确的实施了干预措施。此外,一小部分病情严重的患者可能放弃了治疗,这也会导致住院病死率降低。药敏试验结果显示,KP对β-内酰胺酶抑制剂、第3代头孢菌素类和碳青霉烯类等几乎所有抗菌药物均高度敏感,而EC的耐药率较高,仅对亚胺培南、美罗培南和阿米卡星等几种抗菌药物较为敏感[13-14],与KHIM 等[15]的研究结果一致。本研究共培养出ESBLs阳性14株,其中EC占78.6%,共检出碳青霉烯类耐药菌株1株,其耐药机制可能与碳青霉烯酶的产生、外排泵的高度表达、抗菌药物作用靶点的改变及高产AmpC 酶或ESBLs基础上合并外膜蛋白丢失有关。碳青霉烯类耐药细菌感染限制了临床抗菌药物的选择,同时也给免疫缺陷患者的治疗带来了巨大挑战。本研究中经验性抗感染治疗方案多选用第3代头孢菌素或哌拉西林-他唑巴坦,合并重症感染者应用碳青霉烯类抗菌药物,值得注意的是,大多数患者初始抗感染治疗方案与药敏试验结果并不完全匹配,过度使用广谱和超广谱抗菌药物的现象在临床上普遍存在。初始用药方案的选择,过度应用抗菌药物的现状是否会导致耐药情况进一步演变仍需进一步探讨。本研究是1项单中心的回顾性研究,还存在一定的局限性,可能会在住院患者群体和与病史相关资料产生选择偏差;二是本研究没有对病原菌进行进一步的分子分析;三是没有探讨KP毒力与临床表现的关系。
综上所述,PLA常见于老年糖尿病及合并基础胆道疾病患者,KP和EC是PLA主要的致病菌,KP-PLA患者常合并糖尿病;EC-PLA多合并胆道疾病和肿瘤,脓肿常为多发且易复发,TBIL水平较高,病情往往更加危重。抗感染联合B超引导下穿刺引流已经成为一线治疗方式,疗效好,安全性佳。应尽早确定病原菌种类,合理使用抗菌药物,加强耐药监测,避免多药耐药菌株产生,选择个体化诊疗方案,从而提高治愈率,降低病死率,减少并发症发生。

