高通量分子测序技术在男性新生儿G6PD缺乏症筛查中的应用研究*
杨金玲,陈大宇,黄丽华,韦江艳
广西科技大学附属妇产医院/广西科技大学附属儿童医院/广西壮族自治区柳州市妇幼保健院新生儿疾病筛查中心,广西柳州 545001
葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症是由于G6PD基因缺陷导致红细胞膜的G6PD生成障碍。G6PD缺乏在某些诱因引起急性溶血性贫血,并导致高胆红素血症,新生儿期重症可发展为核黄疸,导致脑瘫[1-2]。由于G6PD基因突变与其表型之间的关系尚未完全明确、G6PD缺乏症有明显遗传多样、一些特殊病理状态下G6PD酶活性并不降低和截断值设置不合理等原因,致使男性新生儿G6PD缺乏症并未全部检出[3-4]。本研究采用高通量分子测序(NGS)技术检测男性新生儿G6PD缺乏症,探讨男性新生儿G6PD基因型与表型的相关性,并合理设置男性新生儿G6PD酶活性筛查截断值,为临床诊疗提供依据。
1 资料与方法
1.1一般资料 随机收集柳州市妇幼保健院新生儿疾病筛查中心男性新生儿足跟干滤纸血片1 092例。本项目通过柳州市妇幼保健院伦理委员会批准,监护人均签署知情同意书。
1.2方法
1.2.1标本采集 出生72 h后采集男性新生儿足后跟血制成干滤纸血片,5个工作日内送检。
1.2.2仪器与试剂 G6PD酶活性分析采用丰华公司的全自动时间分辨荧光免疫分析仪及配套分析试剂盒。采用Lab Aid 824核酸提取试剂及提取仪器提取干滤纸血片中的DNA 。采用NGS技术对G6PD基因外显子2~13测序,不一致的结果采用多色探针荧光聚合酶链反应(PCR)熔解曲线法验证(厦门致善生物G6PD基因检测试剂盒) 。
1.3评估方法 G6PD酶活性<2.6 U/gHb,筛查结果为阳性。本研究检出的G6PD基因变异,查询公共数据库gnomAD、千人项目中国人群、ExAC数据库等,并通过多种计算机软件预测该变异对基因或基因产物致病结论是否一致。PCR熔解曲线结果判读按G6PD基因检测试剂盒说明书进行。WHO根据G6PD缺乏症患者酶活性等级及临床表现,将G6PD缺乏症分为5种类型:Ⅰ型酶活性最低,为0%;Ⅴ型酶活性最高,>200%;Ⅱ型酶活性小于正常酶活性的10%,患者有间断溶血发作,尤其是在摄食蚕豆及其制品或药物后诱发急性溶血,不伴慢性溶血;Ⅲ型酶活性为正常酶活性的10%~60%,少数抗疟疾药物(如伯氨喹)或感染(如伤寒、大叶性肺炎、肝炎)可诱发溶血;Ⅳ型酶活性大于正常酶活性的60%,无特殊临床表现。通过WHO的G6PD基因突变分型数据库可查询突变基因所属G6PD缺乏症的类型。
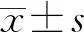
2 结 果
2.1NGS技术与酶活性检测中假阴性结果分析 本研究共检测1 092例男性新生儿,121例检出G6PD基因突变:G6PD缺乏症为X连锁不完全显性遗传,男性检测到突变基因即表现为G6PD酶活性降低,本地区男性新生儿G6PD缺乏症阳性率为11.08%(121/1 092)。G6PD缺乏症男性新生儿酶活性为(1.20±0.72)U/gHb,健康男性新生儿G6PD酶活性为(6.66±0.91)U/gHb。酶活性分析检出G6PD酶活性缺乏114例,假阴性7例;NGS技术检出G6PD基因变异115例,假阴性6例,见表1。NGS技术的灵敏度、特异度、阳性预测值和阴性预测值分别为95.04%、100.00%、100.00%和99.39%;G6PD酶活性分析的灵敏度、特异度、阳性预测值和阴性预测值分别为94.21%、100.00%、100.00%和99.28%。两种检测方法差异无统计学意义(P>0.05)。
2.2G6PD基因型与G6PD酶活性分析 本研究共检测到7种G6PD基因突变,所有突变均已被报道。c.1388G>A等位基因型检出率最高,占G6PD等位基因的41.32%,c.1376 G > T、c.95 A > G、c.1024 C > T、c.871 G > A、c.392 G > T和c.487G>A检出率依次降低。最常见的4种变异位点c.1376G>T、c.95A>G、c.1388G>A、c.1024C>T酶活性依次增高,4种变异位点酶活性比较差异有统计学意义(F=16.2,P<0.05)。本地男性新生儿G6PD酶活性WHO分型为Ⅱ型和Ⅲ型,以Ⅱ型为主,占85.12%(103/121),见表2。
2.3ROC曲线分析男性新生儿G6PD缺乏筛查截断值 对男性新生儿G6PD基因正常和基因突变标本的酶活性进行ROC曲线分析,约登指数最大为0.992 8,G6PD缺乏筛查截断值<4.24 U/gHb为阳性标本,灵敏度为99.28%,特异度为100.00%,曲线下面积(AUC)为0.999,见图1。

表1 NGS技术与G6PD酶活性检测的假阴性结果比较
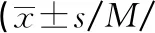
表2 G6PD基因型与G6PD酶活性检测范围)
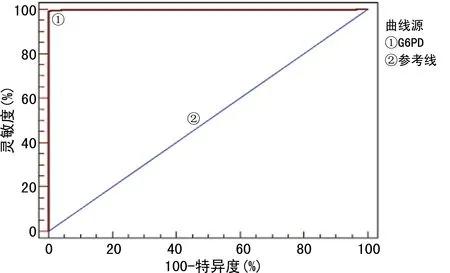
图1 男性新生儿G6PD缺乏症截断值ROC曲线分析
3 讨 论
G6PD缺乏症为X连锁不完全显性遗传,男性发病多于女性;G6PD缺乏症患者临床表现差异极大,重者可危及生命。有研究报道,本地区人群G6PD缺乏阳性率为7.66%,本研究中男性新生儿G6PD缺乏阳性率为11.08%,在G6PD缺乏症发生率高的地区进行新生儿G6PD缺乏症筛查具有重要意义[5-7]。
截至目前,已报道的G6PD基因突变超过210种,95%为点突变[8]。本研究中c.1388G>A、c.1376 G > T、c.95 A > G 和c.1024 C > T 4种突变基因型占95.04%,c.1388G>A突变基因型检出率最高(41.32%),与其他地区报道的结果相似[9-10]。按照WHO分型,检出的7种基因型变异属于Ⅱ型或Ⅲ型[11]。除Ⅲ型变异c.487G>A的酶活性相对较低外,所有Ⅱ型变异的酶活性均远远低于Ⅲ变异,差异有统计学意义(P<0.05)。本研究Ⅱ型突变中,酶活性降低程度因基因型而异,c.1376G>T酶活性最低,c.95A>G、c.1388G>A 和c.871G>A酶活性依次升高。Ⅱ型突变酶活性范围<10%,酶活性降低程度大,在本实验室酶活性检测中未出现假阴性结果[11]。Ⅲ型突变中检测到1例c.487G>A变异,其G6PD酶活性最低,其余c.1024C>T、c.392G>T酶活性依次升高。
本研究中NGS技术和G6PD酶活性检测中均出现假阴性结果。NGS技术的假阴性结果经验证为常见的G6PD基因突变位点,G6PD酶活性检测结果为阳性。理论上,NGS技术可检出G6PD基因中常见变异,由于标本质量不合格、实验过程中DNA含量不足及生物信息分析人员的熟练程度等亦可能出现假阴性结果。本研究中G6PD酶活性检测假阴性结果均为Ⅲ型变异中c.1024C>T突变或c.392G>T突变。Ⅲ型酶活性缺乏不明显甚至酶活性不缺乏的病例通常无法检出,但这些病例仍然可以因为抗疟疾药物或感染等因素诱发溶血。在做好质量控制的基础上,NGS技术可以弥补因不同基因突变导致酶缺乏程度不一或其他急性溶血情况下出现酶活性较高所致的漏检。NGS技术灵敏度、特异度、阳性预测值和阴性预测值与G6PD酶活性检测比较,差异均无统计学意义(P>0.05),两种方法可互为补充。
本研究G6PD酶活性检测中有7例男性新生儿使用常规截断值无法检出,可见筛查截断值的设置很重要[12]。本研究发现,G6PD缺乏男性新生儿酶活性平均值为(1.20±0.72)U/gHb,健康男性新生儿G6PD酶活性为(6.66±0.91)U/gHb,二者酶活性基本不存在交叉。本研究取约登指数最大时的截断值4.24 U/gHb,其灵敏度为99.28%,特异度为100.00%,AUC为0.999,以提高检测男性新生儿G6PD缺乏症检出率。截断值重新设定后,G6PD酶活性检测可以检出可疑Ⅱ型变异,通过G6PD基因检测可确定是否携带致病基因,实现早诊断、早预防。
综上所述,NGS技术可用于男性新生儿G6PD缺乏症检测,精准指导临床早诊断、早预防;G6PD酶活性检测截断值设置合理时,价格低廉、快速且容易实施;两种检测方法结合临床相关资料综合判断可用于临床用药指导、急性溶血鉴别诊断、预防新生儿核黄疸等。本研究仅探讨NGS技术在男性新生儿G6PD缺乏症筛查中的应用,女性新生儿G6PD缺乏症筛查未做研究。由于女性有2条X染色体,并且X染色体随机失活,存在不完全显性遗传,女性携带者酶活性可完全正常或稍微降低,生化检测漏检率高,今后应考虑NGS技术应用于急性溶血期患者及女性杂合子诊断。

