血清UA、non-HDL-C及COR与脑卒中后抑郁发生及发展的相关性研究
袁少勇, 张丽君, 万雪梅, 赵明媚
我国脑卒中的发病率逐年增长,脑卒中会对患者的神经功能造成严重损伤,使得脑卒中患者有较高的致残率,对患者的日常生活造成严重影响[1]。脑卒中后抑郁是脑卒中较为常见的并发症之一,目前对脑卒中后抑郁的发病机制缺乏了解,因此对脑卒中后抑郁缺乏有效的治疗手段[2]。尿酸(uric acid,UA)是嘌呤物质代谢的终产物,是反映机体嘌呤代谢情况和肾脏功能的重要指标[3],研究报道显示血清UA水平升高与脑卒中的发生存在一定相关性,高血清UA脑卒中患者预后较差[4]。非高密度脂蛋白胆固醇(non-high-density lipopro-tein cholesterol,non-HDL-C)是指总胆固醇(total cholesterol,TC)中除去高密度脂蛋白胆固醇(high-density lipoproteincholesterol,HDL-C)的部分,主要包括中间密度脂蛋白(intermediate density lipoprotein,IDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和超低密度脂蛋白(very low-density lipoprotein,VLDL)等致动脉粥样硬化颗粒[5,6],在脑卒中预后预测和评估中具有较高的临床价值[7]。皮质醇(cortisol,COR)属于糖皮质激素,主要分布于肾上腺皮质,能够促进机体的糖代谢功能[8]。研究报道显示脑卒中患者体内COR水平异常升高,并且可以作为脑卒中发生发展的重要指标[9]。本研究对2017年4月-2019年4月期间我院诊治的150例脑卒中患者进行临床研究,以此探讨血清UA、non-HDL-C及COR与脑卒中有抑郁的发生及发展的相关性。
1 资料与方法
1.1 一般资料 选择2019年4月-2022年4月期间我院诊治的150例脑卒中患者进行临床研究,患者入院后进行汉密顿抑郁量表(Hamilton Depression Scale,HAMD)评估,总分<7分患者纳入非抑郁组,共86例。总分≥7分患者纳入抑郁组,共64例。同时抑郁组患者根据HAMD评分进一步分为28例轻度抑郁组(7≤HAMD评分<17分)、24例中度抑郁组(17≤HAMD评分<24分)和12例重度抑郁组(HAMD评分≥24分)。纳入标准:(1)入组患者均符合脑卒中的临床诊断标准;(2)患者为首次发病;(3)既往无神经疾病史。排除标准:(1)患者意识模糊,无法进行交流;(2)严重痴呆患者;(3)失语症患者;(4)合并除抑郁和焦虑之外的精神疾病患者。患者入院后均与院方签署知情同意书,临床研究开展经过我院伦理委员会审核通过。
1.2 血清UA、non-HDL-C及COR水平检测 抽取患者空腹静脉血3 ml,室温静置30 min后,6000 rpm离心15 min,将上清液转移至另一洁净试管中,封口后冻存于-80 ℃。待所有患者的血清样本采集完成后统一进行血清学指标检测。血清UA检测采用磷钨酸比色法,采用UA检测试剂盒(北京雷根生物技术有限公司,货号:TC0713,规格:96T)。通过酶联免疫法检测血清中TC、HDL-C和COR水平,采用TC检测试剂盒(上海酶联生物科技有限公司,货号:ML-ELISA-0011,规格:96T)、HDL-C检测试剂盒[上海通蔚生物科技有限公司,货号:BIO(Tw)-E01(Hu)-03023,规格:96T]和COR检测试剂盒(上海信裕生物科技有限公司,货号:xyA462Ge,规格:96T)分别对血清TC、HDL-C和COR水平进行检测,实验操作严格按照试剂盒使用说明书进行。按照弗洛斯特公式计算non-HDL-C含量,non-HDL-C=TC-(HDL-C)。
1.3 神经功能缺损和生活能力评估 通过美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分对患者的神经功能缺损情况进行评定,总分为42分。0~1分则正常,2~4分之间为轻度缺损,5~15则为中度缺损,16~20分则为中重度缺损,大于20分则为重度神经功能缺损,NIHSS评分越高则表明脑卒中患者的神经功能损伤越严重。通过日常生活活动(Activities of Daily Living,ADL)评分对脑卒中患者的生活能力进行评估,项目内容包括做家务、服用药物、穿衣服、行走、洗澡、上厕所和进食等方面进行综合评估。总分为100分。0≤ADL评分<20分则为完全依赖,20分≤ADL评分<45分则为重度依赖,45分≤ADL评分<70分则为中度依赖,70分≤ADL评分<100分则为轻度依赖,ADL评分=100分则为完全独立,ADL评分越高则患者的生活自理能力越强。
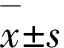
2 结 果
2.1 两组患者的一般资料 非抑郁组患者年龄32~78 岁,平均年龄(56.19±10.82)岁。女性患者37例,男性49例。病程20 d至5个月,平均病程(1.09±0.87)个月。抑郁组患者年龄33~78 岁,平均年龄(56.83±11.26)岁。女性患者27例,男性37例。病程25 d~5个月,平均病程(1.16±0.93)个月。两组患者在年龄、性别比例和病程等一般资料上差异没有统计学意义(P>0.05),具有可比性。
2.2 抑郁及非抑郁组患者的血清UA、non-HDL-C及COR水平比较 抑郁组患者的血清UA、non-HDL-C及COR水平明显高于非抑郁组,组间差异均具有统计学意义(均P<0.05)(见表1)。
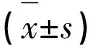
表1 抑郁及非抑郁患者的血清UA、non-HDL-C及COR水平比较
2.3 抑郁及非抑郁组患者的NIHSS评分和ADL评分比较 抑郁组患者的NIHSS评分明显高于非抑郁组患者,而ADL评分明显低于非抑郁组患者,组间差异均具有统计学意义(均P<0.05)(见表2)。
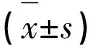
表2 抑郁及非抑郁组患者的NIHSS评分和ADL评分比较
2.4 不同抑郁程度患者血清UA、non-HDL-C及COR水平比较 重度抑郁组血清UA、non-HDL-C及COR水平明显高于中度抑郁组和轻度抑郁组(均P<0.05),而中度抑郁组血清UA、non-HDL-C及COR水平明显高于轻度抑郁组(P<0.05)(见表3)。
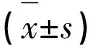
表3 不同抑郁程度患者血清UA、non-HDL-C及COR水平比较
2.5 不同抑郁程度患者的NIHSS评分和ADL评分比较 重度抑郁组NIHSS评分明显高于中度抑郁组和轻度抑郁组(均P<0.05),而中度抑郁组NIHSS评分明显高于轻度抑郁组(P<0.05)。重度抑郁组ADL评分明显低于中度抑郁组和轻度抑郁组(均P<0.05),而中度抑郁组ADL评分明显低于轻度抑郁组(P<0.05)(见表4)。

表4 不同抑郁程度患者的NIHSS评分和ADL评分比较
2.6 血清UA、non-HDL-C及COR水平与NIHSS评分和ADL评分相关性分析 脑卒中抑郁患者NIHSS评分与血清UA、non-HDL-C及COR水平均呈正相关性(均P<0.05),而ADL与血清UA、non-HDL-C及COR水平均呈负相关性(均P<0.05)(见表5、图1)。
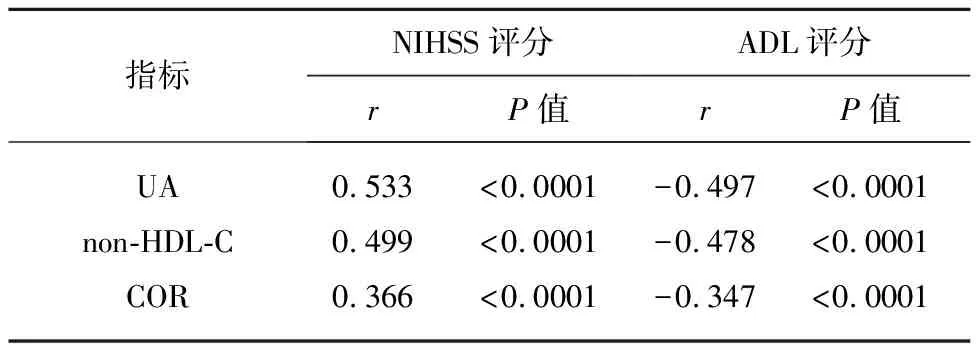
表5 血清UA、non-HDL-C及COR水平与NIHSS评分和ADL评分相关性分析
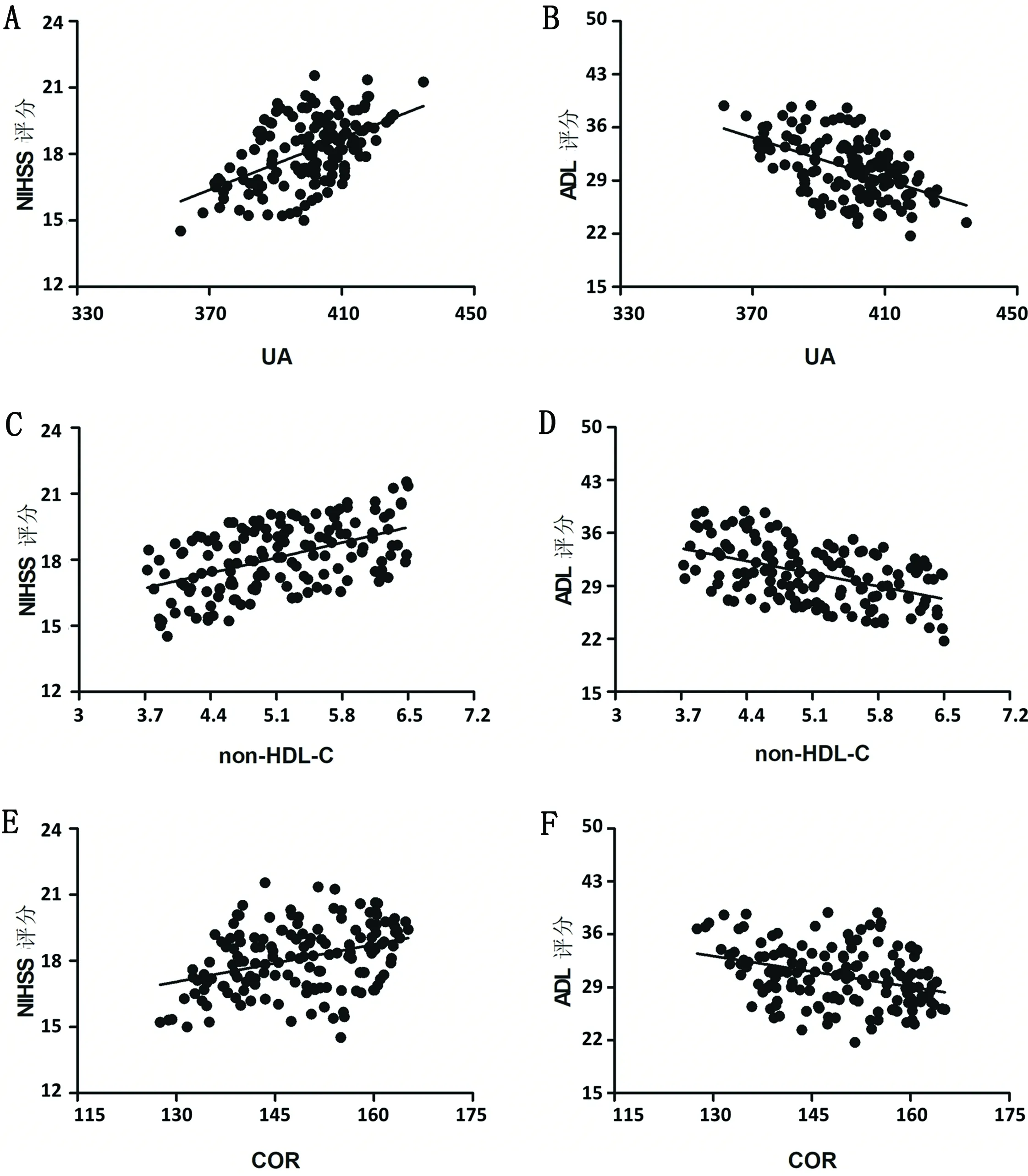
注:(A)血清UA与NIHSS评分的相关曲线图;(B)血清UA与ADL评分的相关曲线图;(C)血清non-HDL-C与NIHSS评分的相关曲线图;(D)血清non-HDL-C与ADL评分的相关曲线图;(E)血清COR与NIHSS评分的相关曲线图;(F)血清COR与ADL评分的相关曲线图。
3 讨 论
脑卒中后抑郁是脑卒中患者的常见并发症之一,脑卒中后抑郁的发生会对患者的生活质量造成严重影响,同时也不利于患者肢体功能的恢复[10]。目前对脑卒中后抑郁的发病机制仍然缺乏了解,文献报道显示脑组织氧化应激的产生、脑部血管炎症反应的发生以及内分泌异常等因素均与脑卒中后抑郁的发生存在相关性[11~13]。为进一步降低脑卒中后抑郁的发生率以及提高脑卒中后抑郁的治疗效果,需要对脑卒中后抑郁的发病机制进行深入探究。
血清UA水平升高与脑卒中的发生发展密切相关,并且能够促进血管炎症反应的发生[14]。本研究发现抑郁组患者血清UA水平明显高于非抑郁组,并且随抑郁程度增加血清UA水平逐渐上升。Guiraud等[15]发现血管炎症反应的发生与脑卒中后抑郁的发生密切相关,脑卒中后抑郁患者血清C反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin 6,IL-6)等炎症因子水平异常升高。Spiga等[16]发现血清UA能够促进血管炎症的发生,UA作用于血管内皮细胞上的糖皮质激素受体蛋白并激活Janus激酶(Janus kinase,JAK)/信号转导和转录活化因子(signal transducer and activator oftranscription 3,STAT3)信号通路,导致细胞释放大量IL-6和TNF-α等炎症因子,促进炎症反应的发生。因此在脑卒中患者体内由于血清中UA水平上升,UA作用于患者脑部血管内皮细胞上的受体蛋白并使其蛋白质构象发生改变,ATP将磷酸基团转移至受体蛋白上并能够招募JAK蛋白并使其磷酸化,通过磷酸化级联反应最终将磷酸基团转移到STAT3蛋白上,磷酸化修饰的STAT3蛋白能够形成同源二聚体并进入到细胞核中,通过其转录激活结构域结合到IL-6和TNF-α基因的启动子上并激活IL-6和TNF-α基因转录,导致IL-6和TNF-α蛋白合成和分泌增加。分泌的IL-6和TNF-α蛋白进入到血管微环境当中,形成局部脑部血管炎症反应。脑部血管持续的炎症反应会阻断神经元的兴奋传导,最终导致患者抑郁的发生[17]。
Non-HDL-C主要包括IDL-C、LDL-C和VLDL等脂蛋白分子,在脑卒中患者诊断中具有一定临床价值。本研究发现抑郁组患者血清non-HDL-C水平明显高于非抑郁组,并且随抑郁程度增加血清non-HDL-C水平逐渐上升。Leónreyes等[18]发现non-HDL-C参与氧化应激的过程,并且是心脑血管疾病的风险因子,non-HDL-C所引起的氧化应激的发生是导致心脑血管疾病发生的影响因素。Liu等[19]发现non-HDL-C等脂蛋白能够被氧化修饰,使得蛋白质功能缺失或下降,导致体内脂质代谢紊乱。因此,在脑卒中患者中由于non-HDL-C水平升高会导致氧化修饰状态的non-HDL-C水平也随之升高。氧化修饰后的non-HDL-C的脂质运输功能受到抑制,导致脑部血管的脂质代谢出现紊乱并引发氧化应激的发生。氧化应激发生过程中会产生大量的氧自由基对神经元细胞造成严重损伤,从而造成神经元细胞的死亡和功能异常,导致神经传输受阻,患者最终出现抑郁症状。
COR由肾上腺皮质分泌产生,在糖类代谢中发挥重要作用。本研究发现抑郁组患者血清COR水平明显高于非抑郁组,并且随抑郁程度增加血清COR水平逐渐上升。Osborne等[20]发现COR和性激素等激素分子能够通过血脑屏障进入脑组织并促进神经元细胞的细胞周期进程,从而促进神经元细胞分裂。Ennis等[21]发现内分泌失调是阿尔兹海默症发病的重要影响因素,COR等激素水平的异常升高会抑制神经元细胞的增殖和神经传导,同时促进神经元细胞的凋亡,导致阿尔兹海默症的发生。因此在脑卒中患者中血清COR水平异常升高会诱导患者的神经元细胞发生凋亡,导致患者神经兴奋传导功能受阻,进而导致抑郁的发生。本研究进一步发现血清UA、non-HDL-C及COR水平均与患者的NIHSS评分呈正相关,而与ADL评分呈负相关,表明血清UA、non-HDL-C及COR水平与脑卒中后抑郁患者的预后存在一定相关性,在脑卒中后抑郁患者的预后预测和诊断中具有重要的临床价值。
综上所述,在脑卒中后抑郁患者中血清UA、non-HDL-C及COR水平明显升高,并且随抑郁程度增加而逐渐升高。同时血清UA、non-HDL-C及COR水平与脑卒中后抑郁患者的NIHSS评分和ADL评分存在一定相关性,在脑卒中后抑郁患者的诊断和治疗中具有一定临床价值。

