4 F MPA1 导管经右肘静脉完成双侧肾上腺静脉同步采血可行性和安全性研究
——附51 例报道
李庆安, 王清鹤, 余 铭, 李禄洪, 温俊伟, 沈双玉, 褚佳丽, 吴俊霞,靳 怡, 李元昊
原发性醛固酮增多症(primary aldosteronism,PA)主要临床表现为高血压和(或)低血钾。PA 分型和病变定位决定了治疗方法选择[1]。 中国PA 诊疗专家共识和国外PA 诊疗指南均推荐肾上腺静脉采血(adrenal venous sampling,AVS)作为PA 功能分型诊断金标准[1-3]。 可能是手术入路不同、使用导管不一等原因, 手术成功率特别是右肾上腺静脉(right adrenal vein,RAV)手术成功率较低[4]。 国内外尚无针对AVS 操作标准化流程的临床指南。 非同步AVS 存在与精神压力相关的人为差异以及醛固酮分泌脉动性对过量醛固酮偏侧化评估的可能[5],双侧同步AVS 更具有挑战性,特别是右肘静脉入路完成双侧同步AVS 鲜有报道。 本研究团队自2021年10 月开始创新性地探索采用2 根4 F MPA1 导管经右肘静脉行同步AVS,截至2022 年10 月已连续累积完成51 例,报道如下。
1 材料与方法
1.1 病例选择
连续入选2021 年10 月至2022 年10 月在襄阳市中心医院需接受AVS 的51 例PA 患者。 男21 例,女30 例,年龄(50.2±9.5)岁(范围30~68 岁)。 所有患者经筛查和盐水负荷/卡托普利试验确诊为PA[1]。本研究经医院伦理委员会批准,所有患者均签署手术知情同意书。
1.2 肾上腺增强CT 检查
排除3 例肾小球滤过率估计值(eGFR)<60 mL/(min·1.73 m2)患者,48 例AVS 术前接受肾上腺增强CT 检查。 参照Ota 等[6]肾上腺增强CT 评价标准,45 例右肾上腺中央静脉(right adrenal central vein,RACV)可显示,3 例显示不清或未见显示。本研究团队根据RACV 汇入下腔静脉(inferior vena cava,IVC)位置、 与副肝静脉关系以及RACV 走行, 提出RACV 三型分型法(见图1、2)。 本研究中Ⅰ型28 例,Ⅱ型12 例,Ⅲ型5 例。

图1 RACV 三型分型法
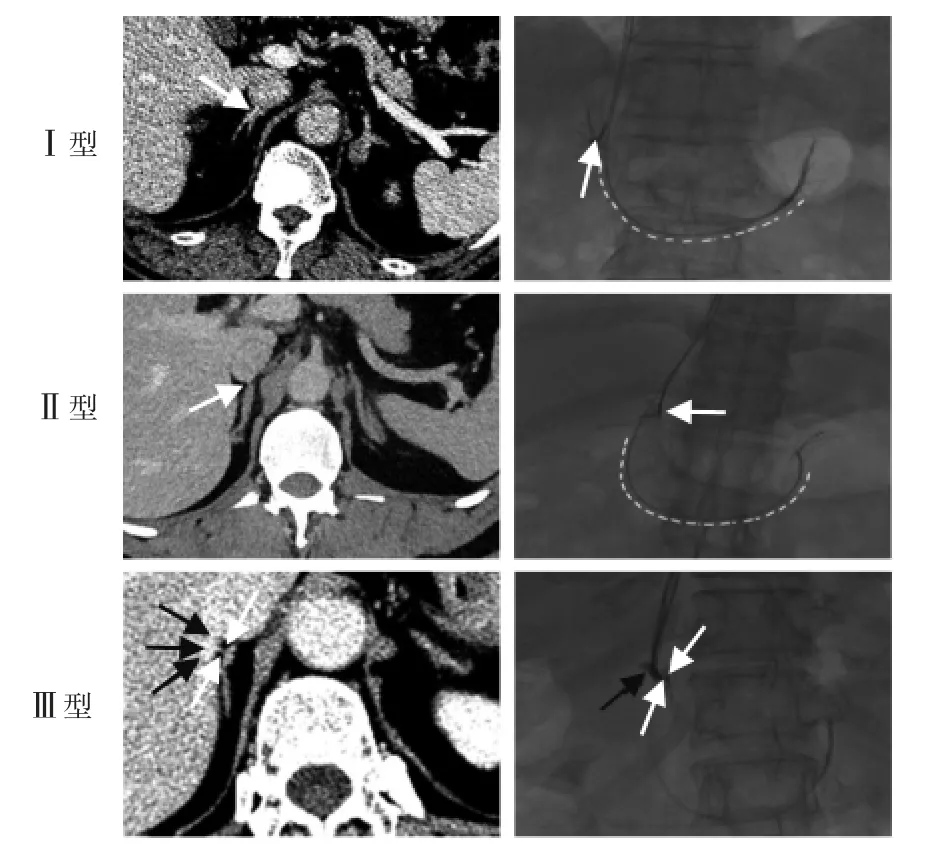
图2 RACV 三型分型CT 及DSA 影像
1.3 AVS 操作技巧
经右肘静脉建立2 个静脉入路,肘静脉显露不清楚或有解剖变异穿刺有困难时,可在TUORen 彩色多普勒超声导引下完成。 静脉入路见表1,具体穿刺位置见图3。 静脉入路建立后,注入普通肝素3 000 U 预防血栓形成。

表1 AVS 静脉入路

图3 经右肘静脉穿刺并置入鞘管
在距4 F MPA1 导管(Cordis 公司,美国)尖端2~3 mm 处制作2 个侧孔,当端孔嵌顿或血管塌陷时,可经侧孔采样;将1 根4 F MPA1 导管(见图4①)头端塑形成直径6~7 cm 猪尾形圆圈(见图4②),作为左肾上腺静脉(left adrenal vein,LAV)导管使用[7]。

图4 导管塑形
肾上腺静脉插管技术:0.035 英寸导丝导引下,操作导管依次通过上腔静脉、右心房,到达IVC 在第1 腰椎水平处备用;先操作塑形后导管使导管进入左肾静脉,继续旋转推送导管使导管尖端缓慢爬升,即可进入左肾上腺总干静脉;缓慢注射1~2 mL非离子型碘对比剂显示左肾上腺总干静脉、左膈下静脉、左肾上腺中央静脉(right adrenal central vein,LACV),继续操作导管或在导丝导引下,导管凭借体外特殊塑形超选择进入LACV(见图2)。依据CT 提供的RACV 分型信息,操作4 F MPA1 导管(见图4①),发现导管有“勾挂”“跳跃”现象时,再轻轻推送导管,X 线透视下观察导管尖端稳定后缓慢注射非离子型对比剂0.5~1 mL,通过正位、右前斜30°静脉造影显示RAV, 避免过度超选至肾上腺静脉分支。对于RACV Ⅲ型患者,先插管至副肝静脉,采取边后退边顺时针旋转导管方式,或专注于副肝静脉开口附近,寻找并插管至RACV(见图5)。
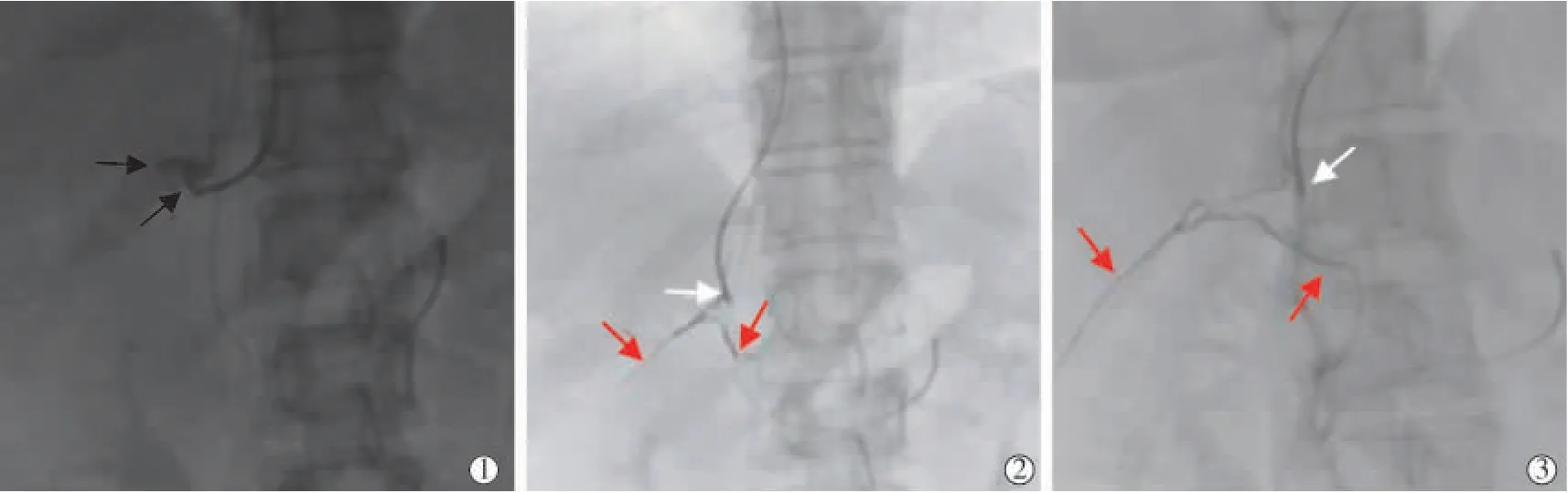
图5 RACV Ⅲ型插管影像
分3 个时间区间同时(同步)采集LAV、RAV、外周静脉血样。 第1 时间区间:核实双侧导管尖端均分别在RAV、LACV 位置后, 同时采取自然流出法(平置导管并下垂导管尾端让血液自然流出)留取双侧肾上腺静脉血样,并从鞘管留取外周静脉血样,各采集血样4~6 mL;第2 时间区间:按前述方案采集血样1 次;第3 时间区间:右侧导管尖端仍位于RAV, 左侧导管尖端调整至左肾上腺总干静脉,再次采集血样。 术毕右肘静脉穿刺点适度加压包扎,不需卧床制动。
AVS 成功的判断标准:肾上腺血浆皮质醇浓度(plasma cortisol concentration,PCC)与外周PCC 比值即选择指数(selection index,SI)≥2 ,为单侧AVS成功[1]。 同步AVS 采血成功定义:双侧肾上腺在3 个时间区间至少有1 个时间区间同时采血成功。 统计穿刺部位并发症(出血、血肿、静脉炎、周围神经损伤等)、肾上腺静脉插管部位并发症(静脉破裂、血肿、梗死等)及全身并发症(脑出血、死亡等)发生情况。
1.4 统计学方法
采用SPSS 25.0 软件进行统计学分析。 计量资料若符合正态分布以±s 表示, 不符合正态分布则以M(P25,P75)表示,各比率以百分比表达。 P<0.05为差异有统计学意义。
2 结果
2.1 导管选择、同步采血成功率
RAV 均使用4 F MPA1 导管,左肾上腺总干静脉及LACV(1 例LACV 缺如)均使用经特殊塑形的4 F MPA1 导管。 AVS 失败原因分析见表2。 双侧同步AVS 成功率为92.2%(47/51), 结果分析见表3。未见导管打折或折断现象。

表2 AVS 失败原因分析

表3 双侧同步AVS 结果分析
2.2 并发症发生情况
1 例患者在采血结束造影复核导管位置时发生RAV 破裂,形成肾上腺血肿(见图6),表现为对比剂局部滞留及腰背部疼痛, 经止痛后3 d 疼痛逐渐消失, 未遗留后遗症,AVS 参数及结果解读见表4。未见其他并发症发生。

表4 1 例双侧同步AVS 发生肾上腺血肿患者AVS 参数及结果解读

图6 肾上腺静脉分支破裂、血肿形成影像
3 讨论
AVS 是PA 分型的关键环节, 但因操作技术难度大,导管选择复杂,手术成功率低[4]。 AVS 技术在国内乃至国际上并未得到大范围普及, 双侧同步AVS 可消除与不同采样时间相关的偏差[8]。 但右上肢入路行同步AVS 的前提是建立可容纳至少2 个4 F 导管的静脉通路, 国内大部分医学中心在术前由护士在病房对患者建立1 个静脉入路,手术时再由医师采用导丝-鞘管交换技术置入鞘管[9-10]。 本研究中均由手术医师在手术时建立静脉入路,并把超声技术用于右肘静脉穿刺中。 右肘静脉由头静脉、肘正中静脉、贵要静脉组成,头静脉位置较表浅,显露良好,51 例患者中有37 例在头静脉建立至少1 个静脉入路,头静脉使用率达72.5%(37/51),但头静脉直径差距较大、易痉挛,直径粗的可容纳2 个6 F 血管鞘或1 个9 F 血管鞘, 有1 例因头静脉纤细穿刺困难,另1 例在插管过程中痉挛严重导致由同步AVS 改为非同步AVS 方案[7]。 4 F MPA1 导管较同样形状的5 F 导管更细, 容易通过细小甚至痉挛的头静脉,使得经上肢静脉建立2 个路径行同步AVS 成为可能,这也是本研究团队选择该型导管的原因之一。贵要静脉粗、直,部分患者位置深需要超声导引,本研究中有13 例患者仅在该静脉就可建立2 个入路,随着超声导引静脉穿刺技术积累,自第21 例患者起, 未再出现经右肘静脉建立2 个静脉通路失败案例。56.67%(17/30)女性和28.57%(6/21)男性患者需要超声导引穿刺置入鞘管, 说明上肢入路行同步AVS 特别是在女性患者,彩色多普勒超声是开展该技术的必备仪器。 与患者手术成功率、创伤相比,在超声设备日益普及的今天,该缺陷实属微不足道。
RAV 形态细、短,且常存在解剖变异[4],使得右侧插管成功率不甚理想[11]。 肾上腺增强CT 空间分辨率高,可清楚地显示RAV 形态及位置,被列为评价PA 的首选影像方法[3]。本研究团队提出的RACV三型分型法对AVS 操作指导性强、简单、实用,手术医师在术前仔细判读CT 影像信息, 掌握RACV 分型类别,仔细分析RACV 汇入IVC 的位置、方向,有助于寻找RACV 开口, 特别是针对RACV Ⅲ型患者。本研究中RACV Ⅲ型有5 例(11.11%),Miotto等[12]报道类似比例为12.1%,表明RACV 解剖变异比例较高,开口隐蔽,易被忽略,术者往往花费大量时间和精力在其他地方寻找RACV,这可能是AVS技术难度大、手术成功率低、难于推广的原因。 针对5 例RACV Ⅲ型患者, 本研究凭借4 F MPA1 导管形状、柔韧性及操控性,并未回避而是有意寻找到副肝静脉,先插管至副肝静脉,通过边后退边顺时针旋转导管方式, 或专注于副肝静脉开口附近,均寻找到RACV 开口并插管至RACV,结果4 例采血获得成功(见图2),1 例根据正位、右前斜30°肾上腺静脉造影形态[13]和肾包膜静脉显现[14]提示插管成功(见图5),但SI(1.43)<2,判定为采血失败。 可能原因:由于类固醇肝脏代谢,副肝静脉血液携带的PCC 远低于全身静脉和肾上腺静脉血液,导致肾上腺和IVC 间PCC 显著降低[12]。
关于LAV 采血,美国、日本内分泌学会指南分别推荐于总干静脉、LACV 采血,本研究采用RACV分别与左总干静脉和LACV 同步采血, 并且RACV与LACV 同步采血2 次。 塑形成猪尾形圆圈的导管在形态上顺应了IVC→左肾静脉→左肾上腺总干静脉→LACV 的解剖结构要求, 导管柔顺性和操控性达到较好平衡,操控其可使其尖端到达左肾上腺总干静脉,继而到达LACV。 1 例LACV 插管影像提示成功,但SI(1.15)<2,表明采血失败,可能的原因为肾上腺静脉通过除中央静脉外的其他邻近静脉丛回流[15],或导管过度超选,仅采集腺体某一无异常区域的静脉血[16],采血结果的准确性降低。 上肢入路行LAV 插管,国内大多数开展AVS 的医学中心最常选择的导管为5 F TIG 导管(日本Terumo 公司),由于其特殊形状,经右肘静脉进入左肾上腺总干静脉较为容易,但质地较硬,部分病例在进一步进入LACV 时较为困难[9,17]。 何际宁等[18]报道56 例左侧AVS 中有16 例(28.6%)需要联合使用微导管超选择至LACV, 以降低导管对血管的损伤及易于在中央静脉内调整导管,无形中会增加操作时间及医疗费用。本研究中未使用微导管,对4 F MPA1 导管加以塑形,左肾上腺总干静脉采血成功率即可达98%(50/51),LACV 采血成功率为98%(49/50,1 例LACV 缺如);92.2%(47/51)患者使用同一型号2 根4 F MPA1 导管,即可完成双侧同步AVS。
AVS 最常见并发症为肾上腺静脉破裂形成血肿。 本研究中发生1 例肾上腺血肿,影像信息提示RAV 细小分支破裂出血(见图6),分析其与对比剂注入过多过快有关,与导管选择无关。因此,术者应熟悉肾上腺静脉解剖及变异特点, 术中操作仔细轻柔,以减少并发症发生。未因导管人工塑形及仅为4 F,发生导管打折、折断现象。 未见其他并发症发生。
利用增强CT 提供的肾上腺静脉解剖信息,超声导引下于上肢肘静脉建立2 个静脉入路,充分发挥4 F MPA1 导管性能, 再加上驾驭导管的技能娴熟,是该技术得以成功的关键。
但经右肘静脉行同步AVS 亦有不足之处:①上肢静脉入路行RACV 插管时,体外导管操作方向与体内导管尖端运动方向相反,需要反复体会揣摩,方能提高导管操控能力;②上肢入路时,导管尖端易受呼吸运动影响, 采血过程中有脱离RACV 可能; ③部分患者右肘静脉显露不清楚、 有解剖变异,使得肘部静脉穿刺置管困难,需借助彩色多普勒超声导引;④4 F MPA1 导管管径较细,有形成血栓可能。
总之, 本研究创新性地选择2 根4 F MPA1 导管即可经右肘静脉完成双侧同步AVS,使原本导管选择复杂、操作繁琐、手术成功率低、不易推广的手术变得简单,具有手术成功率高、创伤小、不需卧床制动等优点,具有较好的临床应用前景。

